Szilárd-folyadék egyensúly
Kapcsolódó kifejezések:
- Fázisdiagramok
- Ionos folyadék
- Oldékonyság
- Gőznyomás
- Fázis egyensúly
- Államegyenlet
- Folyadék-folyadék egyensúly
- Termodinamika
Letöltés PDF formátumban
Erről az oldalról
FÁZISDIAGRAMOK MEGHATÁROZÁSA REAKTÍV VAGY VOLÁLIS ELEMEKKEL
Szilárd – folyékony egyensúlyok 315
A szilárd anyag súlyvesztése folyadékkal történő egyensúlyozás után 315
Elkülönített folyadék kémiai elemzése 316
A kioltott minták kémiai elemzése 318
Hőelemzés 319
Elektromotoros erő 320
Elektromos ellenállás 321
Anódos oxidáció 321
Mágneses érzékenység 323
Hígítás entalpia 325
Az ötvözet bomlásának vagy képződésének kinetikája 325
Diffúziós együttható 327
Gőznyomás 327
Röntgenabszorpciós spektrometria 328
Optikai fényvisszaverő képesség 328
Korróziós tesztek 328
Folyékony fémzárványok mozgása az ionos kristályokban 330
Minta előkészítés kromatográfiával
Serban C. Moldoveanu, Victor David, a Journal of Chromatography Library, 2002
Folyadék-szilárd egyensúly kétkomponensű rendszereknél
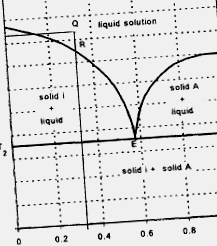
A kétkomponensű rendszer szilárd-folyadék egyensúlyát, amelyben a folyadékok elegyednek, és a szilárd-szilárd oldhatóság elhanyagolható, általában az 1.3.4. Ábrán bemutatott diagramm írja le. Az ilyen típusú diagram által leírt folyamatban a nyomást állandó értéken tartják (a szabadság fokainak maximális száma három). A T1 hőmérsékleten lévő Q pontnál az anyag megolvad. A hőmérséklet csökkenésével az összetétel változatlan marad az R pontig, ahol a szilárd „i” kristályosodni kezd, és a készítmény az RE vonal mentén az E pontig (eutektikus pontig) módosul. Amikor a hőmérséklet eléri az eutektikus pontnak megfelelő T2-t, az egész anyag szilárdvá válik. Az E pontnak megfelelő oldat összetétele eutektikus összetételként ismert. A T2 alatti anyag szilárd anyag, amely tiszta „i” kristályokból, valamint az „i” és „A” mikrokristályos keverékéből áll, eutektikus összetételű.
1.3.4. Ábra Kétkomponensű rendszer szilárd-folyadék egyensúlyának diagramja, amelyben a folyadékok elegyednek és a szilárd anyag szilárd oldhatósága elhanyagolható.
Diffúzió nanoporózus gazdarendszerekben
2.2 Folyadék-szilárd egyensúly
A folyadék-szilárd egyensúly zárt térben kevésbé érthető, összehasonlítva a gáz-folyadékéval. Ennek egyik különös oka a folyadék-szilárd átmenetek bonyolultsága, amelyek még ömlesztett állapotban is meglehetősen eltérő tulajdonságokat mutathatnak, például a fázisátalakulásokhoz vezető különböző mechanizmusokból. 68 Tehát az azonos atomokból vagy molekulákból álló szilárd anyagoknak vagy molekuláris kristályoknak meglehetősen eltérő kristályszerkezete lehet, amelyet tovább meghatározhatnak a bezárások, beleértve a korlátozó terek geometriáját és a felületi kémiát. 69–73 A következőkben azonban nem foglalkozunk mindezekkel a finom részletekkel, például az atomszerkezetekkel, és csak a pórusméret, a pórusmorfológia és a makroszkopikus folyadék tulajdonságai, valamint a fagyás és az olvadás viselkedése közötti általános összefüggésekre szorítkozunk. Különösen csak a pórusfalakat nedvesítő folyadékokat vesszük figyelembe.
Ilyen körülmények között a probléma a bezárt gáz-folyadék átmenetekre emlékeztet. 74 Ez az analógia abból a tényből fakad, hogy a kis pórusokban a gáz-folyadék átmeneti pontok elmozdulásait első megközelítésben a Kelvin-egyenlet rögzíti. A szilárd-folyékony egyensúly leírása hasonlóan elvégezhető az azonos szerkezetű Gibbs – Thomson egyenlet felhasználásával. Mindkettő előrejelzi, hogy az átmeneti nyomás és a hőmérséklet pórusmérettől függő eltolódásai arányosak a fordított pórusmérettel, ami a térfogat és az interfész szabad energiák közötti versengésből adódik. Emellett számos kísérleti bizonyíték van arra vonatkozóan, hogy a többrétegű adszorpció teljes analógiájával a felületi 75 előolvadás jelensége folyadékszerű, rendezetlen réteg létezéséhez vezet a pórusfalak és a fagyott kristályos mag között. pórus belseje, amelynek célja a teljes energia minimalizálása a szilárd anyagok közötti kristályszerkezetek eltérése miatt. 76–78. Tehát az előző szakaszban tárgyalt számos jellemző itt is érvényes, ezért csak röviden tárgyaljuk.
A makroszkopikus termodinamika alapján a porózus szilárd anyagokban lévő folyadékok szilárd – folyadék egyensúlyának megértésének egyik központi kérdése az egyensúlyi átmeneti hőmérséklet helye. A gázszorpcióban az ideális pórusszerkezetű anyagok esetében ez kapilláris párolgással jár. Összességében a fagyás átmenetet társíthatjuk az egyensúlyi átmenethez (feltételeznünk kell azonban, hogy a magfagyasztott fázis a pórusnyílásoknál van ellátva a gócképződés késleltetésének elkerülése érdekében). 79 Tehát a fagyasztó-olvadó hiszterézis metastabilitása késleltetett olvadással jár, mivel a pórusokban a fagyasztott folyadékkal rendelkező magrészekben a folyadék „hídjainak” maggátlásához szükséges szabad energia akadályai vannak. Külső fagyott fázis hiányában a pórusnyílásoknál a késleltetett homogén magképződés következtében a kritikus feletti pórusméreteknél pórusmérettől függő metastabil fagyás figyelhető meg. 80 Meg kell azonban jegyezni, hogy ezt a képet nem támogatták maradéktalanul, és az együttélési hőmérsékletet az olvadás hőmérsékletével is összefüggésbe hozták (lásd pl. A 81., 82. hivatkozást).
- Rubus Chamaemorus - áttekintés a ScienceDirect témákról
- Tisztító és csapdázó technika - áttekintés a ScienceDirect témákról
- Pyelonephritis - áttekintés a ScienceDirect témákról
- Nátrium-tioszulfát - áttekintés a ScienceDirect témákról
- Nátrium-tioszulfát - áttekintés a ScienceDirect témákról