Szív metabolikus modulációja alacsony szénhidráttartalmú, alacsony fehérjetartalmú ketogén étrenden cukorbeteg patkányokban in vivo hiperpolarizált 13 C piruvát, butirát és acetoacetát szondákat alkalmazva
Funkcionális anyagcsere csoport, Szingapúr Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, Szingapúr
Funkcionális anyagcsere csoport, Szingapúr Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, Szingapúr
Funkcionális anyagcsere csoport, Szingapúr Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, Szingapúr
Funkcionális anyagcsere csoport, Szingapúr Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, Szingapúr
Funkcionális anyagcsere csoport, Szingapúr Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, Szingapúr
Funkcionális anyagcsere csoport, Szingapúr Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, Szingapúr
Kardiológiai Osztály, Szingapúr Nemzeti Szívközpont, Szingapúr
Funkcionális anyagcsere csoport, Szingapúr Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, Szingapúr
Levelezés
Philip T. H. Lee, PhD, Szingapúri Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, 11 Biopolis Way # 02-02, 138667 Szingapúr
Funkcionális anyagcsere csoport, Szingapúr Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, Szingapúr
Funkcionális anyagcsere csoport, Szingapúr Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, Szingapúr
Funkcionális anyagcsere csoport, Szingapúr Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, Szingapúr
Funkcionális anyagcsere csoport, Szingapúr Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, Szingapúr
Funkcionális anyagcsere csoport, Szingapúr Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, Szingapúr
Funkcionális anyagcsere csoport, Szingapúr Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, Szingapúr
Kardiológiai Osztály, Szingapúr Nemzeti Szívközpont, Szingapúr
Funkcionális anyagcsere csoport, Szingapúr Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, Szingapúr
Levelezés
Philip T. H. Lee, PhD, Szingapúri Bioimaging Consortium, Tudományos, Technológiai és Kutatási Ügynökség, 11 Biopolis Way # 02-02, 138667 Szingapúr
Absztrakt
Hosszú távú alacsony szénhidráttartalmú, alacsony fehérjetartalmú ketogén étrend (KD) hatásának vizsgálata karcsú diabéteszes Goto ‐ Kakizaki (GK) patkányokban a szív metabolizmusára és a diabéteszes kardiomiopátia állapotára.
Anyagok és metódusok
A cukorbeteg GK patkányokat KD-vel etették 62 hétig. A szívműködést és az anyagcserét mágneses rezonancia képalkotással és 13 C mágneses rezonancia spektroszkópiával (13 C-MRS) értékeltük nyugalmi állapotban és dobutamin stressz alatt. 13 C-MRS-t hiperpolarizált [3-13 C] acetoacetát, [1-13 C] butirát vagy [1-13C] piruvát injekcióját követően végeztünk a keton test, a rövid szénláncú zsírsav vagy a glükóz felhasználásának felmérésére. A fehérje expressziót és a kardiomiocita struktúrát Western-blottolással, illetve szövettan segítségével határoztuk meg.
Eredmények
A KD csökkentette a vércukor-, triglicerid- és inzulinszintet, miközben növelte a vér ketonszintjét. KD-vel táplált diabéteszes patkányokban a miokardiális keton test és a glükóz oxidációja alacsonyabb volt, mint a chow táplált cukorbeteg patkányokban, míg a miokardiális glikolízis és a rövid láncú zsírsav oxidációja nem változott. A dobutamin stressz fokozott szívterhelést és csökkent szívműködést mutatott KD-vel táplált cukorbeteg patkányokban. A szívizom glikolízisének dobutamin-indukálta stimulációja nagyobb mértékben fokozódott a KD-vel táplált diabéteszes patkányokban, mint a chow-táplált diabéteszes patkányokban, amit potenciálisan megkönnyített a glükóztranszportban részt vevő fehérjék bazális expressziójának és a KD-vel táplált patkányok szívének glikolízisében bekövetkező upreguláció. . A KD által kiváltott metabolikus profil kardiális hipertrófiával, a szívizom lipid- és kollagéntartalmának növekedésével, valamint az oxidatív stressz fokozott markerével járt együtt.
Következtetés
Úgy tűnik, hogy a KD súlyosbítja a diabéteszes kardiomiopátiát GK patkányokban, ami összefüggésbe hozható a maladaptív kardiális metabolikus modulációval és a lipotoxicitással.
1. BEMUTATKOZÁS
A cukorbetegség a szív- és érrendszeri betegségek kockázati tényezője. 1 A diabéteszes szívben az alapul szolgáló kardiovaszkuláris állapotok hiánya ellenére kardiomiopátia alakulhat ki, ami annak tulajdonítható, hogy fokozottan preferálja a zsírsav-anyagcserét. 2 A szívelégtelenség kialakulása a szív szubsztrátjának megváltozott anyagcseréjével is összefüggésbe hozható. 3 Megjegyzendő, hogy a keton testek kardiometabolikus egészségben betöltött szerepe is egyre inkább felértékelődik. 4, 5 Embereken és állatokon végzett vizsgálatok a miokardiális keton test hasznosításának előrehaladását mutatják előrehaladott szívelégtelenségben. 6, 7 Azonban még nem világos, hogy a kudarcot szenvedő szívben a keton testhasználatának növekedése adaptív vagy rosszul alkalmazkodó-e. Patkányokban végzett ischaemia-reperfúziós kísérletek során az éhgyomri okozta ketózis 8 és a β-hidroxi-butirát (β-OHB) 9 intravénás injekciója enyhítheti az iszkémiás károsodást. Egy nemrégiben végzett klinikai vizsgálatban a nátrium-glükóz ko-transzporter-2 (SGLT2) gátló empagliflozin jótékony hatását a cukorbetegségben szenvedő betegek szív- és érrendszeri kimenetelére 10 szintén összefüggésbe hozták hiperketonémiával. 11 A legújabb tanulmányok azonban azt mutatták, hogy a hiperketonémia ellenére az empagliflozin 12-es szintet csökkent, vagy nem változtatta meg a szívizom keton testének kihasználtságát a cukorbetegség rágcsáló-modelljeiben.
A ketogén étrend (KD) egyre népszerűbb a cukorbetegség kezelésében. 14 A betegeknél a KD kimutatta a testtömeg-csökkenést, bár a KD előnyei meghaladhatják a testtömeg-csökkenést, például a szív- és érrendszeri betegségek (CVD) kockázatának csökkenését. 15-17 Érdekes, hogy a KD CVD-kockázatokkal ellentétes hatásait egereknél is jelentették. 17–21. A CVD kockázatával kapcsolatos ellentmondásos megállapítások ellenére jelenleg korlátozott kutatások folynak a KD szívfiziológiára gyakorolt hatásáról. A KD által kiváltott magas ketontartalmú, valamint alacsony szénhidráttartalmú és magas zsírtartalmú környezet hosszú távon kiválthatja a szív metabolikus alkalmazkodását, ami a diabéteszes szívben előnyös lehet vagy nem. Itt arra kerestük a választ, hogy a KD képes-e modulálni a szív szubsztrát metabolizmusát és/vagy indukálhat-e funkcionális változásokat a diabéteszes szívben. Erre a célra a diabétesz és a diabéteszes kardiomiopátia sovány rágcsáló modelljét, Goto ‐ Kakizaki (GK) patkányokat használtuk. 22-24 A sovány diabéteszes modellt választották az elhízás zavaró hatásainak csökkentésére a megállapításokra.
2. ANYAGOK ÉS MÓDSZEREK
2.1 Állatok
A Taconic (New York) által tenyésztett hím sovány diabéteszes Goto ‐ Kakizaki (GK/MolTac) patkányokat az InVivos-tól (Szingapúr) vásárolták. 12 hetes kortól kezdve chow-diétával (N = 4; Patkány-/egér-diéta # 1324 mod., Altromin, Németország; 16 kcal% zsír, 21 kcal% fehérje, 63 kcal% szénhidrát) vagy alacsony szénhidrát alacsony fehérjetartalmú ketogén étrend (LCLPKD; a továbbiakban KD; N = 6; AIN-76A módosított # F3666, Bio-Serv, New Jersey; 93,5 kcal% zsír, 4,7 kcal% fehérje, 1,8 kcal% szénhidrát) 62 hetek ad libitum. A diéta 53. hetétől kezdve a KD hosszú távú hatásait MRI és hiperpolarizált 13 C-MRS alkalmazásával értékeltük nyugalmi körülmények között vagy dobutamin infúzióval (135 μg/kg/perc, 1 mg/ml koncentrációban; összesen dózis: 1,35-2,7 mg/kg). A vizsgálat végén szerv- és vérmintákat gyűjtöttünk táplált állapotban. Az állatokkal kapcsolatos összes eljárást az A * STAR Intézményi Állattenyésztési és Felhasználási Bizottság hagyta jóvá (# 171204).
2.2 In vivo MRI és hiperpolarizált 13 C-MRS
Az MR méréseket 9,4 T MR szkenneren (Bruker, Németország) végeztük izoflurán altatásban. Két infúziós vonalat készítettek farokvénákban hiperpolarizált 13 C szubsztrátok és dobutamin beadására. FLASH MRI-t készítettünk a dobutamin infúzió előtt és alatt 10-20 perc alatt a szívműködés mérésére (53-54 hetes étrendnél). A szívszubsztrát kihasználtságának mérése érdekében megkezdték a szív által kiváltott 13 C-os impulzusszerzéses spektroszkópiát, amelyet azonnal hiperpolarizált [3-13 C] -acetoacetát (3 μl/g 53-54. Hét diéta) injekciójával, [1-13 C] piruvát (7 μL/g 57-58 hetes étrend mellett) vagy [1-13 C] butirát (7 μL/g az étrend 61-62 hetében). Minden hiperpolarizált szubsztrátum 13 C-MRS-ét két különböző körülmények között, egy hét különbséggel megismételtük 20 perc sóoldatos infúzió (nyugalmi állapot) vagy dobutamin infúzió (stressz állapot) után. A pihenés vagy a stressz kísérletek sorrendje véletlenszerű volt. A cine MRI, a hiperpolarizált 13 C szubsztrát előkészítés és a 13 C ‐ MRS részleteit a cikk kiegészítő információi tartalmazzák.
2.3 Vérelemzés
A szérummintákat a dobutamin infúzió előtt és 20 perces dobutamin infúzió után, valamint a vizsgálati időszak alatt néhány időpontban (etetett vagy éheztetett körülmények között) gyűjtöttük. A vércukorszintet, a triglicerideket (TG) és a β-OHB-t méterekkel határoztuk meg. A szérum-acetoacetátot, a szabad zsírsavat (FFA), az ANP-t és az inzulint vizsgálati készletek segítségével határozták meg (lásd a cikket alátámasztó információkat).
2.4 Ex vivo szövetanalízis
Az érdekes fehérjék expresszióját Western-blot segítségével határoztuk meg. A szív-szukcinil-CoA-3-oxálsav CoA transzferáz (SCOT) aktivitást a korábban leírtak szerint hajtottuk végre. 28 A szív-piruvát-dehidrogenáz (PDH) aktivitását és a szív triglicerid szintjét meghatározó tesztkészletek segítségével határoztuk meg. Sirius Red hisztológiát végeztek a fibrózis felmérésére. A szövetanalízis részleteit a kiegészítő anyagok tartalmazzák (lásd a cikket támogató információkat).
2.5 Statisztika
A statisztikai elemzést Student's t-teszttel végeztük ex vivo adatokra. Ismételt intézkedéseket az ANOVA-t használtak az in vivo és a szérum adatok elemzésére (diétás hatások: chow vs. KD, dobutamin hatások: pihenés/fiziológiás sóoldat vs dobutamin), kivéve a 13 C piruvát MRS-t, ahol egy közönséges kétutas ANOVA-t használtak, mert két az állatokból hiányoztak a többi vagy a dobutamin adatok. Ha az interakció időtartama szignifikáns volt, Bonferroni-korrigált többszörös összehasonlítást végeztek. Az adatkorrelációkat Pearson-korrelációval hajtottuk végre. Statisztikai szignifikanciát P
3 EREDMÉNYEK
3,1 KD befolyásolta a testsúlyt és a vérparamétereket
Kezdetben a KD alacsonyabb testsúlyt eredményezett a KD-vel táplált diabéteszes patkányokban, mint a chow-táplált cukorbeteg patkányokban (P 1. táblázat: Vérparaméterek, szervtömeg, fehérje expresszió, fehérje aktivitás, lipid tartalom és fibrózis, 60-63 hetes diéta után meghatározva
3,2 KD attenuált dobutamin indukálta végdiasztolés térfogat csökkenés
Nyugalmi állapotban nem volt különbség a szívfunkció paramétereiben a KD-vel táplált diabéteszes és a chow-táplált diabéteszes patkányok között (2. táblázat). A dobutamin infúzió 25% -kal növelte a pulzusszámot és az étrendtől független ejekciós frakciót (2. táblázat). Dobutamin csökkent végdiasztolés térfogat (EDV) (P 2. táblázat: A bal kamrai funkció paraméterei nyugalmi állapotban és dobutamin stressz alatt MRI-vel mérve
3,3 KD és a dobutamin stressz csökkentette a szívizom keton testének oxidációját a TCA ciklusban
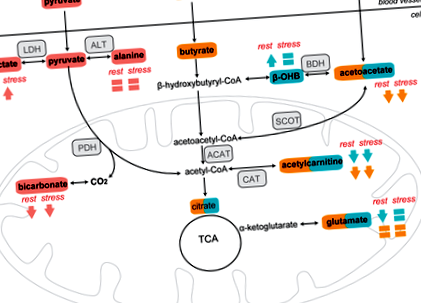
A KD szív keton test metabolizmusára gyakorolt hatásainak vizsgálatához szív 13 C ‐ MRS-t végeztünk hiperpolarizált [3–13 C] acetoacetát injekciója után (1. ábra, kék útvonalak). [1-13 C] Acetilkarnitin (172,6 ppm), [5-13 C] glutamát (a trikarbonsav [TCA] ciklus terméke; 181,2 ppm) és [3-13 C] β-OHB (68,5 ppm) láthatóak szív 13 C MR spektrumok 1 percen belül a [3-13 C] -acetoacetát (209,9 ppm) beadása után (2A, B ábra).
Nyugalmi állapotban a KD-vel táplált cukorbeteg patkányok 34% -kal alacsonyabb [5-13 C] glutamáttermelést mutattak (P = 0,001 vs. chow-táplált cukorbeteg patkányok; Ábra) és 42% -kal alacsonyabb [1-13 C] acetil-karnitin termelés (általános diétás hatás: P A 13 C] β-OHB termelés 75% -kal volt magasabb a KD-vel táplált diabéteszes patkányokban, mint a chow-táplált diabéteszes patkányokban (P 13 ° C] glutamáttermelés 47% -kal chow-táplált cukorbeteg patkányokban (P 13 C] acetilkarnitin termelés 51% -kal (általános dobutamin hatás: P = 0,01; Ábra). A [3-13 C] β-OHB termelés 88% -kal nőtt dobutamin stressz alatt a szoptatott cukorbeteg patkányokban (P
3,4 KD nem befolyásolta a szívizom rövid láncú zsírsav-oxidációját a TCA-ciklusban
Szív 13 C ‐ MRS-t végeztünk hiperpolarizált [1–13 C] butirát beadását követően (1. ábra, narancssárga utak). Az [1-13 C] butirát metabolizmusának metabolikus termékei (azaz [1-13 C] acetoacetát (174,6 ppm), [1-13 C] acetilkarnitin (172,6 ppm) és [5-13 C] glutamát (181,2 ppm)) az [1–13 C] butirát (184 ppm) beadása után 1 percen belül számszerűsíthető a 13 C MR spektrumokban (3A, B ábra).
Az [1–13 C] butirát injekciója esetén az [1–13 C] -acetoacetát és az [1–13 C] acetil-karnitin termelése 31% -kal, illetve 37% -kal alacsonyabb volt KD-vel táplált cukorbeteg patkányokban, mint tehénnel táplált patkányokban cukorbeteg patkányok (általános étrendi hatás: P = 0,002 és P A 13 C] glutamát mindkét csoportban hasonló volt, és a dobutamin stressz nem változtatta meg (ANOVA P = 0,43; 3E. Ábra), amely arra utal, hogy a KD nem befolyásolta a szívizom rövid láncú zsírsav-oxidációját a TCA-ciklusban.
3,5 KD csökkentette a glükóz oxidációját nyugalmi állapotban, miközben fokozta a glikolízist dobutamin stressz alatt
A szívizom glükóz metabolizmusának felméréséhez 13 C-MRS-t végeztünk hiperpolarizált [1-13 C] piruvát injekcióját követően (1. ábra, rózsaszínű utak). A metabolikus termékek (azaz [1-13 C] laktát (183 ppm), [13C] hidrogén-karbonát (160 ppm) és [1-13 C] alanin (177 ppm)) termelése 1 percen belül megfigyelhető [1 - 13 C] piruvát (170 ppm) beadása (4A, B ábra).
Nyugalmi állapotban az [1–13 C] laktát és az [1–13 C] alanin termelése nem volt különbözõ a chow-táplált és a KD-vel táplált diabéteszes patkányok között (P = 0,19 és általános diétás hatás: P = 0,12; Ábra: 4C, D). A [13C] -hidrogén-karbonát termelés azonban 75% -kal alacsonyabb volt a KD-vel táplált diabéteszes patkányokban (P 13 C] laktáttermelés 195% -kal a táplált cukortartalmú patkányokban (P 13 C] laktáttermelés KD-vel táplált diabéteszes patkányokban (P 13 C] alanin KD-vel táplált cukorbeteg patkányokban és chow-táplált cukorbeteg patkányokban 34% -kal (általános dobutamin-hatás: P = 0,016; 4D. Ábra). A [13 C] -hidrogén-karbonát termelése 25% -kal csökkent dobutamin stressz alatt a chow-vel táplált cukorbeteg patkányokban (P = 0,003 vs. pihenés), míg a KD-vel táplált diabéteszes patkányokban változatlan volt (P > 0,99 vs. pihenés; Ábra). Dobutamin stressz alatt [1-13 C] a laktáttermelés korrelált az EDV-vel (4F. Ábra), valamint az SV-vel (4G ábra). A [13 C] -hidrogén-karbonát termelés szintén korrelált az SV-vel (4H ábra).
Meghatároztuk a glükóztranszportban részt vevő fehérjék (azaz inzulinfüggő GLUT4 és inzulinfüggetlen GLUT1) és a glikolízis (azaz PKM1 és PKM2) expresszióját is. Érdekes, hogy míg a KD alacsony szénhidráttartalmú, a GLD4 expressziója jobban szabályozott volt a KD-vel táplált cukorbeteg patkányok szívében, mint a tehénnel táplált diabéteszes patkányokéban, bár a GLD1-et a KD nem befolyásolta (1. táblázat és S3. Ábra). . A PKM1 és a PKM2 expressziója szintén jobban szabályozott volt a KD-vel táplált cukorbeteg patkányok szívében, mint a tehénnel táplált diabéteszes patkányokban (1. táblázat és S3. Ábra).
3,6 KD befolyásolta a zsírsav oxidáció és a szívizom lipotoxicitásának markereit
Az acil-CoA dehidrogenáz (ACADL) és a 3-hidroxi-acil-CoA dehidrogenáz (HADH) expressziója magasabb volt a KD-vel táplált cukorbeteg szívekben, mint a tehénnel táplált cukorbeteg patkányokban, míg a karnitin-palmitoil-transzferáz-1B (CPT1B) expressziója hasonló a két csoport között (1. táblázat). A szívizom trigliceridtartalma és a kollagéntartalma általában 56% -kal, illetve 11% -kal volt magasabb a KD-vel táplált cukorbeteg patkányok szívében, mint a tehénnel táplált diabéteszes patkányokban (1. táblázat és S4. Ábra). A kataláz, egy antioxidáns enzim expressziója megduplázódott a KD-vel táplált diabéteszes patkányok szívében a chow-vel táplált diabéteszes patkányokéval összehasonlítva (1. táblázat), ami az oxidatív stressz emelkedését jelezte.
4. MEGBESZÉLÉS
Jelen tanulmányunkban újszerű betekintést nyújtunk arra, hogy az alacsony szénhidráttartalmú környezetnek kitett szív kompenzálhatja az alacsony szénhidráttartalmú mennyiséget a glikolitikus tartalékképesség felfelé szabásával. Az inzulin által közvetített glükóz szívbe történő transzportjában (azaz a GLUT4) és a glikolízis utolsó lépésében (azaz a PKM1 és a PKM2) a fehérje bazális expressziója magasabb volt a KD-vel táplált cukorbeteg patkányok szívében, mint a tehénnel táplált cukorbetegeknél patkányok. Ez a megnövekedett munkaterhelés alatt megnövekedett glikolízis-stimuláló képességet jelenthet. Bár megfigyeltük, hogy a miokardiális 13 C laktáttermelés hiperpolarizált 13 C piruvát injekció esetén dobutamin stressz hatására megnőtt, amint azt korábban tárgyaltuk, a KD-vel táplált diabéteszes patkányokban figyelemre méltóan magasabb volt, mint a tehénnel táplált diabéteszes patkányokban (1. ábra rózsaszín). A szívglikolitikus kapacitás növekedése azonban a KD-vel táplált diabéteszes patkányokban nem lehet előnyös, mivel tovább növelheti a glikolízis és a glükóz oxidáció közötti eltérést, amely utóbbi valóban alacsonyabbnak bizonyult a KD-vel táplált cukorbeteg patkányokban, mint szoptatott cukorbeteg patkányok.
20%). Ezért figyelembe kell venni az étrend összetételének különbségeit a vizsgálatok összehasonlításakor vagy a megállapítások klinikai körülményekhez történő fordításakor.
Összefoglalva: ez az első olyan tanulmány, amely átfogóan megvizsgálja a KD hatását a szív metabolizmusára in vivo a diabéteszes szívben, különféle hiperpolarizált 13 C metabolikus szondák felhasználásával. Karcsú diabéteszes GK patkányokban a hosszú távú KD súlyosbította a diabéteszes kardiomiopátia státust, amely összefüggésbe hozható a maladaptív kardiális metabolikus modulációval és a lipotoxicitással. A további kutatásoknak a KD szív- és érrendszeri biztonságára kell összpontosítaniuk az embereknél.
KÖSZÖNETNYILVÁNÍTÁS
Köszönjük Tay Zhi Wei PhD-nak az alakszerkesztésben nyújtott segítségét.
- Az elhízás kezelésére szolgáló folyékony fehérjetartalmú szívritmuszavarok; NEJM
- 8 hetes, alacsony szénhidráttartalmú, magas zsírtartalmú, ketogén étrend fokozott kimerítő testmozgás egerekben
- 10 legjobb keto süti könnyű alacsony szénhidráttartalmú süti recept a ketogén étrendhez
- 7 napos ketogén diétás étkezési terv finom és egyszerű keto receptek zsírégetéshez és energiához
- A magas fehérjetartalmú étrend 8 előnye - EFM Egészségklubok