Új fluoreszcencia-vizsgálat kalcein-AM alkalmazásával az emberi eritrocita életképességének és öregedésének meghatározásához
Institutul National de Cercetare ‐ Dezvoltare pentru Stiinte Biologice, Bucuresti, Románia
University of Sciences et Technologies de Lille 1, Laboratoire de Chimie Biologique, UMR USTL/CNRS 8576, 59655 Villeneuve d'Ascq Cedex, FranciaországA szerző további cikkei keresése
Institutul de Biologie al Academiei Române, Bucuresti, Románia
Universitatea Al. I. Cuza, Facultatea de Biologie, Iasi, Románia
Institut Pasteur, Unité de Physiopathologie des Infections Lentivirales, Párizs, Franciaország
University of Sciences et Technologies de Lille 1, Laboratoire de Chimie Biologique, Villeneuve d'Ascq, Franciaország
Institutul National de Cercetare ‐ Dezvoltare pentru Stiinte Biologice, Bucuresti, Románia
University of Sciences et Technologies de Lille 1, Laboratoire de Chimie Biologique, UMR USTL/CNRS 8576, 59655 Villeneuve d'Ascq Cedex, FranciaországA szerző további cikkei keresése
Institutul de Biologie al Academiei Române, Bucuresti, Románia
Universitatea Al. I. Cuza, Facultatea de Biologie, Iasi, Románia
Institut Pasteur, Unité de Physiopathologie des Infections Lentivirales, Párizs, Franciaország
University of Sciences et Technologies de Lille 1, Laboratoire de Chimie Biologique, Villeneuve d'Ascq, Franciaország
Absztrakt
Háttér
Jelentettek egy rendkívül érzékeny, gyors és egyszerű áramlási citometriás vizsgálatot az emberi vörösvérsejtek (RBC) életképességének és öregedésének felmérésére.
Mód
Az ebben a jelentésben leírt vizsgálat a kalcein acetoxi-metil-észterének (calcein-AM), egy fluoreszcein-származéknak és nem fluoreszcens vitális festéknek az alkalmazásán alapul, amely passzívan keresztezi az életképes sejtek sejtmembránját, és citoszolos észterázokkal zöld fluoreszcens kalceinné alakítja át, amely intakt membránokkal és inaktív multirezisztens fehérjével rendelkező sejtek visszatartják. A kalceinveszteség áramlási citometriával könnyen meghatározható, és az észterázok citoszolos lokalizációját spektrofluorometriás elemzésekkel igazoltuk.
Eredmények
Megállapítottuk, hogy a vörösvérsejtek Ca 2+ -val inkubáltak, ami gyors és modulált önhalált vált ki, amely számos jellemzővel rendelkezik az apoptózissal (Bratosin és mtsai., Cell Death Differ 2001; 8: 1143–1156), az externális foszfatidil-serinnel és az elveszített kalceinnel festett és citoszolos adenozin-trifoszfát-tartalom. A phycoerythrin-jelzett annexin-V és a calcein-AM alkalmazásával végzett kettős jelölés azt mutatta, hogy az észteráz aktivitás csökkenése korai esemény, amely megelőzi a foszfatidil-szerin maradványok külsővé válását. Ezen túlmenően ez a vizsgálat lehetővé tette számunkra, hogy megkülönböztessük az ultracentrifugálással izolált fiatal és idős vörösvérsejteket egy önmagát alkotó Percoll-gradiensben, és az RBC öregedésének megbízható markerének tekinthető.
Következtetések
Úttörő szerepet játszik Brunning et al. (1), számos módszert írtak le fluoreszcens festékekkel a sejtek életképességének és citotoxicitásának mérésére, és ezeknek a próbáknak a száma folyamatosan növekszik (2). Az általunk alkalmazott színezékek közül a kalcein acetoximetil-diacetilészter (calcein-AM), a fluoreszcein származéka, kiemelkedik a sejtek életképességének és a sejtek citotoxicitásának első indikátoraként, köszönhetően a sejtek kiváló retenciójának és a fluoreszcenciának a pH-hoz való relatív érzéketlenségének fiziológiai tartomány (2, 3). A Calcein-AM egy erősen lipofil vitális festék, amely gyorsan bejut az életképes sejtekbe, az intracelluláris észterázok átalakítják kalceinné, amely intenzív zöld (530 nm) jelet eredményez (3), és az intakt plazmamembránnal rendelkező sejtek visszatartják. A pusztuló vagy sérült sejtekből, amelyeknek sérült a membránintegritása, vagy a multirezisztens fehérjét (MRP) expresszáló sejtekből (4, 5), a hidrolizálatlan szubsztrátumokat és azok fluoreszcens termékeit gyorsan extrudálják a sejtekből. Az elmúlt évtizedben a kalcein-AM vizsgálat felváltotta a sejtek életképességének (6-12) és citotoxicitásának (13-18) értékelésére szolgáló hagyományos 51 Cr-release módszert, és az apoptózis (19-24) kvantitatív meghatározására alkalmazták.
Az MRP előfordulása az emberi vörösvérsejtek (RBC) membránjában Pulaski és mtsai. (25) teszi ezt a sejtet potenciálisan hasznossá az MRP működésének és a potenciális MRP inhibitorok hatékonyságának tanulmányozása során. Az MRP humán vörösvértestek kiáramló aktivitásának monitorozásához számos kutató fluoreszcens szondákat használt, többek között fluoreszceinszármazékokat, például 2, ′ 7 ′ -bis- (karboxi-propil) -5/6-karboxifluoreszceint, acetoxi-metil-észtert (26), 2 ′, 7 '-bis- (karboxi-etil) -5/6-karboxi-fluoreszcein vagy kalcein-AM (27). Tudomásunk szerint azonban a kalcein-AM vizsgálattal nem számoltak be az RBC életképességének értékelésére.
Nemrégiben mi és mások (28-30.) Beszámoltunk arról, hogy az érett emberi vörösvértestek gyors önpusztító folyamaton mennek keresztül, amelynek számos jellemzője van az apoptózissal, beleértve a sejtek zsugorodását, a plazmamembrán vesiculizációját, a foszfatidil-szerin externalizációját, az esetleges vörösvértest szétesését vagy jelenlétében ezeknek a haldokló vörösvérsejteknek a fagocitózisát. Mivel a programozott sejthalál ezen szabályozott formáját a Ca 2+ beáramlás indukálhatta és modulálhatta, megvizsgáltuk, hogy a kalcein-AM vizsgálatot lehet-e használni az RBC életképességének meghatározására.
Jelen cikkünkben gyors és érzékeny calcein-AM vizsgálatot írunk le az emberi RBC életképességének áramlási citometriás meghatározására.
ANYAGOK ÉS METÓDUSOK
Vegyszerek
A fluorogén festék-kalcein-AM, humán szérumalbumin, fenil-metil-szulfonil-fluorid, nátrium-azid, szaponin és adenozin-5'-trifoszfát készletet Sigma-Aldrich-től (St. Louis, MO, USA), phycoerythrin-konjugált annexin-V-től (PE) vásároltuk. -Annexin-V) és HEPES-puffert a Pharmingen-től (San Diego, Kalifornia, USA) szereztük be, az A 23187 ionoforból. Streptomyces chartreusis Calbiochem-től (La Jolla, Kalifornia, USA) és Percoll-tól a Pharmacia-Biotech AB-től (Uppsala, Svédország) szereztük be.
Vérminták
A heparinban összegyűjtött emberi vércsoportú Rh Rh + vörösvértesteket a francia Etablissement Région de Transfusion Sanguine de Lille szállította. Vér centrifugálás után (2000g 5 percig 4 ° C-on) a plazmát, a vérlemezkéket és a leukocitákat pipettázással eltávolítottuk, és az eritrocitákat háromszor mostuk Dulbecco foszfáttal pufferolt sóoldatában (PBS; pH 7,4; 137 mM NaCl, 2,7 mM KCl, 8,1 mM Na2HPO4, és 1,5 mM KH2P04). A vörösvértesteket újraszuszpendáltuk (107 sejt/ml) HEPES pufferben (10 mM HEPES és 140 mM NaCl), pH 7,4, 0,1% humán szérum albuminnal kiegészítve, Ca 2+ (2,5 mM CaCl2) és ionofor A hiányában. 23187 (0,5 μM), a korábban leírtak szerint (28), és 37 ° C-on 3 és 20 órán át inkubáltuk 5% CO2-atmoszférában. A fiatal és a régi vörösvértesteket a vér ultracentrifugálásával választottuk el egy önmagát alkotó Percoll-gradiensben Lutz és munkatársai eljárása szerint. (31) módosítva a korábban leírtak szerint (32). Mindkét frakciót háromszor mossuk 0,2 M fenil-metil-szulfonil-kloridot tartalmazó pH 7,4-es PBS-pufferrel, és ugyanabban a Percoll-gradiensben újra centrifugáljuk.
Áramlási citometrikus elemzés
Az áramlási citometriás elemzéseket FACScalibur citométeren (Becton Dickinson, San Jose, Kalifornia, USA) hajtottuk végre, CellQuest szoftver alkalmazásával a megszerzéshez és elemzéshez. A fényszóró csatornákat lineáris nyereségre, a fluoreszcencia csatornákat pedig logaritmikus skálára állítottuk be, és minden körülmények között minimum 10 000 sejtet elemeztünk.
Az RBC szubpopulációk áramlási citometriai elemzése fényszórás mérésekkel
Az eritrocita méretének és sűrűségének változásait előre és oldalsó szög szórókkal (FSC vs. SSC) használtuk izotóniás PBS pufferben, pH 7,4, ozmolalitás 320-330 mosmol/kg, Bratosin és mtsai. (32).
A sejtek életképességének áramlási citometriai vizsgálata Calcein-AM alkalmazásával
PE ‐ Annexin ‐ V és Calcein ‐ AM kettős címkézésű áramlási citometrikus elemzés
A vörösvértesteket először (37 ° C-on 45 percig) inkubáltuk kalcein-AM-mel (0,5 μM) a fent leírtak szerint. Ezt követően a sejteket centrifugálással izoláltuk (2000 ppm)g 4 ° C-on 5 percig), 100 μl HEPES-kötő pufferben (pH 7,4) szuszpendáljuk, amely 2,5 mM kalcium-kloridot tartalmaz, és 10 μl PE-annekszin-V-vel inkubáljuk 15 percig szobahőmérsékleten, sötétben. 400 μl megkötő puffer hozzáadása után a sejteket elemeztük az FL1 (kalcein) és az FL2 (PE ‐ annekvin-V) biparametrikus hisztogramjain. A kísérleteket három példányban hajtottuk végre.
A citoszol-észteráz aktivitás fluorometriai mérése
A citoszolos észteráz aktivitás kétféle mérését hajtottuk végre. Az első típusban a vörösvérsejteket előkezeltük (37 ° C-on 45 percig) kalcein-AM-vel (végső koncentráció: 5 μM) a fent leírtak szerint, és 106 vörösvérsejt-szuszpenziót 300 μl hideg vízzel hemolizáltunk Vortex-szel történő keverés közben. pár perc. A sejtmembránok ultracentrifugálással történő eltávolítása után (10 000 ppm)g 4 ° C-on 20 percig) a citoszol fluoreszcencia intenzitását egy FL × 800 (Bio-Tek Instruments, Winooski, VT, USA) Microplate Fluorescence Reader alkalmazásával határoztuk meg KC Junior programmal a következő körülmények között: 485 nm-es gerjesztés, 528 nm-es emisszió, 20 sávszélesség és 100% -os érzékenység. Az eredményeket a „fluoreszcencia egységek átlagaként” fejeztük ki. A vakpróbákat ugyanolyan körülmények között vizsgáltuk kalcein-AM hiányában.
A második típusú mérés során citoszolos frakciót készítettünk 500 μl vörösvértest 1 ml hideg vízben történő keverésével, és a sejtmembránokat ultracentrifugálással eltávolítottuk a lizátumból (10 000g 4 ° C-on 20 percig). 250 μl felülúszóhoz 15 μl 100 μM kalcein-AM munkaoldatot adtunk 96 lyukú műanyag fekete mikrotiter lemezeken (Nunc, Naperville, IL, USA), és az elegyet 37 ° C-on tartottuk különböző időpontokban. (0 és 50 perc között, 5 perces időközönként). A vakpróbákat ugyanolyan körülmények között vizsgáltuk kalcein-AM hiányában, és a fluoreszcencia intenzitását a fent leírt FL × 800 Microplate Fluorescence Reader alkalmazásával határoztuk meg. Minden kísérletet legalább háromszor hajtottak végre, háromszor ismétléssel.
Az adenozin-trifoszfátszint meghatározása vörösvértestekben
Az adenozin-trifoszfát (ATP) szintjét a Sigma-Aldrich adenozin 5'-trifoszfát készlet segítségével határoztuk meg, és a mikromol ATP-ben fejeztük ki egy deciliter vérben. A kísérleteket három példányban hajtottuk végre.
EREDMÉNYEK
Az inkubációs idő hatása a címkézési hatékonyságra a Calcein-AM használatával
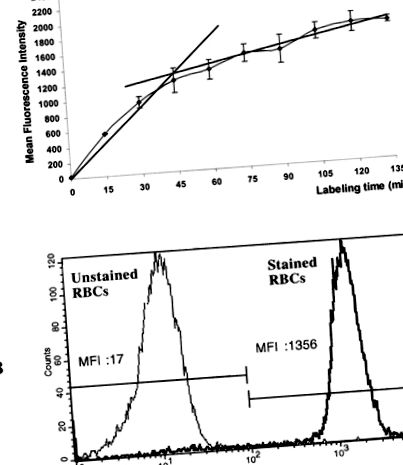
Amint az 1A. Ábrán látható, a kalcein-AM-jelölt vörösvértestek és a vörösvérsejt-észterázok által végzett kalcein-AM-hidrolízis sebessége az inkubáció 45 percen belül gyorsan növekedett. Az átlagos fluoreszcencia intenzitás ezután nem nőtt nagyban, talán annak köszönhető, hogy a kalcein egyidejű spontán felszabadulása következtében a sejtmembrán permeabilizációja hosszú inkubációs periódus alatt következett be. A kalcein-AM festés meredeksége alapján 45 perc inkubációs időt fogadtunk el. Az 1B. Ábra mutatja, hogy ezekben a kísérleti körülmények között a festetlen és festett vörösvértestek régiói egyértelműen meghatározva voltak.
Az RBC-észteráz aktivitás áramlási citometriai elemzése. V: Az inkubációs idő hatása az emberi vörösvértest citoszol aktivitására a kalcein-AM felé. A frissen izolált vörösvértesteket 37 ° C-on inkubáltuk 5 μM kalcein-AM jelenlétében, és az áramlás citometriás elemzését különböző időpontokban végeztük. Az adatokat három független kísérlet átlagos fluoreszcencia intenzitásának ± szórásaként fejezzük ki. B: 5 μM kalcein-AM jelenlétében 0 percig (festetlen vörösvértestek) és 45 percig (festett vörösvértestek) inkubált humán vörösvértestek sejt-észteráz aktivitásának áramlási citometriai elemzése (egyetlen paraméter). A fluoreszcencia átlagértékeket MFI-ben fejezzük ki. Abcissae: log skála zöld fluoreszcencia intenzitása (FL1). Rendel: relatív sejtszám. A megszámlált cellák száma: 10 000. A bemutatott eredmények három reprezentatív kísérletből származnak.
A Calcein-AM assay specifikus az RBC Cytosol észteráz-aktivitására
Annak igazolására, hogy a kalcein-AM vizsgálat specifikus volt a citoszolra, és nem membránészterázokra, például az acetilkolinészterázra, az emberi vörösvértestek extracelluláris enzimére, amelynek aktivitása a vörösvértest öregedésével jelentősen csökken (34), a kalcein-AM-t adták a mentes vörösvértestek citoszolos frakciójához. plazmamembránok. Amint a 2A. Ábra mutatja, a spektrofluorometrikus elemzés egy mikrotiterlemez-fluoreszcencia-leolvasóval egyértelműen kimutatta, hogy a vörösvértest-citoszol aktív észterázokat tartalmaz, és hogy a platót kevesebb mint 30 perc alatt éri el a membrángát hiánya miatt.
Az észteráz aktivitás fluorometrikus mérése az emberi vörösvértestek citoszolos frakciójában mikrolemez fluoreszcencia leolvasóval. V: Az észteráz-aktivitás kinetikája: a frissen izolált humán vörösvértesteket hemolizáltuk, és a membránok ultracentrifugálással történő eltávolítását követően a citoszolos frakciót 37 ° C-on inkubáltuk 5 μM kalcein-AM jelenlétében, és fluoreszcenciáját különböző időpontokban határoztuk meg, a Anyagok és metódusok. Az adatok három független kísérlet átlagának ± szórását jelentik. B: Humán vörösvértestek citoszoljának fluoreszcencia intenzitása, amelyeket lizálás előtt preinkubáltunk (37 ° C 45 percig) calcein-AM-vel. Három különböző donor kapott citoszolos frakcióját elemeztük, és az adatok három független kísérlet átlag ± szórását mutatják.
Ezt az eredményt megerősítette a Microplate Fluorescence Readerrel mért fluoreszcencia-intenzitás a vörösvértestek citoszolos frakcióin, amelyeket lizálás előtt inkubáltunk (37 ° C 45 percig) calcein-AM-vel (5 μM). Amint a 2B. Ábra mutatja, három különálló kísérlet, három külön-külön három különböző donor vörösvérsejtjeivel végzett, intenzív fluoreszcenciát mutatott, amely egyedenként változó volt.
Calcein ‐ AM assay for Human RBCMembrane Integrity
Annak felmérésére, hogy a kalcein-AM vizsgálat alkalmas lenne-e a membrán permeabilizációjának tesztelésére a sejthalál kontrolljaként, kezeltünk vörösvértesteket szaponin hiányában vagy jelenlétében. A 3. ábra a kalcein fluoreszcencia csökkenését mutatja a szaponinnal kezelt vörösvérsejtekben (átlagos fluoreszcencia intenzitás [MFI]: 25) a kezeletlen vörösvérsejtekhez képest (MFI: 1418). Ez az eredmény lehetővé tette számunkra annak megállapítását, hogy a hisztogram nem festett régiója az elhalt vagy haldokló sejteket reprezentálja sérült membránokkal, ezzel magyarázva a kalcein fluoreszcencia felszabadulását.
A szaponinnal kezelt humán vörösvértestek áramlási citometriás elemzése. A szaponin-kezeletlen és a szaponin-kezelt humán vörösvértestek kalcein-AM festésének áramlási citometriai elemzésének átfedése (egyetlen paraméter). MFI: a fluoreszcencia átlagértékei átlagos fluoreszcencia intenzitásként kifejezve. Abscissae: log skála zöld fluoreszcencia intenzitása (FL1). Rendel: relatív sejtszám. A megszámlált cellák száma: 10 000. Az eredmények három reprezentatív kísérletből származnak.
Calcein ‐ AM mint az emberi vörösvértest életképességének markere
Calcein-AM assay mint az emberi vörösvértest öregedésének markere
Ezután felmértük, hogy ezzel a vizsgálattal meg lehet-e különböztetni a fiatalokat a régi vörösvérsejtektől, amelyeket a frissen gyűjtött emberi vér ultracentrifugálásával izoláltunk egy önmagát alkotó Percoll-gradiensben (31). Ez a módszer biztosítja a fiatalok és az öreg vörösvértestek magas szintű dúsulását, kevés szennyező sejtet tartalmazva. Az izolált sejtek százalékos arányát mindkét populáció esetében 1,0 ± 0,2% -ra becsülték. Ezek az értékek hasonlóak a Sorette et al. (38) és Bratosin és mtsai. (32).
Amint az 5A. Ábra mutatja, a kalcein fluoreszcenciája a régi vörösvérsejtekben alacsonyabb volt, mint a fiatal vörösvérsejtekben az észteráz aktivitás csökkenése miatt. Ehhez hasonlóan jó korrelációt figyeltünk meg az ATP-tartalommal, amely alacsonyabb volt a régi vörösvértestekben, mint fiatalokban (5B. Ábra). Amint a 4B. Ábra mutatja, a régi vörösvérsejtek csökkent kalcein-fluoreszcencia-intenzitása nem volt összefüggésben az annexin-V festéssel (az adatokat nem mutatjuk be), ami arra utal, hogy a csökkent észteráz aktivitás megelőzi a foszfatidil-szerin expozíciót. Amint arról Bratosin és mtsai. (35), csak a makrofágok által fagocitizált, öregedő vörösvértestek reagáltak az anesztin-V-vel. Ez a megállapítás azt mutatja, amint azt Gatti et al. (20) tapadó sejtvonalak, a PC12 és az NIH3T3 alkalmazásával, az annekdin-V kevésbé érzékeny lehet, mint a kalcein-AM a korai apoptózis kimutatására. Ezek az eredmények arra késztetnek bennünket, hogy azt javasoljuk, hogy a kalcein-AM vizsgálatot lehet használni az emberi vörösvértest öregedésének markerként.
V: Ultracentrifugálással izolált fiatal (Y) és idős (O) humán vörösvértestek sejtészteráz aktivitásának áramlási citometriai elemzésének átfedése (egyetlen paraméter), Percoll önképző gradiensben Lutz és mtsai. (31), Bratosin és mtsai. (32) A számok a fluoreszcencia átlagértékeket (MFI) jelentik. Abscissae: log skála zöld fluoreszcencia intenzitása (FL1). Rendel: relatív sejtszám. A megszámlált cellák száma: 10 000. A bemutatott eredmények négy reprezentatív kísérletből származnak. B: Az ATP-tartalom alakulása fiatal (Y) és régi (O) vörösvértestekben. Az adatok három független kísérlet átlag ± szórását jelentik.
VITA
Az általunk kifejlesztett biztonságos és érzékeny kalcein-AM vizsgálat értékes tesztet jelenthet a vérbankokban tárolt vörösvértestek öregedésében és életképességében. Ebben a tekintetben érdekes hivatkozni egy Beutler (40) által megjelent cikkre: „Vissza a jövőbe a vörösvértestek megőrzésében”, amely azzal a hatalmas problémával foglalkozik, hogy meghosszabbítja az időtartamot, amikor a vörösvértestek folyékony állapotban tárolhatók. Beutler ezt írta: „A haladás számos okból lassú volt. Először is, a tárolási elváltozás alapvető jellege továbbra sem ismert. Másodszor, soha nem találtak megfelelő helyettesítő tesztet az önkénteseken végzett életképességi vizsgálatok elvégzésére. " Az általunk leírt calcein-AM vizsgálat hozzájárulhat a Beutler által kiváltott második probléma megoldásához.
Köszönetnyilvánítás
Daniela Bratosin és Laura Mitrofan a MacoPharma Co. (Tourcoing, Franciaország) munkatársai, Carmen Palii pedig a romániai francia nagykövetség és a MacoPharma Co. munkatársai. A szerzők hálásak Dr. Jean-Jacques Huart-nak (az Etablissement Régional igazgatójának) de Transfusion Sanguine de Lille), Francis Goudaliez (a MacoPharma Co. igazgatója) és Hervé Dubly (a MacoPharma Co. elnöke), akik kedves érdeklődést és pénzügyi támogatást nyújtottak ehhez a projekthez. Hálával tartozunk a játékvezetőknek észrevételeikért és kritikáikért, amelyek segítettek a jelentés javításában.
- Nekrotizáló enterocolitis-csökkentés exkluzív emberi tej-diéta és probiotikum alkalmazásával
- Az új gyógyszeres amooranin apoptózist indukál Caspase-aktivitással az emberi mellrák sejtjeiben
- Paleo frissítés; Tekintse át a Tökéletes emberi étrend dokumentumfilmet, Stephanie Shimerdla Medium
- Új nemi specifikus zsigeri adipozitási index mexikói gyermekpopulációhoz - ScienceDirect
- Újszerű megközelítés a peptikus fekély perforációs műtétjén - Ahmadinejad - 2020 - Klinikai esetjelentések -