Új molekuláris célpontok a szarkoidózis kezelésében
Jared Chiarchiaro
a pulmonalis, allergiás és kritikus ellátás osztálya, Dorothy P. és Richard P. Simmons Interstitialis tüdőbetegség központja, Pittsburghi Egyetem Orvostudományi Egyetem, Pittsburgh, Pennsylvania, USA
b Orvostudományi Tanszék, Dorothy P. és Richard P. Simmons Interstitialis tüdőbetegségek központja, Pittsburghi Egyetem Orvostudományi Kar, Pittsburgh, Pennsylvania, USA
Bill B. Chen
a pulmonalis, az allergiás és a kritikus gondozás orvoslásának osztálya, Dorothy P. és Richard P. Simmons Interstitialis tüdőbetegség központja, Pittsburghi Egyetem Orvostudományi Egyetem, Pittsburgh, Pennsylvania, USA
Kevin F. Gibson
a pulmonalis, allergiás és kritikus ellátás osztálya, Dorothy P. és Richard P. Simmons Interstitialis tüdőbetegség központja, Pittsburghi Egyetem Orvostudományi Egyetem, Pittsburgh, Pennsylvania, USA
b Orvostudományi Tanszék, Dorothy P. és Richard P. Simmons Interstitialis tüdőbetegség központ, Pittsburghi Egyetem Orvostudományi Kar, Pittsburgh, Pennsylvania, USA
Absztrakt
A felülvizsgálat célja
A szarkoidózis egy krónikus granulomatózus betegség, amely általában a tüdőt, a nyirokcsomókat és más szervrendszereket érinti. A bizonyítékok arra utalnak, hogy a gyulladáscsökkentő terápiák széles körű alkalmazása ellenére az USA-ban a szarkoidózis morbiditási és halálozási aránya növekszik. Ebben az áttekintésben új terápiákat vizsgálunk, amelyek más betegségek (például rheumatoid arthritis, Crohn-kór és pikkelysömör) specifikus gyulladásos útjait célozzák meg, amelyek hasonlóak a szarkoidózis immunopatogenezis szempontjából releváns utakhoz, és ezért potenciálisan új szarkoidózis-terápiákat jelentenek.
Legfrissebb megállapítások
A szarkoidózis immunopatogenezise az elmúlt években jól tisztázódott. Rengeteg bizonyíték van a T-sejt aktiválására a szarkoidózisban, amely mind a Th1, mind a Th17 gyulladásos kaszkádok aktivációjához vezet. A T-sejt aktiválást célzó terápiákat, a Th1 útvonalakat (például az interleukin-6 inhibitorokat), a Th17 útvonal mediátorait és másokat az Élelmiszer- és Gyógyszerügyi Hivatal jóváhagyta vagy vizsgálat alatt álltak számos autoimmun gyulladásos betegség kezelésére, de ezeket még nem vizsgálták szarkoidózis. A p38 mitogénnel aktivált protein kinázok és az ubiquitine proteasome rendszer új szerekkel történő célzása szintén új terápiás lehetőséget jelenthet a szarkoidózisban szenvedő betegek számára.
Összegzés
A szarkoidózisban szenvedő betegek növekvő morbiditási és mortalitási aránya határozottan alátámasztja a krónikus betegségek kezelésének hatékonyabb gyulladáscsökkentő terápiák kifejlesztésének szükségességét.
BEVEZETÉS
A szarkoidózis egy krónikus, multiszisztémás granulomatózus rendellenesség, amely általában magában foglalja a tüdőt és a nyirokcsomókat [1], de magában foglalhatja az összes többi szervrendszert is. Úgy gondolják, hogy a betegség 10 000 fehér amerikaira 10-et és 10 000 afro-amerikaira 35-et érint [2]. Mégis, a betegek akár 80% -ának is szüksége lesz kezelésre [2], és a szisztémás terápiát igénylők közel fele 5 évvel a diagnózis után is terápiát igényel [3]. 1951 óta a kortikoszteroidok jelentik az első terápiát a tüneti és progresszív betegségben szenvedő betegek számára, de annak alkalmazása, bár rövid távon hatékony, dózisfüggő mellékhatások és a bizonyíték arra, hogy ez kedvezően megváltoztatja a progresszív betegség természetes kórtörténetét [4▪, 5–7].
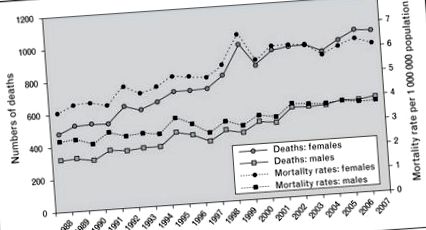
A legújabb bizonyítékok arra utalnak, hogy a kortikoszteroidok és más immunszuppresszánsok széles körű alkalmazása ellenére a szarkoidózisban a halálozási arány folyamatosan növekszik [8]. 1998 és 2007 között a szarkoidózissal összefüggő halálozási arány növekedett. A nőknél több mint 50% -kal, a férfiaknál 30% -kal nőttek, 1988-tól 2007-ig átlagosan 3% -kal nőttek [8]. Érdekes, hogy bár az életkorhoz igazított halálozás legnagyobb relatív növekedését a nem hispán fehéreknél tapasztalták a nem spanyol háttal szemben, a legnagyobb abszolút növekedést a nem spanyol fekete nők körében tapasztalták. A tanulmányban a halálozás leggyakoribb oka maga a betegség folyamata volt, rámutatva a progresszív betegség hatékonyabb terápiáinak szükségességére [8] (1. ábra).
A szarkoidózis patogenezise akkor kezdődik, amikor egy még azonosítatlan antigént antigént bemutató sejtek feldolgoznak és a T-limfociták elé tárják a fő hisztokompatibilitási komplex (MHC) II. Osztályú felszíni molekulák összefüggésében. Az interakció gyulladásos válasz aktiválódásához vezet határozottan Th1-torzítással, gyulladásos sejtek toborzásával és nem kaszkáló granulomák kialakulásával. Újabban meggyőző bizonyítékok állnak rendelkezésre a Th17 immunutak szerepéről a szarkoidózis granulomák előállításában és fenntartásában. Az uralkodó hipotézis szerint az antigén perzisztencia a gyulladásos kaszkád megnövekedéséhez és perzisztenciájához vezet (a tumor nekrózis faktor emelkedésével), míg az antigén clearance-et a gyulladásos kaszkád megszüntetése és a betegség remissziója követi [9].
Kimutatták, hogy a kortikoszteroidok rövid távú előnyökkel járnak (a tünetek, a tüdőfunkció és a radiográfia szempontjából), de a korai tanulmányok azt sugallják, hogy a placebóval összehasonlítva nem nyújtanak hosszú távú előnyöket (radiográfiásan vagy tüdőfunkciós vizsgálatokkal) [11]. A kortikoszteroid-megtakarító szerek (például antimetabolitok) alkalmazása javította a betegek számára rendelkezésre álló kezelési lehetőségeket, de nem mindegyik részesül ebben a terápiában, és egyesek olyan mellékhatásokat tapasztalnak, amelyek a kezelés abbahagyását igénylik [12]. Sok más, a gyulladásos kaszkádban specifikus molekulákat megcélzó biológiai anyag megjelenésével megterhelő szükség van ezeknek a szarkoidózisban szenvedő betegek lehetséges terápiájaként történő feltárására. Szükség van új terápiás megközelítések kidolgozására is az aktív progresszív és a relapszus-remitáló betegség természetes kórtörténetének módosítása céljából, vagyis a betegség módosító antiszarkoidózisos gyógyszeres terápiák szükségességére.
A SARCOIDOSIS IMMUNOPATOGENEZISE
Granuloma képződés - Th1/Th17 hipotézis. Kezdeményezés: az alveoláris makrofágokat és a dendritikus sejteket feltételezett antigén aktiválja. A dendritikus sejtek a nyirokcsomókba vándorolva elindítják a Th1/Th17-sejt amplifikációt. Az alveoláris makrofágok által termelt kemokinek vonzzák a Th1/17, Treg, B-sejteket, valamint a CD8 + sejteket és a fibroblasztokat, és elindítják a granuloma képződést (effektor fázis). A dendritikus sejtek és a makrofágok egyaránt olyan citokineket termelnek, amelyek a szarkoidózisban a Th1 és Th17 sejteket részesítik előnyben [54].
ANTIMETABOLITOK: METOTREXÁT, AZATHIOPRIN, LEFLUNOMID ÉS MIKOKFENOLÁT
Asztal 1
| Metotrexát | Kettős-vak placebokontrollált vizsgálatok, leendő esetsorok és esetjelentések | Hányinger, szájfekélyek, leukopenia, hepatotoxicitás, émelygés és fertőzések | Pneumonitis és teratogén |
| Azatioprin | Leendő esetsorok és esetjelentések | Leukopenia, hányinger és fertőzések | Súlyos leukopenia, hepatotoxikus hatások, hasnyálmirigy-gyulladás és bőrrák |
| Leflunomid | Kettős-vak placebokontrollált vizsgálatok, leendő esetsorok és esetjelentések | Leukopenia, hepatotoxikus hatások, fertőzések és alopecia | Pneumonitis, teratogén, perifériás neuropathia és magas vérnyomás |
| Mikofenolát-mofetil | Esetsorozat | Hányinger, hasmenés és fertőzések | Bőr rák |
TNFα-GÁTLÓK: INFLIXIMAB, ADALIMUMAB ÉS NEM CÉLZOTT TUMOR NEKROZIS TÉNYEZŐK
A glükokortikoidokkal vagy antimetabolitokkal szemben rezisztens szisztémás betegségben szenvedő betegeknél a célzott TNFα-gátlás a kezelés következő ajánlott lépése [9,13]. A legjobb adatok az infliximabra vonatkoznak, amely két randomizált klinikai vizsgálatban vegyes eredményeket mutatott [22,23]. Az adalimumab hatékonyságára vonatkozó adatok egyetlen, kicsi, nyílt vizsgálatra korlátozódnak [24]. Ez hatékony alternatíva lehet az infliximab-intoleranciában szenvedő betegek számára, hasonló biztonsági és hatékonysági eredményeket mutat [24,25], de az adatok korlátozottak. A talidomid, a pentoxifyllin és az apremilaszt három nem célzott TNFα-gátló hatású gyógyszer, és a hatékonyságról és a mellékhatásokról való kiábrándító adatok miatt harmadik vonalnak tekintik őket [26–28].
Citotoxikus T-limfociták társult blokkja
A T-sejt aktiválásához kostimulációra van szükség a makrofág CD80/CD86 komplexe és a T-sejt CTLA fehérjereceptora közötti kapcsolaton keresztül. Ennek a kapcsolatnak a blokkolása a T-sejt-válasz csökkenését eredményezi. Az abetacept egy fúziós fehérje, amely az IgG1 Fc régiójából áll, fuzionálva a CTLA-4 extracelluláris doménjével, és amely kötődik a CD80 és CD86 molekulához. Ez megakadályozza a kostimulációt és a T-sejtek down-szabályozását eredményezi. Az abetaceptet jelenleg reumás ízületi gyulladásban szenvedő betegek számára engedélyezték, akiknek az anti-TNFα-terápiára adott válasza nem volt megfelelő. Számos, placebo-kontrollos vizsgálatot végeztek abetacepttel Crohn-kórban és fekélyes vastagbélgyulladásban [29]. Ez a gyógyszer potenciálisan hasznos immunszuppresszáns lehet szarkoidózisban szenvedő betegeknél.
BELÉGZETT VASOAKTÍV BELBENI PEPTID
A vazoaktív bélpeptid (VIP) egy neuropeptid, amely pleiotróp hatással van a simaizom összehúzódására és az értágulatra, valamint gyulladáscsökkentő hatásokra. A belélegzett VIP-nek immunreguláló hatása van a szarkoidózisban, beleértve a szabályozó T-sejtek növekedését, ami az effektor T-sejtek elnyomott indukcióját és proliferációját, valamint a HLA-DR, CD86 és CD8 + downregulációját eredményezi a bronchoalveolaris lavage (BAL) mintákban a betegeknél szarkoidózissal [30]. A VIP terápiát számos gyulladásos betegségben vizsgálják, beleértve a szarkoidózist is.
MEGLÉVŐ Th1-CÉLZOTT TERÁPIÁK
Léteznek olyan terápiák, amelyek célja a Th1 által közvetített gyulladás csillapítása a tumor nekrózis faktor gátlása révén, amelyeket szarkoidózisban teszteltek. Az Infliximab-ot a fentiekben tárgyaltuk. Az adalimumab terápiás hatékonyságot mutatott kis kohorsz vizsgálatokban [31]. A golimumab és az etanercept hasonló szerek, amelyek mindkettő hatástalannak bizonyultak a szarkoidózisban [32,33].
Az IL-6 egy fontos proinflammatorikus citokin, amelyet a T-sejtek és a makrofágok szekretálnak, és stimulálja az immunválaszt, ami granuloma kialakulásához vezet. Takizawa és mtsai. [34] korán bebizonyította, hogy az IL-6 szint megemelkedett a szarkoidózisban szenvedő betegek BAL folyadékában, és szorosan korrelált a BALF CD3 + limfociták szintjével. A kortikoszteroidokkal végzett kezelés az IL-6 sejtek szintjének jelentős csökkenését eredményezte ebben a populációban. Az Food and Drug Administration (FDA) által a reumás ízületi gyulladás kezelésében jóváhagyott első IL-6 elleni biológiai gyógyszerek a tocilizumab (ACTEMRA; Genentech, San Francisco, Kalifornia, USA), egy anti-IL-6 receptor blokkoló és a siltuximab, maga az IL-6 elleni antitest. Az olokizumab egy IL-6-ra irányított emberi mAb, amely ígéretes eredményeket mutatott egy randomizált, II. Fázisú vizsgálatban, közepes vagy súlyos reumás ízületi gyulladásban szenvedő betegeknél [35]. Az autoimmun betegségek korai fejlődésében számos terápia irányul az IL-6 ellen. Azonban az IL-6 vagy IL-6 receptor elleni terápiákat nem vizsgálták szarkoidózisban szenvedő betegeknél.
IL-12/IL-23P40 ÉS Th17 ÚTMUTATÓK
Az IL-12/IL-23 egy heterodimer citokin, amely az IL-12p40 kisebb alegységből és az IL-23p19 fő alegységből áll. Az IL-12 egy Th1 citokin, amelyet makrofágok termelnek, többek között az antigén stimulációra válaszul, és részt vesz a naiv T-sejtek Th1 sejtekké történő differenciálásában. Serkenti a TNFα termelését is. Az IL-12 p40 kisebb alegysége (IL-12p40) emelkedett a szarkoidózisban szenvedő betegek BAL-mintáiban, összehasonlítva az idiopátiás tüdőfibrózisos betegek és kontrollokéval [36]. A génexpressziós profilok, amelyek a szarkoidózis elváltozású bőrbiopsziákat hasonlítják össze a nem-léziós biopsziákkal és a normál kontrollokkal, számos diszregulációs gént azonosítottak, beleértve az IL-12p40 és az IL23 receptorokat, ami arra utal, hogy mind a Th1, mind a Th17 útvonal szerepet játszik a szarkoidózisban. Hasonlóképpen Ten Berge és mtsai. [37] és Facco és mtsai. [38] mindkettőnél magasabb volt az IL-17a + sejtek szintje a szarkoidózisban szenvedő betegek BAL folyadékában a perifériás vérrel és az egészséges önkéntesekkel összehasonlítva, és IL-17a + T sejteket találtak a szöveti granulomákban, jelezve a Th17 útvonalak szerepét az indukcióban és a sarcoidosis granulomák fenntartása.
P38 MITOGÉN-AKTIVÁLT PROTEINKINÁZOK, NLRP3 INFLAMAMASOME ÉS UBIQUITIN PROTEASOME RENDSZER
A MAP kinázok p38 csoportja és a TNFα termelése között szoros kapcsolat van [13]. A fokozott p38 aktiváció túlzott Th1 és Th17 proinflammatorikus citokintermeléshez vezet. Amikor a szarkoidózisos betegek BAL sejtjeit tartós p38 foszforiláció stimulálja, kimutatták, hogy robusztusabb TNFα és IL-12/IL-23p40 termeléssel reagálnak [13]. A p38 MAP kinázok megcélzása vonzó terápiás potenciállal rendelkezik, mivel fontos szerepet játszik mind a tumor nekrózis faktor mRNS stabilitásának fenntartásában, mind a tumor nekrózis faktor szignalizációból származó számos citokin downstream aktiválásában. A BIRB 796 és a semapimod a p38 MAP kináz inhibitorok, amelyeken klinikai vizsgálatokat végeztek Crohn-betegségben, de egyiket sem vizsgálták szarkoidózisban [44,45].
Először 2002-ben ismerték el, a gyulladásosomák újonnan felismert mintázatfelismerő receptorok, amelyek immun- és gyulladásos sejteken expresszálódnak, és amelyek endogén és exogén kórokozókat céloznak meg. Számos gyulladásos rendszert azonosítottak, de a legjobban az NLRP3 gyulladásokat vizsgálták. Ennek a fehérjekomplexumnak az aktiválása a kaszpáz-1 aktiválásához és a gyulladásgátló citokin IL-1β felszabadulásához vezet, amely részt vesz mind akut, mind krónikus gyulladásos válaszokban számos gyulladásos betegségben, beleértve a szarkoidózist is. Számos NLRP3 gátlót hagytak jóvá: rilonoceptet, a kriopirinnel társított periodikus szindróma (CAPS) IL-1 blokkolóját; kanakinumab, a CAPS IL-1β mAb inhibitora; és anakinra, egy IL-1 receptor antagonista a reumás ízületi gyulladásban és a CAPS-ben. Egyiket sem vizsgálták szarkoidózisban [46–48].
KÖVETKEZTETÉS
Noha jelentős előrelépés történt a szarkoidózis megértésében és kezelésében, a betegség továbbra is elfogadhatatlan terhet jelent a morbiditás és a halálozás szempontjából. A betegség miatti növekvő halálozás határozottan alátámasztja annak szükségességét, hogy olyan terápiákat fejlesszenek ki, amelyek célja a természeti előzmények módosítása, a „betegséget módosító antiszarkoidózis terápiák” szükségessége [61]. Kényszerítő szükség van a T-sejt aktiváció, a Th1 és Th17 immunút, a fontos jelátviteli útvonalak és az ubiquitin – proteasoma rendszer szempontjából releváns, egyre növekvő számú terápiás molekula potenciális előnyeinek feltárására. A szarkoidózissal közös kórokozó mechanizmusokkal rendelkező betegségek - például rheumatoid arthritis, Crohn-kór és pikkelysömör - kezelésére szolgáló gyógyszerek növekvő száma kiváló lehetőséget kínál e biológiai szerek új terápiákként történő felfedezésére szarkoidózisban szenvedő betegeknél.
Köszönetnyilvánítás
Szeretnénk megköszönni Theresa Heinrich asszonynak a kézirat elkészítésében nyújtott segítségét.
- A szarkoidózis tünetei, szakaszai, okai, diagnózisa és kezelése
- Mesentericus adenitis gyermekeknél okai, tünetei; Kezelés
- Alkoholmentes zsírmájbetegség - tünetek és kezelés
- Mesentericus ischaemia kezelés; Megelőzés - Érgyógyászati Klinikák
- A sovány emberek ötször nagyobb eséllyel halnak meg a gyakori szívproblémák kezelése után - egészség - Hindustan