A felületaktív bevonat hatása az agyat célzó polimer nanorészecskékre; felülvizsgálat
B. J. Chacko *, S. Palanisamy 1, N. L. Gowrishankar, J. Honeypriya 2 és A. Sumathy
Gyógyszerészeti Tanszék, Prime Gyógyszerészeti Főiskola, Palakkad-678 551, India
1 Gyógyszerészeti Iskola, Nemzetközi Orvostudományi Egyetem, Kuala Lumpur-57000, Malajzia
2 kutató tudós, Vegyészmérnöki Tanszék, Bombay Indian Institute of Technology (IIT-B), Mumbai-400 076, India
| Benyújtás dátuma | 2016. július 06 |
| Felülvizsgálat dátuma | 2017. április 07 |
| Az elfogadás dátuma | 2018. január 03 |
| Indian J Pharm Sci, 2018; 80 (2): 215-222 |
Ez egy nyílt hozzáférésű cikk, amelyet a Creative Commons Attribution-NonCommercial-ShareAlike 3.0 licenc feltételei szerint terjesztenek, amely lehetővé teszi mások számára, hogy nem műszakilag átdolgozzák, módosítsák és tovább építsék a művet, mindaddig, amíg a szerző jóváírásra kerül és az új alkotások azonos feltételek mellett vannak engedélyezve
DOI: 10.4172/gyógyszerészeti tudományok. 1000348
Absztrakt
A gyógyszerek agyba történő célzása a gyógyszerkutatás egyik legnagyobb kihívást jelentő kérdése, mivel a vér-agy gát áthidalhatatlan akadályt jelent a szisztémásan beadott terápiák és az agy extracelluláris mátrixának áthaladásának a helyileg szállított gyógyszerek gyenge eloszlásának. A vér-agy gátat kiváltó különféle invazív vagy nem invazív módszerek közül a nanorészecske a központi idegrendszeri gyógyszerek beadásának egyik ígéretes módja. A nanorészecske-alapú gyógyszer-célzás koncepciója óriási haladást és óriási korszakot tesz lehetővé a fenti korlátozások leküzdésére jobb gyógyszerhatékonysággal és csökkentett gyógyszer-toxicitással. Az elmúlt években a biológiailag lebontható polimer nanorészecskék felületaktív bevonásának új stratégiái jelentek meg, amelyek eltérnek az agy célzásának hagyományos módszereitől, az orvostudomány élvonalában. A nemionos felületaktív anyag, a poliszorbát 80, mint bevonó anyag, páratlan lehetőséget ígér a kolloid részecskék agyi célzásának fokozására. Jelen áttekintés célja a felületaktív anyaggal bevont nanorészecskék gyógyszerhordozó rendszerként történő alkalmazásának értékelése különböző központi idegrendszeri betegségek esetén.
Kulcsszavak
Vér-agy gát, poliszorbát 80, agy célzás, nanorészecskék, felületaktív anyag, polimerek
A BBB endoteliális sejtekre jellemző a fenestrációk hiánya, a kiterjedtebb szoros, folyamatos kerületi csatlakozások, a nyirokelvezetés hiánya és a fő hisztokompatibilitási komplex antigének hiánya [26], valamint a különböző transzporterek expressziója, beleértve a GLUT1, LAT1, efflux transzportereket, például a p-glikoproteint. (P-gp) [27] és a multirezisztenciával kapcsolatos fehérjék [28,29]. A BBB egyedi tulajdonságai miatt a hidrofil gyógyszerek paracelluláris transzportja gyakorlatilag hiányzik, és a passzív diffúzióval történő transzcelluláris transzport csak olyan molekulák számára érhető el, amelyek megfelelnek bizonyos kritériumoknak, például: 1) a molekulatömeg kisebb, mint 500 Da; 2) a vegyületek egyesülnek; 3) a gyógyszer log P értéke közel 2; 4) a hidrogénkötések kumulatív száma nem haladja meg a 10-et [30]. A BBB gátolja az összes kis molekulájú gyógyszer és 98% -ban a nagy molekulájú gyógyszerek transzportját az agyba [31,32]. Sőt, még az endothel sejtek sikeres felszívódása után is, az aktív kiáramlási mechanizmusok (ATP-kötő kazetta transzporter) visszaszivattyúzzák ezeket a molekulákat a véráramba [33]. Tehát a központi idegrendszer (CNS) különféle hatóanyagainak terápiás stratégiái korlátozottak.
Különböző gyógyszer-célzási stratégiák az agyhoz
A molekuláris trójai faló lovak genetikailag módosított fehérjék vagy peptidek, egy második peptidek vagy peptidomimetikus monoklonális antitestek, amelyek egy specifikus receptorhoz kötődnek a BBB-n, és endogén receptor által közvetített transzportfolyamatok révén keresztezik a BBB-t. A molekuláris trójai lovak nagymolekulájú gyógyszerek nem invazív juttatását biztosítják az emberi agyba. A trójai faló lehetővé teszi a fúziós fehérje receptor által közvetített bejuttatását a BBB-n keresztül, így a fehérje hatóanyag bejuthat az agyba és kiválthatja a kívánt farmakológiai hatást [48,49].
Az oldott hordozó (SLC) transzportereket napjainkban széles körben használják, amelyek több mint 300 membránhoz kötött fehérjét tartalmaznak. Ezek a fehérjék megkönnyítik a szubsztrátumok széles körének transzportját a különböző biológiai membránokon, amelyek fontos szerepet játszanak a fiziológiai folyamatokban. Megkönnyíti a tápanyagok sejtfelvételét, valamint a gyógyszerek és más xenobiotikumok felszívódását [50]. Az SLC transzporterek nagy része dúsított expressziót mutat az emberi BBB-ben, a vese és a máj diszpozíciójában elengedhetetlen szerepű gyógyszer transzporterek hasonló vagy magasabb szinten expresszálódtak a BBB-ben. A BBB-ben lévő SLC transzporterek létfontosságú szerepet játszanak a neurotranszmitterek, aminosavak, vitaminok és különféle egyéb nélkülözhetetlen tápanyagok központi idegrendszeri homeosztázisának fenntartásában. Ezeket a transzportereket megcélozhatják a neurodegeneratív és más központi idegrendszeri betegségek kezelésére szolgáló gyógyszerek CNS-bejuttatásának elérésére [51].
Az elmúlt évtizedekben jelentős kutatási erőfeszítések igazolták, hogy a kolloid hordozók, különösen a nanorészecskék és a liposzómák érdekes előrelépést jelentettek a terápiás szerek központi idegrendszerbe történő hatékony szisztémás és lokális bejuttatásában [52,53]. Ezen kezelési eredmények közül a biológiailag lebontható, biokompatibilis polimer nanorészecskék óriási haladást értek el alacsony toxicitásuk, fokozott biológiai hozzáférhetőségük, szabályozott felszabadulásuk, hatalmas fajlagos felületük és a gyógyszerkibocsátás önszabályozása miatt [54-56]. A nanorészecskék valójában szilárd kolloid részecskék, amelyek nagysága 10 és 1000 nm között van. Olyan makromolekuláris anyagokból állnak, amelyekben a hatóanyag (gyógyszer vagy biológiailag aktív anyag) feloldódik, be van kötve, be van kapszulázva és/vagy amelyekhez a hatóanyag adszorbeálódik vagy kovalensen kapcsolódik, mostanra megtalálhatók a vonatkozó speciális enciklopédiákban [23,57 ]. A nanorészecskék gyógyszerhordozóként történő alkalmazásának fő előnyei közé tartozik az oldhatóság növelése és a terápiás szer lebomlásának csökkentése, valamint a tartózkodási idő meghosszabbítása a gyógyszer és a cél közötti érintkezési idő növelésével. A célhelyen történő előnyös felhalmozódás miatt a terápiás szer csökkent toxicitást és hatékonyságjavulást is mutathat [59,60].
Izgalmas fejlesztés az univerzális „varázslövedék” nanorészecske-alapú gyógyszerek agyba juttatására [61], a legfontosabb célkitűzések a részecskék mérete [62], a felületi tulajdonságok, valamint a gyógyszerek kibocsátása [63] vagy a hatóanyag a legnagyobb hatékonyság elérése érdekében [64]. A 10-100 nm-es nanorészecske-méretek előnyösek az agy célzott bejuttatásához, azonban az agy bejuttatásához a 0,10-es polidiszperzitás mellett a 230 nm-nél kisebb nanorészecske-méreteket is használták [65]. Amint azt számos tanulmány mutatja, a nanorészecskék felületi módosítása lehetővé teszi intravénás beadás után az agyba jutást a BBB és a védőmechanizmus kikerülésével [66-68]. A technológia másik fontos előnye, hogy nem igényel semmiféle módosítást a gyógyszermolekulában az agy bejuttatásához, amelyet a beépített molekula kedvezőtlen fizikai-kémiai jellemzőinek elfedésével lehet elérni [44].
Felületaktív alapú megközelítés a polimer nanorészecskék agyi retenciójának meghosszabbítására
Benvegnu és mtsai. tanulmány nyilvánvalóvá teszi, hogy a haloperidollal töltött poliszorbát bevonatú polimer poli (-kaprolakton) nanokapszulák csökkentik a motor káros mellékhatásait, valamint az extrapiramidális agyi régió oxidatív károsodásait a patkányok szabad haloperidoljához viszonyítva, az álpszichózis modellje [56]. Hasonlóképpen a P80 (poli (oxi-etilén) -szorbitán-20-monooleát) használható az opszonizáció késleltetésére. A P80-mal stabilizált lipidcore nanokapszulák a gyógyszerek hatékony szállítását mutatták az agyba [60].
A tanulmány, amelyet Sun et al. megerősítette, hogy a P80 bevonat még részleges fedése is döntő szerepet játszik a nanorészecskék és az agyi mikroér endotélsejtjei közötti kölcsönhatásban és a CNS-be való bejutásban a nanorészecskék agyba történő célzása során [79]. 2008-ban Wilson és mtsai. kimutatta, hogy az intravénásán beadott takrin és rivasztigmin agykoncentrációja 4,07 és 3,82-szeresére növelhető az 1% nemionos P80 felületaktív anyaggal bevont PBCA nanorészecskékhez való kötődéssel, miközben csökkenti a gyógyszerek májban és lépben való felhalmozódását [80].
Egy másik tanulmány beszámolt a P80-val bevont gemcitabin PBCA nanorészecskék tumorellenes hatásairól in vitro és in vivo farmakodinamikai hatásokról az agydaganat modell C6 glioma sejtjein. Különböző készítményeket (fiziológiás sóoldat, gemcitabin önmagában vagy 1% P80 bevonattal ellátott gemcitabin PBCA nanorészecskék) injektáltunk az agydaganat modelljébe, amelyet C6 glioma sejtek 14 napon át Sprague Dawley patkányokba történő oltása után állítottak elő. gemcitabine PBCA nanorészecskék jelentősen meghosszabbíthatják a túlélési időt a sóoldat kontrollhoz képest [81].
Egy tanulmány összehasonlította az agyszövet koncentrációját és a tiszta bakozid-A oldat és a P80 bevonatú PLGA nanorészecskék intravénás beadását követően elért eredményeket. Kimutatták, hogy a Wistar patkányok in vivo vizsgálatában a tiszta gyógyszeroldattal (2,56 ± 1,23 μg/g szövet) összehasonlítva a bakozid-A magasabb agykoncentrációja (23,94 ± 1,74 μg/g szövet) a felszínnel bevont nanorészecskék jelentős szerepére utal az agy célzásáról [82].
Gelperina és mtsai. [78] tanulmány egészséges patkányokban értékelték a P80-val bevont nanorészecskével társuló DOX akut toxicitását, és terápiás dózistartományt határoztak meg ennek a készítménynek az intrakraniálisan beültetett 101/8 glioblastoma patkányokban. A P80 jelenléte a készítményekben nem volt összefüggésben a toxicitás változásával a szabad vagy nanorészecskés gyógyszerrel összehasonlítva. A daganatot hordozó patkányok eredményei hasonlóak voltak az egészséges patkányokéval.
Ezek az eredmények azt mutatják, hogy a nanorészecskékhez kötött DOX toxicitása hasonló vagy akár alacsonyabb volt, mint a szabad DOX toxicitása. A nanorészecskék bevonatának kritikus koncentrációja a nanorészecskéken a vér agyba történő maximális transzlokációja érdekében a legtöbb tanulmányban megállapítást nyert, hogy (1% w/w) [78]. Egyes tanulmányokban bebizonyosodott, hogy a P80-koncentráció legfeljebb (2% w/w) hatékony vagy agyi célzás a nanorészecskéknél [83,84]. A legtöbb vizsgálatban a bevonathoz 1 tömeg% P80-at adtak a nanorészecske-szuszpenziókhoz, és folyamatos keverés mellett 30 percig inkubálták, végül liofilizálták [85,86].
A megcélzott polimer nanorészecskék a tárolás során megfelelő stabilitással rendelkeznek. A szisztémás bejuttatáshoz a célzáshoz a P80 vagy PEG kapcsolt nanorészecskékkel bevont nanorészecskéknek szintén: 1) stabilnak kell lenniük a vérben, 2) kerülniük kell a RES-t és 3) hosszabb a keringési idejük [87]. Összefoglalva ezeket a kiterjedt kísérleti eredményeket, a nemionos felületaktív anyagokkal (különösen a P80) túlzottan bevont nanorészecskék a beadás után képesek voltak a megterhelt gyógyszereket a BBB-n keresztül szállítani, amely eszközöket juttatott gyógyszerekhez az agyba.
A P80 bevonatú nanorészecskék által közvetített gyógyszer transzport mechanizmusa az agyba
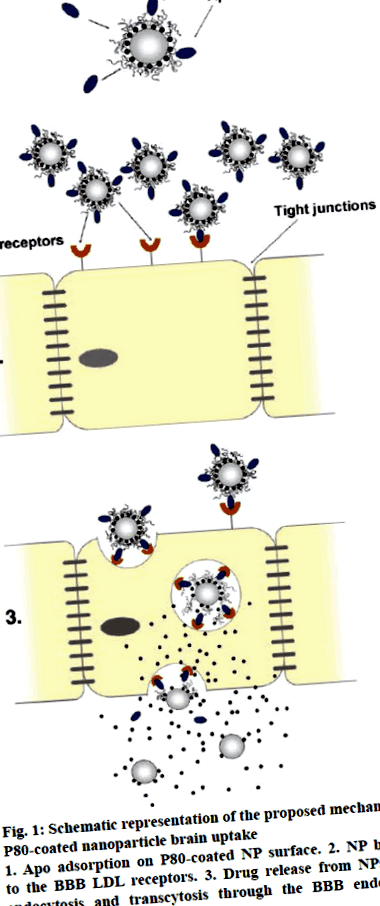
1.ábra: A P80-val bevont nanorészecske agyfelvételének javasolt mechanizmusának sematikus ábrázolása
1. Apo adszorpció a P80 bevonattal ellátott NP felületen. 2. NP kötése a BBB LDL receptorokhoz. 3. Gyógyszer felszabadulás az NP-kből endocitózis és transzcitózis esetén a BBB endoteliális sejteken keresztül [35]
- 10 legjobb étel az agysérülés helyreállításához (klinikai bizonyítékok alapján)
- A testsúly változásai az agy mély stimulálása után obszesszív-kényszeres betegség vagy depresszió esetén
- Könyvajánló Az éhes agy Scott H Young
- Alumínium-oxid nanorészecskék a tűzoltáshoz és a tűz megelőzéséhez Az ACS alkalmazott nanoanyagok
- Brain Booster kiegészítő Nootropic Power vitaminok a jó memória (60-Count) Groupon számára