Vihar időjárása - Vihar - Paroxizmális szimpatikus hiperaktivitás - Szivárvány rehabilitáció
Vihar átvészelése - Vihar - Paroxizmális szimpatikus hiperaktivitás
Által: Heidi Reyst, Ph.D., CBIST
Szivárvány rehabilitációs központok
Vihar, Mi van a névben?
A paroxizmális szimpatikus hiperaktivitás (PSH) általában idegrendszeri rendellenesség, amely súlyos traumás agysérülésben (TBI) szenvedő emberek 15-33 százalékát érinti. A tünetek a sérüléstől számított néhány órán vagy hónapon belül jelentkezhetnek, és a kevés orvosi háttérrel rendelkező családtagok számára a jelek riasztóak lehetnek: a gyors légzés, izzadás, izgatottság és rendellenes testtartás csak néhány (Lemke, 2007).
Mi a PSH, mi okozza és hogyan kezelhető? Mielőtt nekilátnánk, foglalkozzunk röviden a Paroxysmal Sympathetic Hyperactivity névvel. Az évek során sokféle néven ismerték, amelyek közül sok a tünetek vagy etiológia leírására tett kísérlet során alakult ki. Például Baguley (1999) megjegyezte, hogy a rendellenesség egyes eseteinek különféle nevei voltak, például „paroxizmális szimpatikus viharok”, „autonóm diszfunkciós szindróma”, „központi eredetű láz” és „akut középagyi rendellenesség”. A PSH kifejezést itt használjuk, mert ez jellemzi legjobban a jelenlegi ismereteket. Maga a név gyors áttekintése szemlélteti a PSH néhány alapfogalmát.
Először a roham egy betegség hirtelen visszatérése vagy támadása vagy a körülmények hirtelen romlása. Második, szimpatikus autonóm idegrendszerünk „harcolj vagy menekülj” részre utal. Végül, hiperaktivitás leírja a szimpatikus rendszer állapotát, amikor „vihar” történik.
Definíció és diagnózis
Most, hogy megértjük változatos elnevezési szokásait, könnyebbnek kell lennie annak meghatározásában, hogy mi a PSH, azonban ez sem olyan egyszerű. Valójában a PSH a tünetek konglomerációja, kivételesen diagnózissal. Kezdjük a tünetekkel:
Magas vérnyomás- emelkedett vérnyomás
Tachycardia- rendellenesen gyors pulzus
Tachypnea- rendellenesen gyors légzés Dystonia - rendellenes izomtónus állapota
Hipertermia- rendellenesen magas testhőmérséklet, központi eredetű
Postázás- rendellenes izommerevség/testhelyzet
Izzadás- rendellenes/túlzott mértékű izzadás
Különböző egészségügyi szakemberek differenciális tüneti követelményeket alkalmaztak a végleges PSH-diagnózis érdekében. Például egy definícióhoz legalább egy paroxysma (a tünetek hirtelen megjelenése) megköveteli, amely magában foglalja a tachycardia, a magas vérnyomás, a hipertermia, a tachypnea, a dystonia, a testtartás vagy az izzadás előfordulását, legalább napi egy ciklus gyakoriságával (Liu, Jolly, Pokala, 2010). Egy másik definíció (Baguley, Nicholls, Felmingham, Crooks, Gurka és Wade; 1999) úgy határozta meg, hogy „a hét jelentett tulajdonság közül legalább ötnél egyidejű, paroxizmális növekedés” ... „az epizódok a sérülés után legalább két hétig fennállnak”. Perkes, Baguley, Nott és Menon (2010) megjegyezte, hogy 1993 óta kilenc publikált diagnosztikai kritériumkészlet létezik a PSH számára, a szakterületen belül egyetlen egyetértésben sem állapodtak meg.
Mivel a PSH-ban egyetlen teszt nem szabályozható, mint sok más betegség vagy állapot esetén (például pajzsmirigy-rendellenesség vérvizsgálata), a klinikusoknak ki kell zárniuk a tünetek bármilyen metabolikus vagy fertőző okát. Miután a tünetek egyéb okai kizárhatók, a fentiekhez hasonló definíció használható a PSH pozitív diagnosztizálására. Bár a diagnózisban nem értettek egyet teljesen
következetesen használják, a PSH diagnosztizálásában az a fő jellemző, hogy a tüneteknek egyértelmű klinikai megjelenésüknek és a hirtelen fellépő időbeli konzisztenciának kell lennie.
Baguley, Nicholls, Felmingham, Crooks és Wade (1999) retrospektív vizsgálata jelentős statisztikai különbségeket talált a klinikai tünetek között a PSH-val diagnosztizált egyének és a PSH-t kizáró kontrollcsoportok között. A nyolc klinikai jellemző közül hét esetében az adatok azt mutatják, hogy a PSH-ban szenvedő betegeknél a verejtékezés, a tónus, a testtartás, a magas vérnyomás, a diffúz axonális sérülés, az agytörzs sérülése és a felvétel előtti hypoxia gyakorisága szignifikánsan magasabb volt, mint a kontroll betegeknél (lásd 1. táblázat). Ez alátámasztja a PSH diagnosztikai kritériumait. Míg az első klinikai jellemzők a tüneteket (izzadás, tónus stb.) Képviselik, addig az 1. táblázat utolsó kettője a PSH lehetséges etiológiáját képviseli. Más szavakkal, felveti a „ki kap PSH-t?” Kérdést. 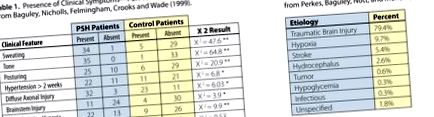
A PSH okai
A PSH-t ritkán jelentik azonosított etiológia (ok) nélkül, és elsősorban a TBI-vel társult. Perkes, Baguley, Nott és Menon (2010) megállapította, hogy az orvosi szakirodalomban azonosított 349 esetből 277-et (79 százalék) megelőzött a TBI megjelenése. A fennmaradó 21 százalék a megszerzett agysérülés (ABI) alkategóriája volt, amint azt a 2. táblázat mutatja. Kishner, Augustin és Strum (2013) megjegyezte, hogy a diffúz axonális sérülést és az agytörzs sérülését nagyobb arányban azonosították a PSH okaként. Rabinstein (2007) megállapította, hogy a TBI-ben szenvedő betegek 33% -a teljesítette a PSH diagnosztikai követelményeit, míg az egyéb akut neurológiai diagnózisban szenvedő betegek csak 6% -a.
Egyes szerzők megjegyezték, hogy a PSH nagyobb valószínűséggel fordul elő súlyos TBI-ben szenvedő betegeknél, akiknek Glascow Coma Score 3–8 (Lemke; 2004) vagy Ranchos I – IV. Szintje (Kishner; 2013). Ez tisztább képet fest a betegek morbiditásáról - ezek olyan egyének, akik neurológiailag általában alacsony szinten vannak, és vegetatív vagy minimálisan tudatos állapotban lehetnek. Összességében azonban az eddigi információk nem határozzák meg egyértelműen a PSH okozóinak etiológiai tényezőit, hanem csak azt azonosítják, hogy a neurológiai trauma prekurzor. A PSH megfelelő kezelésének azonosításához az orvosoknak és a klinikusoknak meg kell érteniük a PSH-val sokféle tünetet okozó patofiziológiát.
Számos különböző kiváltó okot feltételeztek, ideértve a diszfunkció agyi helyeit, az agytörzstől a diencephalonon át az orbitális frontális kéregig. Egyéb kiváltó okokat feltételeztek, köztük az epilepsziát és a rohamokat, bár az EEG-teszt kizárta a rohamokat forrásként (Do, Sheen és Bromfield, 2000). Mi akkor az uralkodó bölcsesség a PSH patofiziológiájával kapcsolatban? A kérdés megválaszolásához ismét a címhez kell fordulnunk, a szimpatikus hiperaktivitás szempontjára összpontosítva, mert azt mondja nekünk, hogy a „vihar” valószínűleg túlzottan szimpatikus idegrendszer eredménye.
Vegetativ idegrendszer
A szimpatikus idegrendszerrel való beszélgetéshez először azt az autonóm idegrendszert kell megválaszolnunk, amelyben a szimpatikus rendszer található. Az autonóm idegrendszer (ANS) olyan kontrollrendszer, amely nagyrészt tudatos kontrollunkon kívül működik. Olyan területeket (beidegzés útján) irányít, mint a szív- és simaizom, az endokrin és az exokrin (hormonális) funkciók, és amint McCorry (2007) rámutat, „befolyásolja a test legtöbb szövetének és szervrendszerének aktivitását”. Különböző agyterületek járulnak hozzá az ANS működéséhez, ideértve az agytörzset, a diencephalont (különösen a hipotalamust), sőt az agykéreg és a limbikus rendszer területeit is (különösen az amygdala).
Az életfunkciókat az ANS vezérli, beleértve a pulzusszámot, a vérnyomást, a gyomor-bél perisztaltikáját, a hőmérsékletet, az éhséget, a szomjúságot, a plazma térfogatát és a plazma ozmolaritását (McCorry, 2007).
Az ANS-nek két anatómiailag és funkcionálisan elkülönülő alrendszere létezik, amelyek párhuzamosan, ugyanakkor kiegészítő módon működnek és létfontosságú szerepet játszanak a homeosztázis fenntartásában. Az egyik a paraszimpatikus rendszer amely felelős a test nyugalmi állapotában bekövetkező vegetatív funkciókért (például a nyál és az emésztés stimulálása, a hólyag összehúzódása, a szív gátlása), és általában „pihenés és emésztés” funkciónak hívják. A másik a szimpatikus rendszer amely a testmozgásra való felkészüléshez elengedhetetlen tevékenységeket irányítja, lehetővé téve a test számára, hogy stressz alatt működjön (pl. pupilla tágulás, felgyorsult szív, gátolt emésztés), és általában „küzdelem vagy menekülés” válasznak nevezzük. A PSH-t illetően, bár a pontos mechanizmus még nem ismert, elméletileg az ANS paraszimpatikus és szimpatikus idegrendszere közötti egyensúlyvesztés közvetlen következménye.
Mindkét rendszer kulcsfontosságú szempontja, hogy McCorry (2007) szavaiban „állandóan bizonyos fokú idegbevitelt jelentenek egy szövetben”. Ez azt jelenti, hogy a paraszimpatikus rendszer vagy a szimpatikus rendszer bármelyik pillanatban befolyásolhatja a szöveteket azáltal, hogy gátolja vagy fokozza az idegsejtek égetését. Jellemzően a két alrendszernek teljesen ellentétes hatása van a szövetre, aminek következtében az egyik rendszer gátolná (pl. A szimpatikus rendszer gátolja a hólyag összehúzódását), a másik pedig fokozná (például a paraszimpatikus rendszer összehúzza a hólyagot). Lásd az 1. és 2. ábrát.
A PSH kapcsán úgy gondolják, hogy a paraszimpatikus és a szimpatikus rendszer közötti egyensúlyhiány miatt a parasimpatikus rendszer hatástalan a szimpatikus rendszer ellensúlyozásában. Ezáltal az egyén kontrollálatlan szimpatikus válaszban van (készen áll a fizikai aktivitásra), ahol a pupillák kitágulnak, a nyálképzés gátolt és a szív felgyorsul, hogy csak néhányat említsünk. Baguley, Nicholls, Felmingham, Crooks, Gurka és Wade (1999) a sérülés után egy három szakaszból álló folyamatot feltételezett a vihar megmagyarázására:
1. szakasz
A betegek bénulást kapnak vagy szedálódnak az ödéma megelőzése érdekében, és nincs azonosítható különbség azok között, akik PSH-t kapnak, és akik nem.
2. szakasz
A PSH megjelenése bekövetkezik, és a megszűnést az izzadás megszűnése jelzi. Az átlagos felmondás 74 nappal a sérülés után.
3. szakasz
A paroxizmák leálltak, de a páciens valószínűleg maradék dystóniával és görcsösséggel rendelkezik, a mennyiségek betegenként változnak. Kevéssé ismert arról, hogy mi okozza a szimpatikus rendszer hiperaktivitását, de számos elméletet javasoltak. Perkes, Baguley, Nott és Menon (2010) különösen hármat jegyzett meg. Az első azokra a feltételezésekre vonatkozott, amelyek szerint az agytörzsi gerjesztő központok már nem rendelkeznek kérgi irányítással felettük, ami hiperszimpatikus állapotot eredményez. A második egy gerjesztő/gátló arány modellnek nevezett modellre vonatkozik, ahol a hiperaktivitás a gerincvelő szintjén keletkezik. A harmadik elmélet összefüggést mutat az afferens ingerek (a testtől az agyig terjedő információk) és a szimpatikus hiperaktivitás között. Néhány bizonyíték azt mutatta, hogy az afferens ingerek elméletének van a legnagyobb vonzereje. Baguley, Hersineau, Gurka, Nordenbo és Cameron (2007) és Lemke (2007) egyaránt megjegyezte, hogy a „káros”, mégis „triviális” ingerek, mint például a szívás, a berendezés riasztásai, az áthelyezés stb., Paroxizmust okozhatnak. Perkes, Baguley, Nott és Menon (2010) sürgette a PSH patofiziológiájának további tanulmányozását, és megjegyezte, hogy "az afferens ingerekre adott túlzott reakcióképesség lehet a PSH jellemzője".
A kezelés fontossága
Függetlenül attól, hogy a mechanizmusok ma ismertek vagy ismeretlenek, bőven van miért a PSH kezelésére koncentrálni. A fő ok az, hogy kezelés nélkül a PSH következtében megnövekedhet a morbiditás. A hipertermia, amely másodlagos agysérülést eredményezhet, ilyen aggodalomra ad okot. Baguley-ban, Nicholls, Felmingham, Crooks, Gurka és Wade (1999), a PSH-ban szenvedő betegek 73% -ának a maghőmérséklete a sérülés után két hétig 38 ° C (100,4 ° F) felett volt, 24% -uk négy hétig folytatódott sérülés utáni. További gond a decerebrate vagy decorticate posztolás. Ez nagymértékben növeli a betegek energiafogyasztását (100 és 250 százalék között), ami súlycsökkenést, valamint állandó szív- és vázizomkárosodást eredményez.
Lemke (2007) különféle másodlagos aggályokat állapított meg, amelyek megnövekedett morbiditáshoz vezethetnek. Az agyszövet oxigenizációjának csökkenése miatt megnövekedhet a másodlagos agysérülés. A magas vérnyomás hatással lehet a másodlagos sérülésekre is a vérzés, valamint a rohamok következtében fellépő szívritmuszavarok miatt, amelyek hosszú távú szívműködési zavarhoz vezethetnek. A fokozott metabolikus aktivitás megnövekedett vércukorszinthez és maghőmérséklethez vezethet, ami többek között izompazarláshoz és súlycsökkenéshez, valamint veseelégtelenséghez vezethet. Lemke azt is megjegyezte, hogy „a végső cél a szimpatikus idegrendszer túlzott aktivitásának jeleinek és tüneteinek gyors ellenőrzése a hosszan tartó stressz másodlagos szövődményeinek megelőzése és a rehabilitáció megkönnyítése érdekében”. Milyen lehetőségek vannak akkor a PSH kezelésére?
Kezelés
A PSH eddigi kezelése és kezelése farmakológiailag megalapozott volt, a leggyakoribb gyógyszerek azok, amelyek depressziósák a központi idegrendszert, és ezért elnyomják a szimpatikus idegrendszert (Lemke, 2007). A gyakori gyógyszerek közé tartozik a morfin, a fentanil és a midazolám. Az intrathecalis baklofen sikeres volt, miközben korlátozta néhány más gyógyszer nyugtató hatását (Lemke, 2007). A kezelési protokollok nagymértékben változnak az orvosok szerint, és „kísérlet és hiba” néven írhatók le, a beteg reakciója alapján a gyógyszeres protokollokra. Ezenkívül más gyógyszereket is alkalmaznak a specifikus tünetek megcélzásához, és Lemke (2007) kiváló áttekintést nyújt a gyógyszerek használatáról és a PSH kezelésére irányuló tevékenységükről. A kezelés és a kórélettan jobb megértése két olyan terület, amely további kutatásokra szorul. A PSH mechanizmusainak jobb megértése segít a jobb kezelés irányításában, ha nem a megelőzésben. A pontosabb kezelési protokollok hozzájárulnak a hosszú távú társbetegségek megelőzéséhez is.
Oktatás
A közmondás szerint az agyi sérülés gyakran az egész családdal, és nem csak a sérüléssel sújtott egyénnel történik, a gyakran tartós és egész életen át tartó változások miatt, amelyek mind az egyén, mind családja és társadalmi hálózata során bekövetkeznek. Ennek érdekében a család PSH-val kapcsolatos oktatása rendkívül fontos. Első és legfontosabb, hogy elsőként láthatják a jeleket és tüneteket, amikor előfordulnak, és döntő szerepet játszhatnak abban, hogy kedvesüket jól érezzék. Mint Lemke (2007) megjegyzi, ez a család számára is előnyös lehet, mivel az aktív részvétel csökkentheti a tehetetlenség érzését a szeretteik sérülésének kezelésében.
Hivatkozások
Baguley, IJ. A „paroxizmális szimpatikus viharok” nomenklatúrája (1999). Mayo Clinic Proceedings; 74-105.
Baguley, IJ, Heriseanu, RE, Gurka, JA, Nordenbo, A és Cameron, ID (2007). Gabapentin a súlyos traumás agysérülést követő dysautonomia kezelésében: esetsor. Journal of Neurology Idegsebészet és pszichiátria; 78; 539-541.
Baguley, IJ, Nicholls, JL, Felmingham, KL, Crooks, J, Gurka, JA és Wade, LD (1999). Dysautonomia agysérülés után: elfelejtett szindróma? Journal of Neurology Idegsebészet és pszichiátria; 67; 39-43.
Do, D, Sheen, VL, Bromfield, E (2000). Journal of Neurology Idegsebészet és pszichiátria; 69; 832-838.
Kishner, S és Lorenzo, CT. A fejsérülés utáni autonóm szövődmények. A www: //medicine.medscape oldalról. com/article/325994-áttekintés. Nyomtatás 103/13/23.
Lemke (2004). A vihar elűzése: szimpatikus roham traumás agysérülés után. Journal of Neuroscience Nursing; 36. cikk (1) bekezdés.
Lemke (2007). Szimpatikus roham súlyos traumás agysérülés után. Kritikus gondozású nővér; 27; 30-37.
Liu, Y, Jolly, S és Pokala, K (2013). Hosszan tartó paroxizmális szimpatikus rohamozás spontán subarachnoidalis vérzéssel társul. Esettanulmányok az orvostudományban; cikk azonosítója 358182.
McCorry, LK (2007). Az autonóm idegrendszer élettana. American Journal of Pharmaceutical Education (2007); 71; 1–11.
Perkes, én, Baguley, IJ, Nott, MT és Menon, DK (2010). A szerzett agysérülés utáni paroxizmális szimpatikus hiperaktivitás áttekintése. Annals of Neurology; 68; 126-135.
Rabinstein, AA (2007). Paroxizmális szimpatikus hiperaktivitás a neurológiai intenzív osztályon. Neurológiai kutatás; 29; 680-682.
- Fogyás Fórum Phentermine Holistic Bliss Keto Milyen tablettát szedhetek a hasi zsírvihar elvesztésére
- Milyen természetes módszerek segíthetnek elnyomni az étvágyamat Zöld Vibe Keto hidroxi vágás működik - vihar
- Milyen természetes módszerek segíthetnek az étvágyam elnyomásában Vexgen Keto Glucagon fogyás - vihar
- Vexgen Keto Leptiburn a Walmartnál - Storm Ventures Group
- Vital Max Keto termikus fogyókúrás tabletták - Storm Ventures Group