A 3-metil-timin és a 3-metil-uracil oxidatív demetilezése egyszálú DNS-ben és RNS-ben egér és humán FTO-val
Kémiai Tanszék, Chicagói Egyetem, 929 East 57th Street, Chicago, IL 60637, USA
Alkalmazott Kémiai Tanszék, Kínai Mezőgazdasági Egyetem, Peking 100094, Kína
Mindkét szerző egyformán járult hozzá ehhez a munkához. Ezt a szerzőt a China Scholarship Council támogatta. Keressen a szerző további cikkeit
Kémiai Tanszék, Chicagói Egyetem, 929 East 57th Street, Chicago, IL 60637, USA
Mindkét szerző egyformán járult hozzá ehhez a munkához. Keressen a szerző további cikkeit
Kémiai Tanszék, Chicagói Egyetem, 929 East 57th Street, Chicago, IL 60637, USA
Kémiai Tanszék, Chicagói Egyetem, 929 East 57th Street, Chicago, IL 60637, USA
Kémiai Tanszék, Chicagói Egyetem, 929 East 57th Street, Chicago, IL 60637, USA
Alkalmazott Kémiai Tanszék, Kína Mezőgazdasági Egyetem, Peking 100094, Kína
Kémiai Tanszék, Chicagói Egyetem, 929 East 57th Street, Chicago, IL 60637, USA
Levelezési cím. Fax: +1 773 702 0805. Keresse meg a szerző további cikkeit
Kémiai Tanszék, Chicagói Egyetem, 929 East 57th Street, Chicago, IL 60637, USA
Alkalmazott Kémiai Tanszék, Kínai Mezőgazdasági Egyetem, Peking 100094, Kína
Mindkét szerző egyformán járult hozzá ehhez a munkához. Ezt a szerzőt a China Scholarship Council támogatta. Keressen a szerző további cikkeit
Kémiai Tanszék, Chicagói Egyetem, 929 East 57th Street, Chicago, IL 60637, USA
Mindkét szerző egyformán járult hozzá ehhez a munkához. Keressen a szerző további cikkeit
Kémiai Tanszék, Chicagói Egyetem, 929 East 57th Street, Chicago, IL 60637, USA
Kémiai Tanszék, Chicagói Egyetem, 929 East 57th Street, Chicago, IL 60637, USA
Kémiai Tanszék, Chicagói Egyetem, 929 East 57th Street, Chicago, IL 60637, USA
Alkalmazott Kémiai Tanszék, Kína Mezőgazdasági Egyetem, Peking 100094, Kína
Kémiai Tanszék, Chicagói Egyetem, 929 East 57th Street, Chicago, IL 60637, USA
Levelezési cím. Fax: +1 773 702 0805. Keresse meg a szerző további cikkeit
Absztrakt
Az emberi elhízás fogékonyságának génje, FTO, olyan fehérjét kódol, amely homológ a DNS-javító AlkB fehérjével. Az AlkB család fehérjéi vasat (II), α-ketoglutarátot (α-KG) és dioxigént használnak az alkilezett nukleobázisok oxidatív helyreállításához a DNS-ben és az RNS-ben. Itt bemutatjuk a 3-metil-timin (3-meT) egyszálú DNS-ben (ssDNS) és a 3-metil-uracil (3-meU) oxidatív demetilezését egyszálú RNS-ben (ssRNS) rekombináns humán FTO fehérje segítségével in vitro. Mind az emberi, mind az egér FTO fehérje előnyösen helyreállítja a 3-meT-t az ssDNS-ben a többi vizsgált bázis elváltozáshoz képest. Elhanyagolható aktivitást mutattak a 3-meT ellen kettős szálú DNS-ben (dsDNS). Ezenkívül ez a két fehérje katalizálhatja a 3-meU demetilezését az ssRNS-ben, kissé nagyobb hatékonysággal, mint az ssDNS-ben lévő 3-meT demetilezése, ami arra utal, hogy a metilezett RNS-ek az FTO előnyös szubsztrátjai.
1. Bemutatkozás
A környezetből származó vagy a sejtek belsejében képződő alkilezőszerek megtámadhatják a nukleobázisok N- vagy O-atomjait, ami azonnali javítást igénylő alkilációs bázis károsodások kialakulásához vezethet [1]. Szinte az összes élő szervezet különböző gépeket fejlesztett ki, hogy felismerje és feldolgozza ezeket a módosításokat. Közülük az alkil-adduktok közvetlen eltávolítása a sérült bázisokról az egyik leghatékonyabb helyreállítási stratégia [2]. Az AlkB fehérjecsalád ezt a fajta közvetlen javítást hajtja végre egy oxidatív demetilezési mechanizmus felhasználásával (S1. Ábra).
A Escherichia coli Az AlkB fehérje az α-ketoglutarát (α-KG) - és Fe 2+ -függő dioxigenázok [2-9] szupercsaládjába tartozik. Homológjai vírusokban, baktériumokban és eukariótákban találhatók. Bár 2007 előtt nyolc emberi homológot (ABH1-8) azonosítottak [10, 11], csak az ABH2 és az ABH3 esetében igazolták, hogy az AlkB-hez hasonló javító funkcióval rendelkeznek [4, 5, 12]. Különösen azt találták, hogy az ABH2 felelős elsősorban az 1-metiladenin (1-meA) bázis elváltozásainak helyreállításáért a genomi DNS-ben, miközben az ABH3 pontos szerepe továbbra sem tisztázott [13]. Az ABH2 a kettős szálú DNS (dsDNS) szubsztrátumokat részesíti előnyben az egyszálú DNS (ssDNS) helyett; azonban mind a hABH3, mind az AlkB aktívabb az ssDNS és az egyszálú RNS (ssRNS) szubsztrátokkal szemben [4, 14]. Az AlkB – dsDNS és az ABH2 – dsDNS komplexek röntgenszerkezeti vizsgálataival csak nemrégiben derült ki ezeknek a fehérjéknek a szubsztrátpreferenciái mögött álló mechanizmusok [15]. Az ABH2 fehérje egy általánosan megfigyelt bázistekercselési mechanizmust alkalmaz egy ujjmaradékkal, amely interkalál a DNS duplex belsejében, hogy kitöltse a megfordított bázis által hagyott rést [15]. Az AlkB fehérje azonban összenyomja a DNS duplexet, hogy kiküszöbölje a bázis megfordításával hagyott rést. Ez az AlkB által a DNS-re gyakorolt torzítás megmagyarázza a rugalmas ssDNS-nek való preferenciáját a viszonylag merev duplex DNS-sel szemben [15] .
Mindhárom fehérje mutatta a legmagasabb aktivitást az 1-meA és a 3-metil-citozin (3-meC) [4-7] ellen, de alacsonyabb aktivitással az 1-metil-guanint (1-meG) és a 3-metil-timint (3) is képesek feldolgozni. ‐MeT) [16, 17]. Ezenkívül az AlkB, az ABH2 és az ABH3 kimutatták, hogy javítják az exociklusos DNS bázis elváltozásokat: 1,N 6-etenoadenin (εA) és (vagy),N 4-etenocitozin (εC) [18-20] .
2. Anyagok és módszerek
2.1. Az mFTO és a hFTO felépítése, expressziója és tisztítása
A teljes hosszúságú mFTO-t (képszám: 4237261) és a hFTO-t (GenBank hozzáférési szám: NP_001073901.1) kódoló cDNS-szekvenciákat pET28a-ba szubklónoztuk, hogy létrehozzunk egy His-jelölt fúziós fehérjét. A plazmidokat transzformáljuk E. coli A BL21 Star (DE3) és baktériumokat 50 mg/l kanamicint tartalmazó LB-agar lemezeken növesztettük. Az egyik napról a másikra termesztett táptalajokat, amelyeket aerob módon 37 ° C-on, 190 fordulat/perc rázási sebességgel tenyésztettünk, 1 l LB táptalaj 50 mg/l kanamicin beoltására használtuk, és 37 ° C-on és 250 fordulat/perc-en növesztettük, amíg az OD600 elérte a ~ 1,0 értéket. Ezután a baktériumsejteket izopropil-β-d-tiogalaktopiranoziddal (IPTG) (0,5 mM) indukáltuk 15 ° C-on, és egy éjszakán át 15 ° C-on és 250 fordulat/perc sebességgel növesztettük. A sejteket centrifugálással összegyűjtöttük, folyékony nitrogénnel lefagyasztottuk és -80 ° C-on tároltuk. Minden további lépést 4 ° C-on hajtottunk végre. A sejtpelleteket az A pufferben (50 mM imidazol, 300 mM NaCl, 50 mM nátrium-foszfát, pH 8,0) szuszpendáltuk, jégen ultrahanggal kezeltük és 12 000 fordulat/perc sebességgel 22 percig centrifugáltuk. A leszűrt felülúszót Ni-NTA kromatográfiával (GE Healthcare) tisztítottuk. Az oszlopból összegyűjtött frakciókat tovább tisztítottuk gélszűrő oszloppal (GE Healthcare). A frakciókat denaturáló SDS – PAGE-val elemeztük.
2.2 A metilált DNS és RNS helyreállítása mFTO és hFTO segítségével
A tipikus reakcióelegy (100 μl) tartalmazott DNS/RNS-t (1 nmol), FTO-t (0,05–0,5 nmol), (NH4) 2Fe (SO4) 2 · 6H2O (283 μM), α ‐ KG (300 μM), L‐ aszkorbinsav (2 mM), szarvasmarha szérumalbumin (BSA, 50 μg ml -1) és 50 mM 2‐ (N-Morfolino) etánszulfonsav (MES) puffer (pH 6,0). Ezt 12 órán át 16 ° C-on inkubáltuk. A reakciót etilén-diamin-tetraecetsav (EDTA) hozzáadásával 5 mM-re állítottuk le.
2.3 restrikciós enzim emésztési vizsgálat
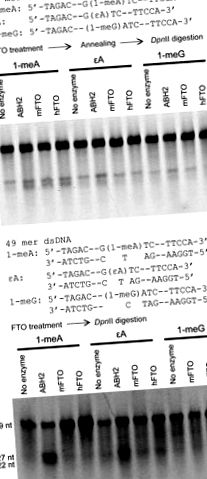
Egy korábban közzétett eljárást [13, 15] követtek egy 1-meA, 1-meG és eA-t tartalmazó 49-mer oligonukleotid DpnII hasítási szekvenciában történő javításának értékelésére. A szekvencia [5′-TAGACATTGCCATTCTCGATAG voltG (lecserélték 1 ‐ meG által) A (helyébe 1 ‐ meA vagy εA lép) TCCGGTCAAACCTAGACGAATTCCA-3 ′, kiegészítve az 5′-TGGAATTCGTCTAGGTTTGACCG-velGATCCTATCGAGAATGGCAATGTCTA ‐ 3 ′]. A reakciókat 37 ° C-on 1 órán át és 16 ° C-on 12 órán át folytattuk 0,2 nmol FTO és 0,2 nmol szubsztrátokkal. Az ssDNS esetében a szubsztrátumokat az emésztési vizsgálat komplementer szálához hevítettük, miután az FTO fehérjével és a kofaktorokkal inkubáltuk.
2.4 DNS/RNS emésztés és HPLC vizsgálat
A javítási reakció után a 15-mer ssDNS/ssRNS-t a P1 (Sigma, N8630) nukleázzal és az alkalikus foszfatázzal (Sigma, P4252) nukleozidokká emésztettük egy korábbi eljárás alapján [27]. Az emésztési oldatot izokratikus, nagy teljesítményű folyadékkromatográfiás (HPLC) rendszerben elemeztük, amely C18 elválasztó oszloppal (150 × 4,6 mm) volt felszerelve, amelyet A pufferrel (50 mM ammónium-acetátot tartalmazó HPLC minőségű vizes oldat) és B pufferrel (50 mM ammónium) egyensúlyoztunk. acetát, 50% acetonitril, 50% víz és 0,1% trifluorecetsav (TFA) 95: 5 (v/v) arányban, 1 ml/perc áramlási sebességgel szobahőmérsékleten. A detektálási hullámhosszt 266 nm-en (3-meT esetén) vagy 261 nm-en (3 meU-nál) állítottuk be.
2.5 Az mFTO és a hFTO kinetikája
Hogy meghatározza K m és K a javítási reakciók macskaértékeit, a kezdeti sebességet úgy kaptuk meg, hogy az enzimkoncentrációt állandó értéken tartjuk és a szubsztrátkoncentrációt változtatjuk. A reakciókat úgy állítottuk be, hogy biztosítsuk, hogy a szubsztrát kevesebb, mint 20% -a elhasználódott. Az összes reakciót 20 ° C-on hajtottuk végre három példányban, és az Origin 8.0 módszerrel elemeztük Michaelis – Menten egyenlettel.
3. Eredmények és megbeszélés
A teljes hosszúságú mFTO-t és hFTO-t klónoztuk, expresszáltuk és tisztítottuk (S2. Ábra). DpnII alkalmazásával restrikciós endonukleáz emésztési vizsgálatot alkalmaztunk mind a hFTO, mind az mFTO 1-meA, 1-meG és εA javítási aktivitásának értékelésére ssDNS-ben vagy dsDNS-ben [13, 15, 28]. A GATC-szekvenciába beépített 1-meA, 1-meG vagy εA-val módosított 49-merész DNS ellenáll a DpnII hasításának. Az alapelváltozás FTO általi eltávolítása lehetővé teszi a DpnII számára, hogy a 49-meros DNS-próbát két fragmensre hasítsa, biztosítva a javítási aktivitás vizsgálatát (1. ábra). Mint arról korábban beszámoltunk [21], mindkét fehérje nagyon alacsony aktivitását tapasztaltuk az 1-meA helyreállítása szempontjából 49-mer ssDNS-ben (1A. Ábra). Mindkét fehérje nem tudta helyrehozni az 1-meA-t dsDNS-ben (sztöchiometrikus mennyiség) 12 órás inkubálás után 16 ° C-on (1B. Ábra) vagy 1 óra inkubálás után 37 ° C-on (az adatokat nem mutatjuk be); míg a tisztított ABH2 ugyanolyan körülmények között jó javító aktivitást mutatott az 1-meA és az εA dsDNS-ben (1B. ábra). Ezenkívül nem figyeltünk meg mFTO vagy hFTO észrevehető aktivitását az εA és 1-meG irányában sem ssDNS-ben, sem dsDNS-ben. A 3-meT bázis elváltozása, amikor beépül a DpnII hasítási szekvenciába, nem tudta blokkolni a DNS-próba enzimatikus emésztését. Így egy másik vizsgálatot alkalmaztunk ennek az alapelváltozásnak a helyrehozásához.
Az FTO fehérjék által végzett 3-meT demetiláció vizsgálatához szintetizáltunk és megtisztítottunk egy 15-meres ssDNS-t [5'-CTTGTCA (3-meT) CAGCAGA-3 '], amelynek középső részén 3-meT volt. Ezt a DNS-t a nukleáz P1 és az alkalikus foszfatáz révén emésztettük nukleozidokká, majd HPLC-vel elemeztük. Amint a 2. A. ábra mutatja, a dC, dG, dT, dA és 3-medT nukleozidok tisztán elkülöníthetők. A 3-medT csúcs intenzitásának változását belső referenciaként más nukleozid csúcsokkal figyeltük meg. A 3 meT tartalmú ssDNS-t 12 órán át inkubáltuk mFTO-val vagy hFTO-val 16 ° C-on. A reakció leállítása után a 3-meT tartalmát emésztési vizsgálattal és HPLC-analízissel mértük. Az eredmények azt mutatták, hogy az ssDNS-ben a 3-meT teljes demetilezését végezte el az mFTO és a hFTO is (2A. Ábra). Amikor egy 15 meres 3-meC-tartalmú ssDNS-t ugyanazon javítási vizsgálatnak vetettek alá, a 3-meC csak ~ 15% -át demetilálták 12 óra múlva, azonos körülmények között (2B. Ábra), ami azt mutatja, hogy az FTO fehérjék erőteljesen preferálják a 3-at -MeT 3-meC felett.
A további vizsgálatokhoz azonban szinte elhanyagolható demetilezési aktivitást ([29] (S5. Ábra) és 300 μM α-KG-t választottunk. Ezután becsültük a pH-aktivitás profilját a 3-meT demetilezéséhez ssDNS-ben és 3‐3 meU ssRNS-ben. Az mFTO esetében a demetilációs aktivitás csökkenését figyeltük meg a pH növekedésével mind az ssDNS, mind az ssRNS szubsztrátok esetében (3. ábra A és B ábra). A hFTO azonban mind a sSDNS, mind az ssRNS szubsztrátok (3C. és D ábra), így a részletes kinetikai elemzéshez a pH 6,0 értéket választottuk.
A kinetikai vizsgálatokat 20 ° C-on hajtották végre, ssDNS vagy ssRNS szubsztrátok változó koncentrációjával. Az eredményeket a 4. ábra mutatja, és az 1. táblázat foglalja össze. Az mFTO fehérje magasabb aktivitást mutatott mind az ssDNS, mind az ssRNS szubsztrátok felé, mint a hFTO. Meg kell jegyezni, hogy ez az eredmény nem tükrözi ezen fehérjék in vivo aktivitását, mivel a tisztított rekombináns mFTO stabilabbnak tűnik, mint a tisztított rekombináns hFTO in vitro. A kinetikai vizsgálatok azt mutatták, hogy az mFTO és a hFTO is kétszeresen preferálja a 3-meU-t az ssRNS-ben, mint szubsztrátumban az ssDNS-ben a 3-meT-vel szemben. A kísérleteket három példányban megismételtük hasonló eredményekkel.
| mFTO | ssDNA (3-meT) | 1,92 ± 0,43 | 0,089 ± 0,008 | 0,046 ± 0,019 |
| ssRNS (3 meU) | 2,08 ± 0,31 | 0,199 ± 0,009 | 0,096 ± 0,029 | |
| hFTO | ssDNA (3-meT) | 0,95 ± 0,12 | 0,007 ± 0,0002 | 0,007 ± 0,002 |
| ssRNS (3 meU) | 8,51 ± 3,13 | 0,115 ± 0,022 | 0,014 ± 0,007 |
Összefoglalva, ez a tanulmány először hozta létre a rekombináns hFTO DNS/RNS demetilációs aktivitását (5. ábra). Az mFTO és a hFTO sem mutatott megfigyelhető aktivitást az ssDNS-ben az εA és az 1-meG felé. Az s-DNS-ben az 1-meA nagyon alacsony demetilációs aktivitását figyelték meg e két fehérje esetében. Katalizálhatják a 3-meC demetilezését is az ssDNS-ben, de sokkal alacsonyabb hatékonysággal, mint az ssDNS-ben lévő 3-meT. Az mFTO és a hFTO sem tudta helyrehozni a bázis elváltozásokat a dsDNS-ben, ami erősen azt sugallja, hogy részt vesznek az ssDNS vagy az ssRNS feldolgozásában.
Fontos, hogy kimutattuk, hogy a rekombináns hFTO és az mFTO in vitro is demetilezheti a 3-meU-t az ssRNS-ben (5. ábra). Az FTO fehérje RNS demetilezési aktivitása valamivel hatékonyabb, mint a 3-meT demetilezése ugyanazok a fehérjék által közvetített ssDNS-ben. Figyelembe véve a dsDNS szubsztrátok elhanyagolható javulását az FTO fehérjék által, valamint az ssRNS-ben az 3s-meU-val szembeni enyhe preferenciákat az ssRNS-ben az ssDNS-ben a 3-meT felett, vonzó az FTO-t RNS-demetilázként javasolni [21]. Talán egy korábban fel nem ismert RNS-metiláció fordított reakcióját katalizálja, és RNS-szinten génszabályozó funkciót fejt ki. Az FTO ezen szabályozó szerepének megzavarása az elhízás fenotípusához vezethet, amely ehhez a fehérjéhez kapcsolódik. Természetesen részletes in vivo kísérletek szükségesek a hipotézis további teszteléséhez. Ez a mostani munka az mFTO és a hFTO in vitro aktivitásának első átfogó értékeléseként szolgál, és megalapozza további vizsgálatát ennek a nagyon érdekes nukleinsav-demetiláznak a szerepéről.
- Egyszeres étrend; sassyfitnesschick
- Egyetlen összetevő egyszerűsége - gluténmentes zsálya
- Az AMG 133 egyetlen növekvő dózisának vizsgálata elhízott alanyokban - teljes szöveg nézet
- Az AMG 171 egyszeri és többszörös növekvő dózisú vizsgálata elhízott alanyokban - teljes szöveg nézet
- Oxidatív stressz, a placenta öregedésével kapcsolatos patológiák és a terhesség káros hatásai - Sultana -