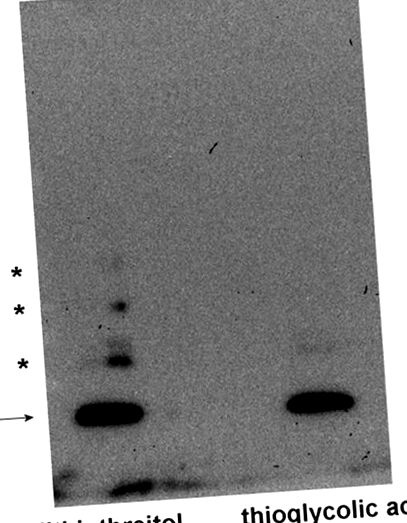
A ciszteinben gazdag fehérjék oxidációja a gélelektroforézis során
A fehérjék gélben való megjelenítésével kapcsolatban két fő stratégia érvényesült: a nem-specifikus fehérjefestés olyan festékekkel, mint a coomassie briliáns kék [4], vagy egy adott fehérje specifikus detektálása Western-blottolással [5]. Ezenkívül egy SDS-PAGE variánst, amelyet később szimbólumnak neveznek el, bevezették a hidrolitikus aktivitással felruházott fehérjék, különösen proteázok gélen belüli megjelenítésére. Ez a módszer a vizsgált proteáz specifikus szubsztrátumának a poliakrilamid-gélbe történő beépítésén alapul. Elektroforetikus szétválasztás után a gélt megfelelő pufferben inkubáljuk annak biztosítása érdekében, hogy az eredeti mintában esetlegesen jelen lévő proteázok ismét enzimatikus aktivitást kapjanak és a szubsztrátot in situ megemésztessék. A gélt ezután festjük, például coomassie kékkel, és a proteolízis helyei fehér csíkként jelennek meg kék alapon [6].
Az SDS-PAGE-t, mint a fehérjék tömegük szerinti elválasztásának módszerét Ulrich K. Laemmli 1970-ben tovább javította [7]. Az új eljárás szerint a fehérjemintákat SDS-sel denaturáljuk 2-merkaptoetanol jelenlétében, amely redukálószer eltávolítja a fehérjékben lévő ciszteinmaradékok között bármilyen diszulfidkötést, akár természetes, akár mesterségesen indukált. A vegyület a ciszteinek későbbi oxidációját is megakadályozza, és redukált állapotban tartja őket. Egy évvel később Grant Fairbanks et al. tovább tökéletesítette az eritrocita membránfehérjék elemzésének protokollját azáltal, hogy a 2-merkaptoetanolt ditiotreitollal helyettesítette, egy dimerkaptán redukálószerrel, amely erősebb, mint maga a 2-merkaptoetanol [8].
Általános meggyőződés, hogy a fent leírt standard körülmények között végzett elektroforetikus szétválasztás során a fehérjék elég jól megőrződnek az oxidációtól, de ez kiderül, hogy nem igaz. Valójában az elektroforetikus gél erős prooxidáns környezet, aminek oka az ammónium-perszulfát maradék nyomainak elkerülhetetlen jelenléte, amelyet a gél előállításakor használnak az akrilamid polimerizációjának katalizálására. Ezenkívül az elektroforetikus gélek pH-értékénél a 2-merkaptoetanol és a ditiotreitol is töltetlen állapotban vannak. Ezért nem vándorolnak együtt a fehérjékkel, és nem tudják ellátni védő funkciójukat az elektroforetikus futtatás során. Általában ez a jelenség az SDS-PAGE egymásra rakási fázisában fordul elő [9], amikor a fehérjék nagyon kis térfogatra koncentrálódnak. Ennek következménye az anomáliás, nagy molekulatömegű fehérje aggregátumok képződése, amelyek a halmozó és a rezolváló gélek közötti határfelületen maradnak.
Ezek a tárgyak a kísérleti eredmények téves értelmezéséhez vezethetnek. Megelőzésük érdekében a tiolcsoportok különféle alkilező szerekkel történő védelme alkalmazható [10]. Alternatív megoldásként egy egyszerűbb módszer a minta kezelése tioglikolsavval. Ez a vegyület alacsony pKa-értékének köszönhetően anionos állapotban van a halmozó és rezolváló gélek pH-értékénél, és az elektroforézis során az anód felé mozoghat. Ezenkívül a tioglikolátion alacsony molekulatömegű, és gyorsabban vándorol, mint az összes fehérje, eltávolítva a maradék ammónium-perszulfátot, mielőtt az reagálni tudna önmagukkal a fehérjékkel.
Az oxidáció sebessége a fehérjében lévő ciszteinmaradékok oxidálószerekhez való hozzáférhetőségétől függ, a jelenséget a magas ciszteintartalmú fehérjék részesítik előnyben. A humán IP-10 kemokin esetében egyértelműen bebizonyosodott, hogy az SDS-PAGE során a cisztein oxidációja által közvetített térhálósodás iránti fokozott hajlam ellensúlyozható a ciszteinek megelőző alkilezésével [9]. Újabban két különböző emlős β-defenzin esetében is találtak bizonyítékot a gélen belüli oxidációra. Ez azonban kielégítő kísérleti tesztekkel nem bizonyított [12,13].
A fehérjék ciszteintartalma változóbb, mint bármely más aminosavé. Az emlős extracelluláris fehérjék átlagos ciszteintartalma 4,1% (az összes aminosav százalékában kifejezve). Ezzel szemben az intracelluláris fehérjék átlagos ciszteintartalma 1,6% [14]. Az intracelluláris emlős fehérje, amely a ciszteinek magas tartalma miatt jelent kivételt, a metionin-szulfoxid-reduktáz B1 (MsrB1, eredeti neve SelR), amely egyike az emberi genom 25 szelenoproteinjének és egyike azon kevés szelenoproteineknek, amelyek funkciója ismert [15 ]. Az MsrB1 az enzimek (MsrAs és MsrBs) nagy családjába tartozik, amelyek felelősek a metionin-szulfoxid redukciójá metioninná, mind szabadon, mind pedig polipeptidláncokba beépítve [16]. Az MsrB1, amely egy katalitikus szelenociszteinnel és öt ciszteinnel van felszerelve, amelyek közül az egyik részt vesz a katalitikus mechanizmusban a szelenocitain maradékkal együtt, a ciszteinek (beleértve a szelenociszteint) tartalma 5,2%, jóval meghaladja az intracelluláris emlősök átlagos tartalmát fehérjék.
Ban ben 1.ábra , nyilvánosságra hoztuk, hogy a rekombináns humán MsrB1 (amely a szelenocisztein helyett ciszteint tartalmaz) ditiotreitollal redukálva, SDS-PAGE és Western-blot hatásának vetve alá, a fő sáv látszólagos molekulatömege 13 kDa. Ugyanakkor más, kevésbé intenzív sávok is láthatók, amelyek nagy valószínűséggel körülbelül 25, 40 és 50 kDa molekulatömegű fehérje aggregátumokat képviselnek (állítólag az MsrB1 dimer, trimer és tetramer formái). A ditiotreitol helyett a tioglikolsav használata teljesen elnyomja ezen extra sávok képződését, egyértelműen jelezve, hogy ez a jelenség az elektroforézis során fordul elő és cisztein oxidációval jár.
Az eljárásokat lényegében a korábban beszámoltak szerint hajtották végre [19]. Az MsrB1-et 1% (w/v) ditiotreitollal vagy 0,01% (w/v) tioglikolsavval (végső koncentrációk) kezeltük, és 5-15% -os gradiens SDS-PAGE-nak vetettük alá (2 ng MsrB1 minden mintához). Az elektroforézis után a fehérjéket Western-blot segítségével elektrotranszferáltuk a PVDF membránra, majd nyúl poliklonális anti-MsrB1-gyel (Abcam, Cambridge, Egyesült Királyság) és megfelelő másodlagos torma-peroxidáz-konjugált antitesttel kezeltük az MsrB1 detektálására a továbbfejlesztett kemilumineszcencia detektáló reagens (GE Healthcare, Chicago, USA). A nyíl az MsrB1, a csillagok pedig az MsrB1 aggregátumokat jelzik.
Az MsrB1 a fehérjék kis csoportjába tartozik, amelyek kritikát mutatnak az elektroforetikus elemzés során a magas ciszteintartalmuk által okozott extrém reaktivitás miatt. Lehet, hogy nem minden. Valójában az MsrB1, az egyéb MsrB izoformák mellett, a legmagasabb enzimatikus aktivitást mutatja, mivel aktív helyén szelenocisztein van jelen. A rekombináns MsrB1, amelyben a ciszteinnel helyettesítették a szelenociszteint, 800-szor alacsonyabb enzimatikus aktivitást mutat, mint a natív szelenoenzim [17]. Ez a sajátosság a szelenolát intenzív nukleofilitásától függ, amely hét nagyságrenddel magasabb, mint a tioláté [18]. A szelenocisztein megnövekedett kémiai reaktivitása az MsrB1 még érzékenyebbé teheti az oxidációra az SDS-PAGE során.
Az MsrB1 ezen ritka jellemzőit nem veszik figyelembe a fehérje elektroforetikus vizsgálata során. Legjobb tudomásunk szerint az erről a témáról készült összes publikációban csak szabványos SDS-PAGE protokollokat fogadtak el, köztük azt is, amelyet mi magunk adtunk ki a vérsejtekben található Msr enzimekről [19].
A leírt műtárgyak - nem mindig felismerhető ictu oculi - kialakulása az eredmények téves értelmezéséhez vezethet. Véleményünk szerint a magas ciszteintartalmú fehérjék, például az MsrB1 SDS-PAGE elválasztását nem szabad olyan redukálószerekkel végezni, mint a 2-merkaptoetanol vagy a ditiotreitol, amelyek nem képesek garantálni a megfelelő védelmet. A tioglikolsav, a fent leírt előnyös kémiai tulajdonságoknak köszönhetően, lehet a legjobb alternatíva a fehérje-tiol- és szelenolcsoportok redukált formában történő fenntartásának biztosításához az oxidáció megakadályozásával az elektroforetikus menet során.
Összefoglalva, javasoljuk egy gondos megelőző vizsgálatot annak megértése érdekében, hogy a rutinszerűen alkalmazott protokollok alkalmasak-e olyan „speciális” fehérjék, például az MsrB1 vizsgálatára. Az e stratégiából fakadó nagyobb munkateher szigorúbb megközelítést garantál, és megbízhatóbb eredmények elérését teheti lehetővé.
- A fehérjék és a fogyás hogyan befolyásolják a fehérjék a fogyást GymBeam Blog
- Biológiailag aktív anyagok lézeres elektroforézisének alkalmazása kombináltan
- Fehérjék a fogyáshoz 4 ok, amiért mindennap ezeket kell enni reggelire
- A műtéti fogyás által megváltozott fehérjék emeljék ki az inzulinrezisztencia biomarkereit a
- Orbakaite megmutatta, hogyan nőtt fel a fia - Newsy Today