A CK2.1, egy csont morfogenetikus fehérje receptor Ia típusú utánzó peptid, helyreállítja a porcot destabilizált mediális meniszkusszal rendelkező egerekben
Absztrakt
Háttér
A térd osteoarthritis (OA) magában foglalja a diarthrodialis ízületek ízületi porcainak degenerálódását. A jelenlegi kezelési lehetőségek ideiglenesen enyhítik az ízületi fájdalmat, de nem állítják helyre az elveszett porcot. Nemrégiben megterveztünk egy új típusú csont morfogenetikus fehérje receptor I típusú (BMPRI) mimetikus peptidet, a CK2.1-et, amely aktiválja a BMPRIa jelátvitelt csont morfogenetikus fehérje (BMP) hiányában. Korábbi kutatásaink kimutatták, hogy a CK2.1 in vitro és in vivo chondrogenesist indukált; azonban nem ismert, hogy a CK2.1 helyreállítja-e a sérült ízületi porcot in vivo. Ebben a tanulmányban bebizonyítottuk, hogy a CK2.1 izületi porc (AC) javulást indukált egy OA egér modellben.
Mód
Olyan hialuronsav (HA) alapú hidrogél részecskéket (HGP) terveztünk, amelyek lassan szabadítják fel a CK2.1-et. A HGP-CK2.1 részecskék kondrogén hatékonyságát teszteltük pluripotens mezenhimális őssejteken (C3H10T1/2 sejtek), és lokálisan injektáltuk az intraartikuláris kapszulába porchibákkal rendelkező egerekben. C57BL/6J egereket operáltunk a medialis meniscus destabilizálása érdekében, és ezeket az egereket a műtét után 6 hétig tartottuk az OA-szerű károsodás fenntartása érdekében. Ezután az egereket az intraartikuláris kapszulán keresztül HGP-CK2.1-vel injektáltuk; Az injekció beadása után 4 héttel az egereket leöltük, és combcsontjaikat porchibákra elemeztük.
Eredmények
A porc immunohisztokémiai elemzése kimutatta, hogy az AC teljes javulást mutat az álműtött egerekhez képest. Az immunfluoreszcencia elemzés a HGP-CK2.1-vel injektált egerek AC-jában a IX-es típusú kollagén termelését és a II-es típusú kollagént mutatta ki. A foszfáttal pufferolt sóoldattal (PBS) és önmagában a HGP-vel injektált egereknél nagyobb volt a X típusú kollagén és az osteocalcin termelés, szemben a HGP-CK2.1-vel injektáltakkal, ami fokozott kondrocita hipertrófiára utal.
Következtetések
Eredményeink azt mutatják, hogy a lassan felszabaduló HGP-CK2.1 a porc javulását a kondrocita hipertrófia kiváltása nélkül hajtja végre. A CK2.1 peptid hatékony eszköz lehet a javítási folyamathoz hozzájáruló jelátviteli utak megértésében, és potenciális terápiaként alkalmazható degeneratív porcbetegségek, például OA kezelésére is.
Háttér
Az ízületi porc (AC) egy viszkoelasztikus kötőszövet, amely a combcsont ízületi végeit takarja, és elengedhetetlen az ízületek szabad mozgásához. Kondrocitákból áll, amelyek felelősek az extracelluláris mátrix (ECM) termeléséért ezen a szöveten belül. Ez az ECM hálózat fenntartja a csuklón át történő mechanikus préselés teherbíró tulajdonságait [1]. Az oszteoartritisz (OA) egy porc anyagcsere-betegség, amely évente 21,7 millió embert érint, és a fogyatékosság szempontjából a tizenegyedik legnagyobb mértékben járul hozzá, és évente több mint 28,5 milliárd dollárba kerül [2–4]. Az OA-ban az AC progresszív ECM-veszteségen, fokozott kondrocita hipertrófián és kondrocita apoptózis vesztésen megy keresztül [5]. A kondrogén ECM proteoglikánokból áll, például agregánokból és kollagénekből, beleértve a II., A IX. És a XI. Típust, amelyek keresztkötéses hálózatot alkotnak biológiai tulajdonságainak szabályozására [6]. Ennél is fontosabb, hogy az AC egy avaszkuláris szövet, és gyenge szövetregeneráló képességgel rendelkezik. Ezenkívül az OA-val együtt jár a subchondralis csont átalakulása és szklerózisa, valamint osteophyták képződése [7].
Az OA progresszióját befolyásoló számos növekedési faktor közül a csontmorfogenetikus fehérjék (BMP), mint például a BMP2, nagymértékben felgyorsítják az AC teljes veszteségét [8]. Érdekes módon a BMP2 egy erős növekedési faktor, számos pleiotrop funkcióval, beleértve az AC képződést is [9, 10]. A BMP2 is ismert, hogy kondrocita hipertrófiát indukál, amelyet porc meszesedés követ, [10]. Ezért a BMP2 nem lehet értékes a porc helyreállítására degeneratív betegségek, például OA esetén.
Mód
Az összes 10 hetes hím C57BL/6 J egeret a The Jackson Laboratory-ból (Bar Harbor, ME, USA) szereztük be, és hagyományos tartási körülmények között tartottuk fenn. Az állati protokollt az IACUC hagyta jóvá a Delaware Egyetemen. 10 hetes hím egerek (n = 6/csoport) négy csoportban választottuk el egymástól: HGP-CK2.1-, HGP- és PBS-injektált csoportokat és ál-operált egereket.
A mediális meniszkusz műtéti destabilizálása
A peptidek megtervezése
A peptideket csoportunk tervezte a korábban leírtak szerint [11]. A BMPRIa-ban nagy valószínűséggel előforduló mintákat tartalmazó proszti keresés lehetséges CK2 foszforilációs helyeket eredményezett a 466–469 (SYED) aminosavakon. A peptideket az Antennapedia homeodomain szignálszekvenciájával terveztük a sejtfelvételhez, és ezeket a kötési helyek egyikébe építettük be: CK2.1 (SYED). A peptidek mindegyik oldalán több aminosavmaradékot tartalmaztak [15].
CK2.1-konjugált HGP-k előállítása
A CK2.1 in vitro felszabadulása
2 mg HGP-CK2.1-t (0,5 ml) PBS-ben diszpergálunk állandó forgatás mellett, 37 ° C-on. Előre meghatározott időpontokban a felülúszót centrifugálással (3000 fordulat/perc 5 percig) gyűjtöttük össze, és a felszabaduló táptalajt egyenlő mennyiségű friss PBS-sel töltöttük fel. A felszabaduló peptidet PBS-ben UV-Vis spektrofotométerrel számoltuk 280 nm-en. A kumulatív felszabadulást a tápközegbe adott időben felszabaduló CK2.1 peptid teljes mennyiségének kiszámításával számítottuk a kezdeti terheléshez viszonyítva.
Sejtkultúra
A C3H10T1/2 sejteket az American Type Culture Collection-től (CCL-26) (Manassas, VA, USA) szereztük be, és az egyrétegű tenyészeteket Dulbecco módosított Eagle-táptalajában (DMEM; Mediatech, Manassas, VA, USA) tenyésztett T-75 lombikokban tartottuk. 10% (v/v) szarvasmarha-magzati szérummal (FBS; Gemini Bioproducts, West Sacramento, Kalifornia, USA), 0,5% (v/v) l-glutaminnal (Mediatech) és 1% (v/v) penicillinnel kiegészítve/sztreptomicin (100 NE/ml penicillin, 100 μg/ml sztreptomicin; Fisher Scientific, Pittsburg, PA, USA). A tenyészeteket 37 ° C-on és 5% CO2-tartalom mellett levegőben inkubáltuk, és a sejteket 90% -os összefolyás mellett passzáltuk 0,05% (v/v) tripszin-EDTA-val (Gemini Bioproducts).
Alcian kék festés
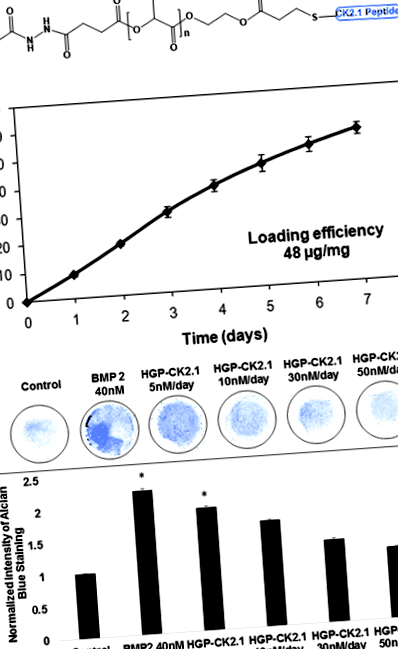
A C3H10T1/2 sejteket beoltottuk 1 × 107 sejt/ml koncentrációban, és 10 μl-es mikromasszas tenyészetként szélesztettük 1,9 cm 2 -es 24-lyukú lemezre (Nunc, Rocskilde, Dánia). A sejteket 10% (v/v) FBS-sel ellátott DMEM-mel egészítettük ki, és 37 ° C-on és 5% CO2-nál inkubáltuk. A sejteket ezután rekombináns BMP2-vel (40 nM; GenScript, Piscataway, NJ, USA) vagy HGP-CK2.1-vel (5 nM vagy 10 nM vagy 30 nM vagy 50 nM/nap felszabadulási koncentrációval) stimuláltuk.
Hét nappal a stimulálás után a tenyészeteket fixáltuk 10% (v/v) semleges pufferelt formalin (pH 7,4) alkalmazásával, 0,05 tömeg% -os cetil-piridinium-kloriddal keverve 20 percig szobahőmérsékleten. A sejteket háromszor 3% (v/v) jégecettel (pH 1,0) öblítettük, és 0,5% (w/v) Alcian blue 8-GX festékkel (Life line, Walkersville, MD, USA) egy éjszakán át festettük. Festés után a tenyészeteket 3% (v/v) jégecettel (pH 1,0) mossuk és levegőn szárítjuk. A festett tenyészeteket invertált fénymikroszkóp alatt (Nikon, TMS-f) tekintettük meg 20x-os nagyítással, az összegyűjtött képeket pedig ImageJ szoftverrel (NIH, Bethesda, USA) elemeztük és mennyiségileg meghatároztuk [18].
Szövettani pontozás
Két héttel az utolsó intraartikuláris injekciók után az egereket leöltük, és a boncolt combcsontokat 10% (v/v) semleges pufferelt formalinban (Sigma Aldrich, St. Louis, MO, USA) rögzítettük és 5 napig 5% -ban meszeztük. (v/v) hangyasav 10 tömeg% -os nátrium-citrátban (Sigma Aldrich). Combcsontminták (n = 6/csoport) paraffinba ágyazottuk és metszettük 6 μm vastagságban. A metszett tárgylemezmintákat Safranin O és gyors zöld festés alkalmazásával festettük [19, 20]. A pontozást a térd négy részében hajtottuk végre, módosított szemikvantitatív pontozási skálával, a korábban leírtak szerint [14]. Az ebben a vizsgálatban alkalmazott pontozási elemzés a következő volt: 0 = normál porc, 0,5 = normál ízületi felületű szafranin O festés elvesztése, 1 = kicsi fibrillációk vagy érdesített ízületi felület és 2 = a felületes rétegbe nyúló fibrillációk. Minden elemzett térdnél 12, az egész ízületet ábrázoló diát vakítottak el, és két független megfigyelő pontozta őket.
Immunfestés
Szekcionált combcsontminták (n = 6/csoport) (előkezeltük xilolban 10 percig a paraffin eltávolítása érdekében) inkubáltuk herehialiálidonázzal 30 percig, hogy a kollagén epitópok megjelennek. A mintákat 1 órán át szobahőmérsékleten immunfluoreszcensen jelöltük vagy nyúl poliklonális IgG II típusú kollagénnel (10 μg/ml; ab34712; Abcam, Egyesült Királyság), majd Alexa 488 szamár anti nyúl IgG-vel (2 μg/ml; Invitrogen, Eugene, OR), USA) vagy nyúl poliklonális IX-es kollagén (10 μg/ml; Abcam), majd Alexa 647 kecske anti-nyúl IgG (2 μg/ml; Invitrogen) vagy nyúl (Rb) pAb kollagén X (10 μg/ml; ab58632; Abcam) ), amelyet Alexa fluor 488 szamár anti-nyúl (2 μg/ml; Invitrogen) vagy nyúl poliklonális IgG osteocalcin követ (10 μg/ml; Santa Cruz Biotechnology, Kalifornia, USA), majd Alexa fluor 488 szamár anti-nyúl (2 μg/ml). ml; Invitrogen). Az antitesteket 3% (w/v) szarvasmarha szérum albuminnal (BSA) hígítottuk. A magfesték-biszbenzimidet (Sigma Aldrich; Hoechst festék 33258. szám, vízben oldva) 5 percig adagoltuk, és a fedőlapokat a tárgylemezekre rögzítettük az Airvol alkalmazásával, ahogy azt korábban leírtuk [21, 22]. Képek készültek (n = 8 kép metszet/minta) a Zeiss 780 konfokálison 20 × objektívvel (0,75NA, Sugárosztó (MBS) 458/514/561/633, 5% lézer kimenettel és (MBS) 405, 2% lézer kimenettel) . A képeket ImageJ (NIH, Bethesda) segítségével számszerűsítettük.
Statisztikai adatok elemzése
Az összes bemutatott adatot egyetlen faktor varianciaanalízissel (ANOVA) elemeztük, amelyet Tukey-Kramer post-hoc teszt követett. Az összes kísérletet háromszor vagy többször megismételtük, és a kontrollra normalizáltuk. A hibasávok az átlag standard hibáját (SEM) jelentik, ahol * a statisztikai szignifikanciát jelöli o
Eredmények
A HGP-k kontrollált módon szabadítják fel a CK2.1-et
A CK2.1-et kovalensen konjugáltuk a HGP-khez Michael-addícióval, ciszteinnel jelölt peptid és akrilezett HGP-k alkalmazásával (1a. Ábra). Körülbelül 48 μg CK2.1-et konjugáltak 1 mg HGP-hez. A peptid felszabadult (1b. Ábra) a HGP-kből +9,4 tömeg%/nap sebességgel a 0. naptól a 4. napig és +5,3 tömeg%/nap sebességgel a 4. naptól a 7. napig. 7. napra, amikor a kísérlet befejeződött, az eredetileg töltött peptid összesen 54,6 tömeg% -a szabadult fel a részecskékből.
Ezután a C3H10T1/2 mezenkimális progenitor sejteket használtuk mikromasszas tenyészetekben a lassan felszabaduló HGP-CK2.1 kondrogén hatékonyságának tesztelésére. Korábbi vizsgálatunk pozitív kondrogén aktivitást mutatott a C3H10T1/2 sejtek között a CK2.1-vel stimulált mikromasszas tenyészetekben 100 nM (legalacsonyabb) és 500 nM (legmagasabb) CK2.1 koncentrációk között [13]. Ezért a C3H10T1/2 sejtek mikromasszas tenyészeteit HGP-CK2.1 koncentrációkkal stimuláltuk, a CK2.1 50 nM vagy 100 nM vagy 300 nM vagy 500 nM összkoncentrációja alapján számítva. A CK2.1 HGP-ből való felszabadulását azonban a kezdeti terhelésből felszabaduló CK2.1 teljes mennyiségének kumulatív felszabadulása alapján jegyezzük meg. A következő koncentrációk korrigált HGP-CK2.1 (+ 9,4%/nap) felszabadulási értéke (50 nM) 5 nM/nap, (100 nM) 10 nM/nap, (300 nM) 30 nM/nap, és ( 500 nM) 50 nM/nap (1c. Ábra). A HGP-CK2.1 egyszeri kezelése 7 napon át, adott koncentrációkon, C3H10T1/2 mikromasszas tenyészeteken mutatta a legjobb kondrogén aktivitást 5 nM/nap koncentráció mellett, amint azt Alcian blue festéssel alkalmazták.
A HGP-CK2.1 intraartikuláris injekciói helyreállították a porc homeosztázisát DMM egerekben
A mediális meniszkusz modell műtéti destabilizálása olyan technika, amely lehetővé teszi az AC elváltozás kialakulását a mediális tibialis fennsík és a mediális kondíliák súlyt viselő régióiban [14]. Ez tükrözi legjobban a porc károsodásának OA-szerű fejlődését, ezáltal ideális modell egereken végzett vizsgálatunkhoz. A mediális meniszkusz destabilizálását hím C57BL/6 J egereken végeztük (n = 6/csoport) 10 hetes korban OA-szerű változások kiváltására. A műtét után 6 héttel az egereknek PBS-t, 6 μM HGP-CK2.1-t (a felszabadult CK2.1-peptid teljes mennyisége alapján kiigazítva a kezdeti terheléshez igazítva) vagy HGP-t önmagában intraartikulárisan injektáltunk minden 2 hét. A HGP-CK2.1 koncentrációját 6 μM-on olyan peptidterhelési adatok alapján választottuk meg, amelyek napi 500 nM-os CK2.1-felszabadulást mutatnak. Ezeket az egér combcsontmintákat Mankins módosított szemikvantitatív analízissel dolgoztuk fel és értékeltük a porc károsodása szempontjából [20]. A szövettani pontozás és elemzés kimutatta, hogy a HGP-CK2.1-vel injektált egereknek volt a legkevesebb OA-károsodása és nagyobb a porcjavulásuk, mint azokhoz, amelyeket kizárólag HGP-vel vagy PBS-sel injektáltak, az áloperált csoporthoz képest (2. ábra). Megjegyzendő, hogy csak a PBS-sel injektált egereknek volt a legnagyobb pontszáma a károsodás szempontjából, amelyet mélyebb repedések és a proteoglikán tartalom elvesztése lát.
A HGP-CK2.1-vel injektált DMM egerek fokozottan expresszálták a II és IX típusú kollagént
A szövettani elemzés kimutatta, hogy a HGP-CK2.1-vel injektált DMM egerek mutatták ki a porc legjobb helyreállítását a HGP- vagy PBS-injektált egerekhez képest. Az újonnan regenerált porc ECM-összetételének azonosításához immunfestést végeztünk a II és IX típusú kollagén DMM térdmintáinak porcáról. A HGP-CK2.1-vel injektált DMM térdek elemzése azt mutatta, hogy a II-es típusú kollagén termelése konzisztens volt a HGP- vagy PBS-injektált egerekhez képest. A HGP-CK2.1-vel injektált minták azonban a IX-es típusú kollagén szintjének emelkedését mutatták, összehasonlítva a HGP- vagy PBS-injekciójú egerekkel (3. ábra). Ez a felfedezés a magas szintű kollagén IX típusú AC-ban összhangban volt korábban ismertetett in vivo munkánkkal [13].
A HGP-CK2.1 II típusú és IX típusú kollagén expressziót váltott ki AC-ban. A PBS-sel vagy HGP-CK2.1-vel vagy HGP-vel injektált DMM-egereket és ál-operált egereket immunfestettük a II-es típusú kollagénre (piros) és a IX.bíborvörös) és Hoechst (kék) a rezidens sejt magjának és helyének ellenfestésére használták. A HGP-CK2.1 injekcióval ellátott egerek magas szintű IX típusú kollagént mutattak, összehasonlítva mind a HGP, mind a PBS injekcióval beadott kontroll egerekkel. Mérlegsávok = 100 μm. AC ízületi porc, HGP hidrogél részecske, MF középső combcsont, MC velőüreg, PBS foszfáttal pufferolt sóoldat, PC patellaüreg, ÁL ál-működtetett
A X típusú kollagén és az osteocalcin expressziójának fokozott expressziója HGP- és PBS-injekcióval ellátott egerekben, de nem HGP-CK2.1 injekciójú egerekben
A HGP-vel injektált egerek mérsékelt porcregenerációt mutattak a PBS-hez képest, míg a X típusú kollagén jelentős növekedését figyelték meg a HGP-vel injektált mintákban, hasonlóan a PBS-vel injektált egerekéhez. A HGP-CK2.1-vel injektált minták azonban a X típusú kollagén alacsony expresszióját mutatták a porcmátrix helyreállításának régióiban (4. ábra). Erről a megállapításról korábban már beszámoltunk in vivo munkánkban [13]. Ezenkívül a HGP-CK2.1 DMM egérminták nem mutattak osteocalcin expressziót, amint azt a PBS-be injektált egérmintáknál megfigyeltük (5. ábra).
A PBS-sel és HGP-vel injektált DMM egerek az X típusú kollagén expresszióját indukálták az ízületi porcokban, de a HGP-CK2.1 nem. PBS-sel vagy HGP-CK2.1-vel (6 μM) vagy HGP-vel injektált DMM-egereket és ál-operált egereket immunfestettünk X típusú kollagénre (zöld) és Hoechst (kék) segítségével meghatároztuk a rezidens sejt magját és helyét. Az immunfestés fokozott X típusú kollagén expressziót mutat a PBS-sel és HGP-vel injektált egerek AC-jában, de nem HGP-CK2.1-vel injektált egerekben. Mérlegsávok = 100 μm. AC ízületi porc, HGP hidrogél részecske, MF középső combcsont, MC velőüreg, PBS foszfáttal pufferolt sóoldat, PC patellaüreg, ÁL ál-operált
A PBS-sel injektált DMM egerek fokozott osteocalcin expressziót mutattak, a HGP-CK2.1 injekcióval nem. PBS-sel vagy HGP-CK2.1-vel (6 μM) vagy HGP-vel injektált DMM-egereket és ál-operált egereket immunfestettünk osteocalcinra (zöld) és Hoechst (kék) segítségével meghatároztuk a rezidens sejt magját és helyét. Az immunfestés fokozott osteocalcin expressziót mutat a PBS-vel injektált egerek AC-jében, de nem a HGP-CK2.1-vel injektált egerekben. Mérlegsávok = 100 μm. AC ízületi porc, HGP hidrogél részecske, MF középső combcsont, MC velőüreg, PBS foszfáttal pufferolt sóoldat, PC patellaüreg, ÁL ál-operált
Vita
Az OA-t a porcszövet lassú, progresszív degenerációja jellemzi. Ez magában foglalja a proteoglikánok köré szerveződött szerkezeti és mechanikai integritás megzavarását, valamint a II., IX. És XI. Típusú fibrilláris struktúrák kollagénvázának [7] kollagén vázát. Az állatok mediális meniszkuszának műtéti destabilizálása szolgál OA modellként [14]. Ezért DMM műtéttel OA-szerű károsodást váltottunk ki az AC-ben. Bár az instabilitási modellek, mint a DMM, jelentős károsodást mutatnak az AC-ben, meg kell jegyezni, hogy a belső sejtes OA-szerű mechanizmusok nem replikálhatják a betegség természetes előfordulását az ízületek öregedése során. Ezek az OA állatmodellek hajlamosak kialakulni az abnormális biomechanikai terhelés iránti érzékenységre az ízületi traumát követően, ideértve a regeneratív változásokat, például a szubkondrális csont átalakulást vagy az oszteofita képződést [14]. Azonban a DMM-modell biztosította az OA-körülményeket emuláló AC legjobb reprodukálhatóságát és progresszív lebomlását [14]. Emiatt ebben a vizsgálatban a DMM modellt alkalmazták. Ezenkívül a CK2.1 peptid intraartikuláris injekcióinak minimalizálása érdekében szabályozott felszabadulású rendszert alkalmaztunk a sérülés lokalizált helyén.
Következtetések
Az OA egy idiopátiás porc degeneratív betegség. Jelenleg nincsenek olyan gyógyszerek, amelyek helyrehozhatnák az elveszett porcot. A növekedési faktor szignál útjainak felhasználásával a kutatók megpróbálják kezelni ezt a kérdést. Azonban a növekedési faktorok, mint például a BMP, pleiotróp természetűek, és köztudottan fokozzák a kondrocita differenciálódást és a kondrocita hipertrófiáját. Megterveztünk egy új peptidet, a CK2.1-et, amely a ligandum hiányában aktiválja a BMPRIa-t [31, 32]. Korábbi tanulmányunk kimutatta a CK2.1 által kiváltott chondrogenesis hatékonyságát in vitro és a porc növekedését in vivo [13]. Ebben a tanulmányban bemutatjuk a CK2.1 hatását a porc helyreállítására egy OA egérmodellben, amely összehasonlítható volt az álműtött egerekkel a kondrocita hipertrófia kiváltása nélkül. Ezek az eredmények összhangban vannak korábbi tanulmányunkkal [13]. Ezért egyedülálló lehetőségünk van megérteni azokat a jelátviteli utakat, amelyek hozzájárulnak a porcképződéshez és a porc helyreállításához. Ez a peptid, a CK2.1, felhasználható a jövőbeni terápiás fejlődéshez a porc degeneratív betegségek kezelésében is.
- A neuronális apoptózis gátló protein 1 (NAIP1) törölt egerek hippokampusos neuronjai megjelenítik
- A Top 5 fehérjepor a férfiak számára 2020-as frissítés
- Súlygyarapodás-receptor az antipszichotikus gyógyszerekhez kapcsolódva - Neuroscience News
- Súlynövelő fehérje - Tudjon meg többet a súlygyarapító fehérjéről - Vásároljon súlygyarapító fehérjét - Nutrition Express
- Melyek a legjobb olcsó fehérjeforrások A legtöbb 15-tel a lehető legnagyobb durranás érhető el