A DEP-1 elvesztése (Ptprj) elősegíti a mieloproliferatív betegséget FLT3-ITD akut mieloid leukémiában
Anne Kresinsky
1 Molekuláris Sejtbiológiai Intézet, Molekuláris Biomedicina Központ (CMB), Jenai Egyetemi Kórház
Reinhard Bauer
1 Molekuláris Sejtbiológiai Intézet, Molekuláris Biomedicina Központ (CMB), Jenai Egyetemi Kórház
Tina M. Schnöder
2 Innere Medizin II, Hämatologie und Onkologie, Jenai Egyetemi Kórház
3 Leibniz Öregedési Intézet, Fritz-Lipmann-Intézet (FLI), Jena
Tobias Berg
4 II. Orvostudományi Osztály, Hematológia/Onkológia, Goethe Egyetem, Frankfurt
Daria Meyer
5 Hálózati modellezés, Leibniz Természetes Termékkutatási és Fertőzésbiológiai Intézet, Hans Knöll Intézet, Jena, Németország
Volker Ast
5 Hálózati modellezés, Leibniz Természetes Termékkutatási és Fertőzésbiológiai Intézet, Hans Knöll Intézet, Jena, Németország
Rainer König
5 Hálózati modellezés, Leibniz Természetes Termékkutatási és Fertőzésbiológiai Intézet, Hans Knöll Intézet, Jena, Németország
Hubert Serve
4 II. Orvostudományi Osztály, Hematológia/Onkológia, Goethe Egyetem, Frankfurt
Florian H. Heidel
2 Innere Medizin II, Hämatologie und Onkologie, Jenai Egyetemi Kórház
3 Leibniz Öregedési Intézet, Fritz-Lipmann-Intézet (FLI), Jena
Frank-D. Böhmer
1 Molekuláris Sejtbiológiai Intézet, Molekuláris Biomedicina Központ (CMB), Jenai Egyetemi Kórház
Jörg P. Müller
1 Molekuláris Sejtbiológiai Intézet, Molekuláris Biomedicina Központ (CMB), Jenai Egyetemi Kórház
Társított adatok
Az akut mieloid leukémia (AML) a hematopoietikus ős- és progenitorsejtek onkogén transzformációja által okozott betegségek heterogén csoportja. Az FLT3 tirozin-kinázt kódoló gén mutációi, amelyek a szekvencia belső tandem duplikációihoz (ITD) vezetnek, a humán AML egyik leggyakoribb genetikai aberrációját jelentik, és szomorú prognózissal járnak. 1 Itt bemutatjuk, hogy a transzmembrán (receptorszerű) protein-tirozin-foszfatáz (RPTP) PTPRJ/DEP-1 genetikai inaktiválása FLT3-ITD bekattanó egerekben (FLT3 ITD/ITD egerek) elősegíti az FLT3-ITD által közvetített rendellenességeket vérképzésben. Az FLT3 ITD/ITD Ptprj -/- egereket fokozott extramedulláris progenitor expanzió jellemezte, amely a legjelentősebb a lépben, megnövekedett kolóniaképző egység-granulocita monocita (CFU-GM) és egy súlyosabb myeloproliferatív neoplazia (MPN).
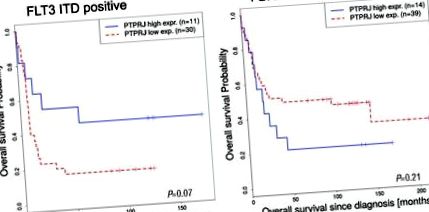
A PTPRJ expresszió fordítottan korrelál az FLT3-ITD pozitív AML betegek túlélésével. (A, B). Alacsony (piros, pontozott) és magas (kék) PTPRJ expressziójú betegek teljes túlélése (Valk-tanulmány, 4, 13 GEO-csatlakozás> GSE1159). Az AML FLT3-ITD pozitív (A: cutoff = 33,3, P = 0,07) és FLT3 WT betegek (B: cutoff = 34,9, P = 0,21) túlélési görbéit mutatjuk be. A betegminták számát (n) feltüntetjük.
A PTPRJ FLT3-ITD által kiváltott betegségben betöltött szerepének közvetlen tanulmányozása érdekében az FLT3 ITD/ITD egereket 6 kereszteztük Ptprj -/- egerekkel. 7 FLT3 ITD/ITD Ptprj -/- egér a betegség korai kezdetét és a túlélés rövidülését mutatta (2A. Ábra). Az FLT3-ITD egerek jelentősen csökkent élettartama tovább lerövidült a Ptprj inaktiválására reagálva. Az FLT3 ITD/ITD egerekben 6 megfigyelt splenomegalia kevésbé hangsúlyosnak tűnt az FLT3 ITD/ITD Ptprj -/- egerekben (2B. Ábra). Míg az FLT3 ITD/ITD egerek májtömege nem volt szignifikánsan megemelkedve a WT egerekhez képest, az FLT3 ITD/ITD Ptprj -/- egerekben szignifikánsan megnőtt (2C. Ábra). A növekedés alatti súlyfejlődés és a felnőtt állatok össztömege nem különbözött az egyes genotípusok között (az adatokat nem közöljük).
A Ptprj inaktiválása fokozott mieloproliferációt eredményez az FLT3 ITD/ITD egerekben. (A) Az FLT3 ITD/ITD Ptprj -/- és az életkornak megfelelő alomtársak Kaplan-Meier túlélési görbéi. A log rank teszt P-értékeit feltüntetjük. 30–35 hetes WT, FLT3 ITD/ITD, Ptprj -/- és FLT3 ITD/ITD Ptprj -/- egerek lép (B) és máj (C) súlya (a teljes testtömegre normalizálva). * P ** P *** P ITD/ITD Ptprj -/- egerek és 30-35 hetes egerek kontrolljai, és csökkent limfocita, valamint megnövekedett neutrophil és monocita populációt jeleznek a Ptprj -/- FLT3 ITD/ITD egerekben az FLT3 ITD/ITD egereknek. (E) H & E hisztopatológia, amely a lép (felső), a máj (középső) és a vese (alsó) architektúrát mutatja 30-35 hetes WT-től, FLT3 ITD/ITD, Ptprj -/- és FLT3 ITD/ITD Ptprj -/- egerek (WP: fehér pulpa; RP: vörös pulpa; GC, nyilakkal ellátott glomeruláris kapszula); a sávok 100 μm-t jelölnek. (F-H) Az FLT3 ITD/ITD Ptprj -/- egerek BM- és lépsejtjeinek immunfenotípusa a granulocita/monocita populáció terjeszkedését és B-sejtek hiányát mutatja. 30-35 hetes egereket elemeztünk. (F) Gating séma a myeloid differenciálatlan B és T sejtek jellemzéséhez (G) A CD11b/Gr-1 expresszió grafikus bemutatása a BM (G) vagy a lépben (H) és a CD19/CD3e expresszió a CD11b -/Gr- 1 - populáció, mint a 106 elemzett sejt összes sejtje. Az értékeket átlag ± SEM formában adjuk meg; * P ** P *** P # P ITD/ITD. n.s: nem szignifikáns; WT: vad típusú.
A korábban jelentett érett myeloid (Gr1 +/CD11b +) sejtek megnövekedett száma a csontvelőben (BM), és különösen az FLT3 lépében. ITD/ITD egerek 6 tovább emelkedtek a lépben és a perifériás vérben a Ptprj hatására inaktiválás (2G, H ábra; Online kiegészítő S1 ábra), amely bizonyítja, hogy a Ptprj hiánya az FLT3-ITD által vezérelt mieloproliferatív fenotípus gyorsulásához vezethet. Az életkorral egyező alomtársak citospinjeinek összehasonlító elemzése megerősítette a monocita populáció kibővülését a BM-ben (Online S3E. Ábra). A lépben a Gr1 + CD11b + mieloid sejtek masszív infiltrációját figyelték meg FLT3 ITD/ITD Ptprj -/- egerekben (2H ábra). A CD19 + sejtek száma drasztikusan csökkent az FLT3 ITD/ITD egerekben. Míg a BM-ben ez a csökkenés független a Ptprj aktivitástól, addig a lépben a Ptprj -/- a CD19 + sejtek további törlését eredményezte (2G, H ábra). A Gr-1-CD11b populáció CD3e + T sejtjeinek mennyisége egyik vizsgált genotípusban sem változott (2G, H ábra). Ezek az adatok azt mutatják, hogy a Ptprj inaktiválása nem mozdította elő a gyulladásos fenotípust az FLT3 ITD/ITD hátterében, és a rendellenességek a megváltozott hematopoiesis miatt.
Az FLT3 pozitív sejtek 8 korábban jelentett hatalmas kiterjedését az FLT3 ITD/ITD egérmodellünk is megerősítette: Lin - c-Kit + FLT3 ITD/ITD egerekből származó progenitorokban az FLT3 pozitív sejtek 5 vagy 40-szeres emelkedése a BM-t vagy a lépet figyelték meg a WT egerekhez képest (3D, E ábra). A Ptprj inaktiválása ennek a sejtpopulációnak a további növekedését eredményezte (3D, E ábra), amely megerősítette a lép extramedulláris hematopoiesisét. Hasonlóképpen, az FLT3-ITD expresszáló LSK sejteket FLT3 ITD/ITD Ptprj -/- egerekben csak a lépben fokozták.
Összességében a Ptprj inaktiválása FLT3 ITD/ITD egerekben a myeloid (Gr-1 + CD11b +) sejtek markánsabb beszivárgását eredményezte a limfociták fokozottabb elnyomásával, ami az FLT3-ITD által vezérelt betegség fokozott agresszivitására utalhat. . Az FLT3 ITD/ITD Ptprj -/- egerek progenitor sejtjeinek terjeszkedése, amely a legjelentősebb a lépben, az extramedulláris hematopoiesis növekedését jelezte. A klonogén vizsgálatok a Lin-lép sejtek fokozott CFU-GM potenciálját mutatták. Sőt, az FLT3 specifikus foszforilációja az FLT3 ITD/ITD Ptprj -/- egerekből származó Lin-BM sejtekben fokozódott. Így adataink a PTPRJ-t az FLT3-ITD által indukált mieloproliferáció szuppresszoraként azonosítják.
- A DEP-1 elvesztése (Ptprj) elősegíti a mieloproliferatív betegséget FLT3-ITD akut mieloid leukémiában
- Az életmódbeli beavatkozás elősegíti a terhességi cukorbetegség utáni fogyást
- Kruzhilina Olga, 1997-ben született - akut limfoblasztos leukémia Boldog Gyermek alapítvány
- A szauna használata edzés után elősegíti a fogyást
- A magnéziumolaj megakadályozza a krónikus betegségeket a geotermikus ásványi anyagok