A diéta, mint az emberi prosztatarák oka
Absztrakt
1 Proliferatív gyulladásos atrófia: elváltozás, amely a hám sérülését a prosztatarákhoz köti
A világ azon régióiban, ahol magas a prosztatarák előfordulása, a prosztata gyulladása lényegében mindenütt jelen van [18]. Jóllehet többnyire tünetmentes, különösen, ha a prosztata perifériás zónáját érinti, ahol rákos megbetegedések fordulnak elő, a prosztatagyulladás régóta ismert, hogy a prosztatarák diagnózisait vezérli, függetlenül a betegség kialakulásának hajlandóságától, mert hajlamos emelni a szérum prosztata-specifikus antigén (PSA) szintjét . A prosztata gyulladásában a prosztata epithelium gátfunkciójának károsodása sztereotip módon a prosztata szekréciójának - ideértve a szekretált fehérjéket, például a PSA - visszafolyását a prosztata parenchymájába és végső soron a véráramba. Mivel a PSA kimutatása a szérumban a prosztata biopszia elsődleges kiváltó okaként szolgál a prosztatarák kimutatásához és diagnosztizálásához, a prosztata gyulladása felelős a több mint 30 millió PSA teszt jelentős részéért, ami több mint egymillió prosztata biopsziához vezet, amely rákot keres, minden évben fellépnek az Egyesült Államokban [36]. Mindazonáltal a szérum PSA emelkedése már 40 éves korban a prosztatarák megnövekedett kockázatával jár együtt az élet későbbi szakaszaiban [23, 24].
A prosztatarák etiológiai tényezői. A prosztata karcinogenezis a prosztata hám károsodását, a regeneratív proliferációt és a krónikus/visszatérő gyulladást követi, amely proliferatív gyulladásos atrófiás elváltozásokhoz vezet. Ezek az elváltozások c-Myc aktivációval, telomer rövidüléssel és epigenetikus gén inaktivációval hajtják ki a sejteket, amelyek prosztata intraepithelialis neoplazia és prosztatarák kialakulását eredményezik, célzott génátalakulásokat, mutációkat és extenzíven korrupt epigéneket
A prosztata károsodása, majd a maladaptív veleszületett immunválasz és a szöveti sérülés válasza lehet az út, amely összeköti a környezeti expozíciókat, beleértve az étrendet is, a prosztatarák kialakulásával. Természetesen mind a populációs vizsgálatok, mind a molekuláris patológiai elemzések során egyértelmű a kapcsolat a prosztata gyulladása, a PIA és a prosztatarák között. Mégsem sikerült teljesen megmagyarázni azokat a mechanizmusokat, amelyek révén az étkezési szokások vagy más expozíció a prosztata károsodásához vezet.
2 Az étrend: A rákkeltő anyagok forrása, amely károsíthatja a prosztata hámot és PIA-t okozhat
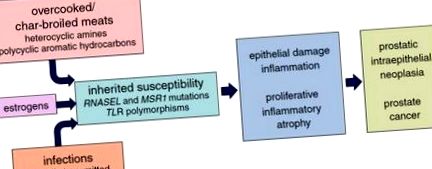
A prosztatarák epidemiológiai tanulmányai erősen érintették az étrendet, mint a prosztatarák kockázatának fő modulátorát. A prosztatarák előfordulása és mortalitása különböző földrajzi régiókban változik, az Egyesült Államokban és Európában magas a prosztatarák kockázata, Ázsiában pedig alacsony a prosztatarák kockázata, ugyanakkor az alacsony kockázatú régiókból a magas kockázatú régiókba bevándorlók általában magasabb prosztatarák kockázatokat vállalnak, különösen a kulturális asszimilációval [27, 73]. Ez valószínűleg az étkezési különbségeket tükrözi: vagy a magas kockázatú régiók étkezési szokásai elősegítik a prosztatarákot, az alacsony kockázatú régiók étkezési szokásai megelőzik a prosztatarákot, vagy mindkettő. Részletesebben megvizsgálva a prosztatarák legkonzisztensebb táplálkozási összefüggése a vörös húsok és/vagy állati zsírok bevitele tűnik [26, 43]. A vörös húsok esetében a magas hőmérsékleten történő főzés vagy az aprósütés heterociklusos aromás aminokat és policiklusos aromás szénhidrogén karcinogéneket hoz létre [39, 44]. Ezek a főzési gyakorlatok a prosztatarák megnövekedett kockázatával is társulnak, és részben magyarázatot adhatnak a prosztatarák kialakulásának nagyobb hajlandóságára az afroamerikai férfiak és az Egyesült Államok kaukázusi férfiak között [37, 82].
3 Nem diétás expozíció, amely prosztata hámkárosodást, prosztata gyulladást és PIA-t okoz
Úgy gondolják, hogy a nemi szteroid hormonok, a fertőzések és az öröklődés befolyásolják a prosztatarák kialakulását. Az androgén hormonokra, például a tesztoszteronra és a dihidrotesztoszteronra, valamint egy működő androgénreceptorra szükség van az összes nemi mirigy normális növekedéséhez és fejlődéséhez, beleértve a prosztatát és a szemhólyagokat is, de kevés az bizonyíték arra, hogy az androgének önmagukban prosztatarákot okoznának. Az androgénszint az élet során folyamatosan csökken a felnőtt férfiaknál, a csúcsot 21 év körül éri el, majd csökken, mivel a prosztatarák kezd kialakulni [66, 68]. Az Egyesült Államokban az afroamerikai férfiak több prosztatarákot szenvednek, mint a kaukázusiak, annak ellenére, hogy hasonló az életkorhoz igazított androgénszint [66]. A felnőtt férfiak prosztatáiban az androgén szignálozásra van szükség az oszlopos szekréciós hámsejt-fenotípus terminális differenciálódásához, elősegítve az olyan gének transzkripcióját és transzlációját, mint a PSA és a TMPRSS2, és elősegítve az ejakulátum szekréciójának kialakulását. Ilyen módon az androgének hajlamosak elnyomni a hámsejtek szaporodását.
Végül a prosztatarák kialakulására adott örökletes hajlam a génekkel magyarázható, amelyek a résztvevőket kódolják, és ösztönzik a veleszületett gyulladásos válaszok aktiválódását és intenzitását. Két ilyen gén, az RNASEL és az MSR1 tűnik felelősnek a prosztatarák egyes családi klasztereiért [11, 90]. Az RNASEL egy ribonukleázt kódol, amely részt vesz egy interferonnal indukálható RNS-pusztító útvonalban, amely vírusfertőzés vagy más sejtkárosító stressz hatására aktiválódik; Az MSR1 egy makrofágmegkötő receptor alegységeit kódolja, amely megköti a bakteriális lipopoliszacharidot és a lipoteichoesavat. Bármelyik fehérje csökkent funkciója egerekben csökkenti a különféle fertőzések teljes tisztításának képességét [80, 96]. A populációs vizsgálatokban meglehetősen következetes összefüggéseket tapasztaltak a prosztatarák és az autópálya-szerű receptorokat (TLR) kódoló gének polimorf variánsai, például a TLR4 és a TLR1-TLR6-TLR10 klaszter között [77, 95]. A TLR-ek a kórokozók és/vagy a sérült sejtkomponensek széles skáláját képesek megkötni, NF-κB jelátvitel útján elősegítve az erőteljes veleszületett immunválaszokat [12].
Annak ellenére, hogy az ösztrogének és a fertőzések úgy tűnik, hogy képesek prosztata hámkárosodást okozni, ami étrendi hatások nélkül PIA-hoz és prosztatarákhoz vezethet, ezeket a folyamatokat mind befolyásolhatják a világ nagy kockázatú prosztatarákos régióiban általános étkezési szokások . Az ösztrogénszint általában magasabb a megnövekedett zsírszövetű férfiaknál. A mikrobiom, a fertőzések vagy a fertőzésekkel szembeni kolonizációs rezisztencia forrása, az étrendi gyakorlattól függően nagyban változik. Az étrend befolyásolhatja az ösztrogének és fertőzések hajlamát a prosztata károsodására, és közvetett módon elősegítheti a prosztatarák elősegítését. Hasonlóképpen, az étrendi heterociklusos amin által közvetített prosztata károsodásának mértéke valószínűleg ugyanazon gazda genetikai tényezőknek lesz kitéve, amelyek szabályozzák a prosztata fertőzésekre adott gazda válaszainak intenzitását. Az RNASEL képes lebontani az emberi RNS-t, valamint a vírusos RNS-t, ami apoptózishoz vezet [89]. Az MSR1 elősegíti a keringő oxidált szérum alacsony teherbírású lipoproteinek tisztítását [41]. A TLR-eket a sérült emberi sejtkomponensek aktiválják [12]. Így az étrend valószínűleg közvetlen és közvetett hatást gyakorol az emberi prosztatarák kialakulására.
4 Gyulladás, PIA és a prosztatarák molekuláris patogenezise
Az életveszélyes humán prosztatarák sejtek 3866 mutációt (20 nem csendes kódoló mutációt), 108 átrendeződést, 5408 DNS hipermetilezéssel rendelkező régiót, rövidített telomer szekvenciákat és aktivált c-Myc fehérjét tartalmaznak [7, 58, 92]. Nevezetesen, úgy tűnik, hogy a szomatikus mutációk nem emeltek ki a prosztata karcinogenezisének egyik gyakori „mozgatórugóját”, és nem utaltak semmiféle bázisváltozási aláírásra, amely jobban megfelelne az egyik típusú karcinogénnek a másikkal szemben. Ehelyett úgy tűnik, hogy a mutációk idővel felhalmozódnak az egyes rákos megbetegedésekben, befolyásolva, hogy megjelentek-e szerzett eltérés-helyrehozó gén-rendellenességek és/vagy használtak-e pro-mutagén kezeléseket. A következetesebb szomatikus genetikai hiba a fent leírt transzlokációk, különösen azok, amelyek rákgénekhez, például TMPRSS2-ERG-hez fuzionált androgén jelátvitel géncéljait tartalmazzák, amelyek a TOP2B- kapcsolódó DNS kettős szálú törések [28]. Úgy tűnik, hogy ez a szomatikus genomhiba PIN elváltozásokban jelentkezik, és valószínűleg a karcinómára jellemző invazivitás alapja. A prosztatarák sejtjeinek összes szomatikus változása közül a legkövetkezetesebbnek és a legkorábbinak tűnik az epigenetikus géncsendesítés, a telomer rövidülés és a c-Myc indukció [58].
A DNS-metiláció mellett a c-Myc fehérje telomer rövidülése és túlzott expressziója következetesen kíséri az emberi prosztata karcinogenezist [33, 49]. A kromoszómák telomerjei, speciális struktúrák, amelyek tartalmazzák
A PIA elváltozások, amelyek a sejtek és szövetek károsodásának hatására keletkeznek, kiváltott gyulladásos válasz kíséretében, a prosztatarákhoz kapcsolódó expozíciók, például étrendi rákkeltők és ösztrogének. A legkorábbi sztereotip molekuláris események, az epigenetikus géncsendesítés, a telomer rövidülés és a c-Myc aktiváció a PIA elváltozásokban jelentkeznek. A molekuláris balesetek pontos mechanizmusait azonban még nem dolgozták ki. Mindegyiknek eredete lehet, vagy legalábbis befolyásolhatja a káros expozíció, például étrendi karcinogén, vagy a gyulladásos válasz. Ily módon a prosztata karcinogenezis számos szervhelyen hasonlíthat az expozíció által vezérelt rák kialakulásához.
5 Racionális beavatkozások a prosztatarák megelőzésére
Ha a prosztatarák járványa a fejlett világban az étrendi karcinogének és/vagy ösztrogének kitettségével magyarázható, amelyek krónikus prosztata gyulladáshoz vezetnek, a racionális prosztatarák megelőzési megközelítéseknek tartalmazniuk kell: (1) az expozíció elkerülését, (2) csillapítást a rákkeltő anyagok által okozott prosztata sejtek és szövetek károsodása, és/vagy (3) a prosztata gyulladásának intenzitásának vagy időtartamának csökkenése. Nem meglepő, hogy minden megközelítés alátámasztására epidemiológiai és klinikai vizsgálati bizonyítékok jelentek meg.
6 Összegzés és következtetések
- Mit kell enni az egészséges prosztatarákos étrendért A mindennapi egészség
- Az étrend és a testmozgás hatása a prosztatarákra Seattle Cancer Care Alliance
- A szőlő diéta rák kúra
- A Grinch, a WHO, a vörös hús és a rák ünnepi vers - diagnosztikai étrend
- Az 5 2 diéta segít legyőzni a rákot és az Alzheimer-kórt