Fucoxanthin: ígéretes gyógy- és táplálék-összetevő
Hui Zhang
1 Gyógyszerészeti Iskola, Shandong Hagyományos Kínai Orvostudományi Egyetem, Jinan 250355, Kína
Yibo Tang
2 Általános Orvostudományi Iskola, Pekingi Kínai Orvostudományi Egyetem, Peking 100029, Kína
Ying Zhang
3 Bőrgyógyászati Osztály, A Kínai Népi Felszabadító Hadsereg Első Kórháza, Gansu 730030, Kína
Shuofeng Zhang
4 Kínai Materia Medica Iskola, Pekingi Kínai Orvostudományi Egyetem, Peking 100029, Kína
Jing Qu
2 Általános Orvostudományi Iskola, Pekingi Kínai Orvostudományi Egyetem, Peking 100029, Kína
Xu Wang
2 Általános Orvostudományi Iskola, Pekingi Kínai Orvostudományi Egyetem, Peking 100029, Kína
Ran Kong
4 Kínai Materia Medica Iskola, Pekingi Kínai Orvostudományi Egyetem, Peking 100029, Kína
Chunchao Han
1 Gyógyszerészeti Iskola, Shandong Hagyományos Kínai Orvostudományi Egyetem, Jinan 250355, Kína
Zhenquan Liu
2 Általános Orvostudományi Iskola, Pekingi Kínai Orvostudományi Egyetem, Peking 100029, Kína
Absztrakt
Az ehető barna hínárokból a fukoxantin, egy allén karotinoid izolálható. A legújabb tanulmányok szerint a fukoxantinnak számos fiziológiai funkciója és biológiai tulajdonsága van, mint például az elhízás, a daganatellenes, az antidiabetes, az antioxidáns, a gyulladáscsökkentő és a hepatoprotektív tevékenység, valamint a szív- és érrendszeri és az agyi érrendszeri védőhatások. Ezért a fukoxantin gyógyszerként és táplálékként egyaránt felhasználható a krónikus betegségek megelőzésére és kezelésére. Bár a fukoxantin számos gyógyászati összetevővel és táplálkozási tulajdonsággal rendelkezik, a vizsgálatok azt mutatták, hogy szerkezete instabil. Ebben a cikkben áttekintettük a jelenlegi dokumentumokat, és áttekintettük a fukoxantin stabilitását befolyásoló szerkezeti tulajdonságokat és tényezőket. Beszámoltunk a fukoxantin anyagcseréjéről, biztonságosságáról, farmakológiai tevékenységeiről és a biohasznosulás javításának módszereiről is. Ezen alapvető háttérismereteket nyújtó tanulmányok alapján a fukoxantin tengeri drogokká és táplálkozási termékekké fejleszthető.
1. Bemutatkozás
A közelmúltban növekszik a zsírok, cukrok és kalóriák bevitele, míg a testmozgás és a fizikai aktivitás csökken. Ez az életmód hozzájárul a kapcsolódó betegségekhez, például az elhízáshoz, a cukorbetegséghez, a rákhoz és más krónikus betegségekhez. Az életmóddal összefüggő betegségek megelőzésére és kezelésére nem elegendő kizárólag farmakológiai kezelést alkalmazni. A táplálkozás szintén kritikus szerepet játszik [1]. Ezért a kutatók biztonságos és hatékony funkcionális összetevőket találnak az ételekben az életmóddal összefüggő betegségek megelőzésére és kezelésére [2]. Ezen funkcionális összetevők egyike a fukoxantin.
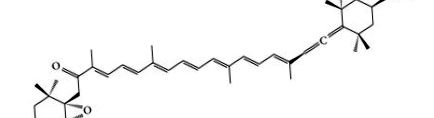
A fucoxanthin tengeri karotinoid, és jelen van a makroalgákban és a mikroalgákban, mint például az Undaria pinnatifida (Wakame), a Laminaria japonica (Ma-Kombu), a Phaeodactylum tricornutum és a Cylindrotheca closterium [3]. A fucoxanthin szerkezetét Englert et al. [4]. A fukoxantin egyedülálló molekulaszerkezettel rendelkezik (1. ábra), amely szokatlan allénkötést, 5,6-monoepoxidot és 9 konjugált kettős kötést tartalmaz [5, 6]. Az allénkötés főleg a fukoxantinban volt, amely a barna moszatokban más karotinoidokban nem volt megtalálható [7]. A fukoxantin egyedi szerkezete és kiralitása azonban instabil. A fűtés, a légi expozíció és a megvilágítás könnyen befolyásolja [8, 9]. Bár a fukoxantin instabil, az instabilitását elősegítő tényezőket alaposan tanulmányozták. Stabil szerkezete és allénkötése miatt a fukoxantin magas antioxidáns aktivitást mutatott [10]. Ezenkívül a fucoxanthin elhízásgátló, antidiabetes, gyulladáscsökkentő, rákellenes és hepatoprotektív aktivitást, valamint kardiovaszkuláris és cerebrovaszkuláris védőhatásokat is mutatott [11–54]. Ebben a cikkben áttekintettük a fukoxantin stabilitását, a fukoxantin metabolizmusát és biztonságosságát, a farmakológiai aktivitásokat és a fukoxantin farmakológiai mechanizmusát befolyásoló tényezőket.
A fukoxantin kémiai szerkezete.
2. A fucoxanthin szerkezete
A fukoxantin szerkezete szorosan összefügg a fukoxantin farmakológiai aktivitásával. Ezért felépítésének tulajdonságai szükségesek a jól ismert ismeretekhez. A fucoxanthin egy jellegzetes karotinoid, amelyet a barna algákban találtak. A fukoxantin szerkezete (1. ábra) hasonló a neoxantinhoz, a dinoxantinhoz és a peridininhez. A többi karotinoiddal ellentétben a fukoxantin egyedülálló szerkezettel rendelkezik, amelyben szokatlan allénkötés, 9 konjugált kettős kötés, 5,6-monoepoxid és néhány oxigén funkciós csoport van jelen, beleértve a hidroxil-, epoxi-, karbonil- és karboxilcsoportokat [55, 56 ].
3. A fukoxantin metabolizmusa és biohasznosulása
A fukoxantin felszívódása és metabolizmusa szorosan összefügg biológiai hozzáférhetőségével. Alapvető ismerete az anyagcsere folyamatának és a fukoxantin biohasznosulásának javítására szolgáló módszerről (2. ábra).
A fukoxantin, a fukoxanthinol és az amarouciaxanthin A kémiai szerkezete.
A fucoxanthinol és az amarouciaxanthin A a fukoxanthin fő metabolitjai. Úgy tűnt, hogy a fukoxantin a beadás után 2 órán belül gyorsan hidrolizálódik a gasztrointesztinális traktusban fukoxanthinollá, és egerekben nem mutattak változatlan fukoxantint a plazmában vagy a májban [59]. A fukoxanthinolt amarouciaxanthin A-vá alakították át, amelyet főleg egerek májmikroszómáiban és HepG2 sejtekben mutattak ki [59]. Hashimoto és mtsai in vitro vizsgálata. [60] kimutatta, hogy az étrendi fucoxanthin a szívben és a májban fukoxanthinolként, a zsírszövetben pedig amarouciaxanthin A-ként felhalmozódott.
Yonekura és mtsai. [61] a fukoxantin metabolizmusát, szöveti eloszlását és kimerülését vizsgálták ICR egerekben. Megállapították, hogy a fukoxanthinol és az amarouciaxanthin A egerek inkább a zsírszövetekben, mint a plazmában, a májban és a vesében oszlanak meg. A fukoxantin metabolitok felezési ideje (t 1/2) a zsírszövetekben (> 41 d) hosszabb volt, mint a plazmában (1,16 d), a májban (2,63 d) és a vesében (4,44 d) [61] . Ezenkívül arra a következtetésre jutottak, hogy a fucoxanthin metabolitok szöveti eloszlása nem volt összefüggésben lipofilitásukkal, de a kimerülés lassabbnak tűnt magasabb lipofilitásuk miatt.
A gyógyszerek farmakokinetikája fajtól függ. Mordenti [62] arról számolt be, hogy az összehasonlított fajok közül a gyógyszerek eliminációja egerekben volt a leggyorsabb, az embereknél pedig a leglassabb. Hashimoto és munkatársai tanulmánya. [63] kimutatta, hogy a fukoxanthinol biohasznosulása magasabb volt humán alanyokban, mint egerekben. Azt is megállapították, hogy a fukoxantin anyagcseréje különbözött az ember és az egér között. A fucoxanthinolt tekintik az ember elsődleges aktív metabolitjának. Amarouciaxantin A-t nem mutattak ki az önkéntes plazmájában.
A fukoxantin, mint fontos tényező oldhatóságát figyelembe kell venni orális alkalmazás esetén. Maeda és mtsai. [64, 65] megállapította, hogy a fukoxantint nehéz feloldani szójaolajban és növényi olajokban, míg halolajban és közepes láncú triacil-glicerinben (MCT) könnyen oldódik. A fehér zsírszövet (WAT) súlygyarapodása kisebb volt a fukoxantinnal és halolajjal táplált KK-A y egereknél, mint a kizárólag fukoxantinnal táplált egereknél [64]. A szétkapcsolódó protein 1 (UCP1) kifejeződése egyértelműbb volt a fukoxantinnal és MCT-vel táplált egerekben, mint a tisztított fukoxantinnal vagy csak MCT-vel táplált egerekben [65]. Ezek az adatok azt jelezték, hogy a fukoxantin felszívódási sebességét halolaj és MCT növelheti. Suga, Sugawara et al. [66] kimutatta, hogy a lizofoszfatidilkolin (lysoPC) és a foszfolipáz A2 (PLA2) fontos szerepet játszanak a karotinoidok felszívódásának fokozásában az emésztőrendszerben és a karotinoidok bélhám általi asszimilációjának egyszerű diffúziós mechanizmusának támogatásában. Így egyes komponensek, különösen a lipidek, jelentősen befolyásolhatják a fukoxantin felszívódási sebességét.
4. A Fucoxanthin biztonságossága
A fucoxanthin biztonságos gyógyszerészeti összetevő. Klinikai kutatások kimutatták, hogy a fukoxantin szedése felgyorsította az anyagcserét, de a metabolikus fellendülés nem stimulálta a központi idegrendszert [67]. Kadekaru és munkatársai 4 hetes toxicitási vizsgálatot végeztek a fukoxantin (95% -os tisztaságú) patkányokon történő ismételt orális adagolásával. [68]. Az eredmények azt mutatták, hogy a fukoxantin nem mutatott nyilvánvaló toxicitást patkányokban [68]. A 0,0012% fukoxantint tartalmazó kivonatok toxicitását egerekben Zaragozá et al. [69]. A kivonatok nem mutattak releváns toxicitási hatást egy akut toxicitási tesztben egy 4 hetes napi kezelés után. Ezenkívül a fukoxanthinol, a fucoxanthin metabolitja nem mutatott szignifikáns káros hatást in vivo [70].
5. A fukoxantin farmakológiai tevékenységei
5.1. Elhízásgátló hatás
A magas zsírtartalmú étrend hosszú távú fogyasztása megváltoztathatja a lipid anyagcserét, amely a zsigeri zsír felhalmozódásához vezet, és elhízást és ehhez kapcsolódó rendellenességeket eredményezhet, mint például cukorbetegség, magas vérnyomás, diszlipidémia és szív- és érrendszeri betegségek rendellenességei [71, 72]. Következésképpen létfontosságú az elhízás megelőzésére szolgáló hatékony stratégiák megtalálása. A kutatók azt találták, hogy a fucoxanthin-kiegészítés különböző utakon keresztül előnyös szerepet játszhat az antihízásban (3. ábra).
A fukoxantin túlsúlyossága. ↑ szabályozás; ↓ leszabályozás.
A fucoxanthin jelentősen csökkentette a plazma és a máj triglicerid koncentrációját, a széklet trigliceridet, a koleszterint és a koleszterint szabályozó enzimaktivitásokat, mint például a 3-hidroxi-3-metil-glutaril-koenzim A-reduktáz és az acil-koenzim A [11–15].
Számos tanulmány azt sugallta, hogy a fukoxantin elhízásellenes hatást fejtett ki a fehér zsírszövetben (WAT) leválasztó protein 1 (UCP1) expressziójának serkentésével. Az UCP1 általában a barna zsírszövetben (BAT) található, amely stimuláció nélkül nem expresszálódik WAT-ban. Maeda és mtsai. [22] az UCP1 fehérje és az mRNS egyértelmű jeleit észlelte a WAT-ban, amikor az egereket fukoxantint tartalmazó Undaria pinnatifida lipidekkel etették. Továbbá azt is felfedezték [64], hogy az étrendben lévő 0,2% fukoxantin szignifikánsan gyengítette a WAT súlygyarapodást KK-A y egerekben az UCP-1 expresszió növekedésével.
A fucoxanthin stimulálhatja a β-oxidációs aktivitást és gátolhatja a foszfatidát-foszfohidroláz aktivitást, ami a máj lipidcseppek felhalmozódásának csökkenését eredményezheti [12]. A magas zsírtartalmú étrend az AMP-aktivált protein-kináz (AMPK) és az acetil-CoA karboxiláz (ACC) foszforilációjának csökkenését idézte elő. A csökkenést a fukoxantin helyreállíthatja az érett 3T3-L1 adipociták fokozott LKB1 foszforilációjával [23].
A fucoxanthin megváltoztathatja a plazma leptin szintjét. A leptin szekréciót fokozza a zsír felhalmozódása az adipocitákban. A leptin az energiafelhasználás szabályozásával szabályozhatja a testtömeget és a zsírzsírpárnát [24]. Park és mtsai. [12] értékelte az Undaria pinnatifida etanol kivonat (UEFx) jótékony hatását C57BL/6J egerekben. Megállapították, hogy a fucoxanthin jelentősen csökkentheti a plazma leptinszintjét, ami az epididymális zsírszövet súlyának jelentős csökkenésével jár.
Egy emberen végzett tanulmány a fucoxanthin súlycsökkenésre gyakorolt hatását javasolta. A 300 mg gránátalma magolaj és a 2,4 mg fukoxantint tartalmazó 300 mg barna alga kivonat kombinációja jelentősen csökkentette a testtömeg és a máj zsírtartalmát az elhízott nőknél, akiket 16 napig kezeltek [25].
5.2. Daganatellenes aktivitás
A kemoterápia egy hagyományos módszer a rákos halálozás arányának csökkentésére. A rák megismétlődése és morbiditása azonban kemoterápiával nem csökkenthető. Ezért elengedhetetlen találni egy ígéretes megközelítést a rák kialakulásának ellenőrzésére. A fucoxanthin hatékony módszer lehet a rosszindulatú daganatok kezelésére a sejtciklus leállításának és az apoptózis kiváltásával.
5.2.1. Sejtciklus letartóztatása
A GADD45 részt vesz a növekedés elnyomásában. A PCNA a ciklin-függő kináz (Cdk) komplexek normális alkotóeleme, valamint egy fehérje, amely részt vesz a DNS replikációjában és helyreállításában. Smith és mtsai. [26] korábban azt találta, hogy amikor a GADD45 a PCNA-hoz kötődik, az in vitro stimulálja a DNS-kivágás helyreállítását és gátolja a sejtek S-fázisba való bejutását. Ezenkívül a GADD45A fokozta a β-catenin és a Caveolin-1 közötti kölcsönhatást, amely a β-catenin transzlokációt indukálta a sejtmembránhoz, ami sejt-sejt adhéziót/kontakt gátlást eredményezett [27]. Yoshiko és Hoyoko [28] megállapította, hogy a fukoxantin a G1 letartóztatásakor jelentősen indukálta a GADD45A-t a HepG2 és DU145 sejtekben. A fucoxantin által indukált GADD45A expressziót és G1 leállást pozitívan szabályozták a p38 MAPK útjának gátlásával a HepG2 sejtekben, és negatívan szabályozták az SAPK/JNK útvonal gátlásával a DU145 sejtekben [29]. Ezenkívül az ERK fukoxantin általi gátlása csak fokozta a GADD45A expressziót, és nem befolyásolta a H1 HepG2 sejtek G1 leállítását. Ezek az eredmények arra utaltak, hogy a MAPK fukoxantin általi GADD45A és G1 leállításában való részvételének különböző mintái összefüggtek a sejttípussal.
Kim és mtsai tanulmánya. [30] kimutatta, hogy a fukoxantin csökkentette a B16F10 sejtek szaporodását, a sejtciklus leállításának indukciója kísérte a G (0)/G (1) fázis alatt. A fukoxantin által kiváltott G (0)/G (1) fázis alatt a sejtciklus leállása a foszforilezett-Rb (retinoblasztóma fehérje), a ciklin D (1 és 2) és a ciklinfüggő fehérje expressziójának jelentős csökkenésével volt összefüggésben. kináz (CDK4) és a p15 INK4B és a p27 Kip1 fehérjeszintjeinek szignifikáns felülszabályozása [30]. Yu és mtsai. [31] beszámolt arról, hogy a fukoxantin apoptózist indukált az emberi gyomor adenokarcinóma MGC-803 sejtjeiben és a sejtciklus leállását G2/M fázisban. A fucoxanthin dózisfüggő módon jelentősen csökkentette a CyclinB1, a túlélő és a STAT3 expresszióját az MGC-803 sejtekben [31]. Megállapították azt is, hogy a fukoxantin elnyomhatja a CyclinB1 expresszióját a JAK/STAT szignálpályán keresztül [31]. A fukoxantin által kiváltott sejtciklus leállításának mechanizmusát egy képen írtuk le (4. ábra).
- EnerGaia - Mi a Spirulina, táplálkozási előnyei és egyéb kérdések
- Lenmag tea - táplálkozási minták
- Lehet, hogy a békalencse egy új, az Ön számára jobb összetevőnek számító Food Dive
- A zöld paradicsom táplálkozási tényei, a zöld paradicsom táplálkozási információi
- Cornus Herb (Dogwood) egészségügyi előnyei, tényei, a Dogwood kéreg és tea gyógyászati felhasználása