Nem alkoholos zsírmájbetegség kezelése teljes alkaloidokkal Rubus aleaefolius Poir a zsíranyagcsere szabályozásán keresztül
1 Hagyományos kínai orvoslás Hsziamen Kórháza, Hsziamen, Fujian 361009, Kína
2 Jinshan utcai közösségi egészségügyi szolgálat, Hsziamen, Fujian 361000, Kína
3 Integratív Orvostudományi Akadémia, Fujian Tradicionális Kínai Orvostudományi Egyetem, Fuzhou, Fujian 350122, Kína
4 Fujian Integrált Orvosi Geriátriai Laboratórium, Fujian Tradicionális Kínai Orvostudományi Egyetem, Fuzhou, Fujian 350122, Kína
5 Integratív Orvostudományi Intézet, Fuzhou, Fujian 350122, Kína
Absztrakt
Összes alkaloid in Rubus aleaefolius Poir (TARAP) egy népi gyógynövény, amelyet Kínában évek óta klinikailag használnak az alkoholmentes zsírmájbetegségek (NAFLD) kezelésére. NAFLD-ellenes hatásának mechanizmusa azonban jórészt ismeretlen. Ebben a tanulmányban egy NAFLD patkánymodellt dolgoztunk ki egy módosított magas zsírtartalmú étrend (mHFD) ellátásával. ad libitum 8 héten keresztül, és értékelte a TARAP terápiás hatását NAFLD patkányokban, valamint az alapjául szolgáló molekuláris mechanizmust. Megállapítottuk, hogy a TARAP csökkentheti a szérum trigliceridek (TG), az összkoleszterin (TC) és az alacsony sűrűségű lipoprotein (LDL-C) szintjét, és növelheti a szérum nagy sűrűségű lipoprotein (HDL-C) szintjét a NAFLD patkányokban. Ezenkívül a TARAP-kezelés csökkentette a zsírsav-szintetáz (FAS) és az acetil-CoA karboxiláz (ACC) expresszióját, és szabályozta a karnitin-palmitoil-transzferáz (CPT) expresszióját. Eredményeink azt sugallják, hogy a lipid anyagcsere szabályozása lehet egy olyan mechanizmus, amellyel a TARAP kezeli a NAFLD-t.
1. Bemutatkozás
A nem alkoholos zsírmájbetegség (NAFLD) világszerte növekszik, és jelenleg a nyugati országokban a leggyakrabban diagnosztizált májbetegség [1–4]. Becslések szerint a NAFLD a népesség 10–24% -ában fordul elő [5–7]. A megnövekedett prevalencia ellenére a NAFLD patogenezise még mindig kevéssé ismert. A kóros lipid metabolizmus és a túlzott lipid felhalmozódás kritikus fontosságú a NAFLD patogenezisében [8]. Az inzulinrezisztencia, az oxidatív stressz és a lokális mikrocirkulációs diszfunkció szintén hozzájárulhatnak a NAFLD kialakulásához [9]. Korábbi tanulmányok kimutatták, hogy az acetil-CoA karboxilázt (ACC), a zsírsav szintetázt (FAS) és a karnitin-palmitoil-transzferázt (CPT) kódoló gének expressziója jelentősen megváltozott a NAFLD-ben [10], tovább kapcsolva a NAFLD előfordulását a máj lipid rendellenességeivel anyagcsere.
A lipidfelhalmozódásnak a NAFLD progressziójában betöltött kulcsszerepe miatt a lipidfelhalmozódás gátlása az anti-NAFLD gyógyszerfejlesztés fókuszpontja. Különböző anti-NAFLD szerek vannak jelenleg preklinikai fejlődésben, némelyiket jelenleg klinikai vizsgálatokban alkalmazzák. Sajnos ezen szerek széles körű alkalmazása kedvezőtlen eredményeket hoz; következésképpen nagyon kívánatosak a leghatékonyabb, minimális mellékhatásokkal járó szerek.
A természetes termékek, köztük a hagyományos kínai orvoslás (TCM), viszonylag kevés mellékhatást mutatnak, és évezredek óta klinikai alkalmazásban állnak, így az ilyen terápiák fontos alternatív gyógymódok a különféle betegségek ellen [11]. Bár a hatásmechanizmus ismeretlen, a gyógynövényes gyógyszerek, például a galagonya, Radix bupleuri, és a szárított mandarinhéjat [12] régóta használják a NAFLD sikeres kezelésére.
Rubus (Rubus L.), amely a Rosaceae családba tartozik, a világon széles körben elterjedt gyógynövény. Rubus aleaefolius Poir (R. aleaefolius) az egyik Rubus hőtisztításra, vérzés megállítására, a vérkeringés elősegítésére és a vérpangás eltávolítására használt fajok. Különböző típusú hepatitis kezelésére használták a kínai Fujian tartomány Anxi megyében, és jelentős terápiás hatást mutatott a NAFLD-re. Korábbi vizsgálataink szén-tetraklorid által kiváltott akut májkárosodási modellben patkányokon azt mutatták, hogy az összes alkaloid az Rubus aleaefolius Poir (TARAP) enyhítette a zsír degenerációt, ami arra utal, hogy a TARAP hatékony terápia lehet a NAFLD számára [13]; ennek ellenére NAFLD-ellenes tevékenységének mechanizmusa még mindig ismeretlen. Annak érdekében, hogy jobban megértsük a TARAP anti-NAFLD hatásait, kifejlesztettünk egy patkány NAFLD modellt, és kiértékeltük a TARAP terápia hatását a lipid metabolizmushoz kapcsolódó gének expressziójára.
2. Anyagok és módszerek
2.1. Összes alkaloid előállítása Rubus aleaefolius Poir (TARAP)
A TARAP-ot a korábban leírtak szerint készítettük [14]. Röviden, a gyökere R. alceifolius Poir a Fujian tartományi Anxitól gyűjtöttük össze, és az alkaloidokat a következő eljárással extraháltuk. 1 g gyógynövényport 50 ml kloroform: metanol: ammónia oldattal (15: 4: 3) extrahálunk 2 órán át jégfürdőn, majd 30 percig ultrahanggal kezeljük és szűrjük. A leszűrt oldatot összegyűjtjük és szárítjuk. A kapott maradékot 2 ml 2% -os kénsavoldatban oldjuk és szűrjük. A szűrőpapírt és a maradékot 2 ml 2% -os kénsavoldattal és pufferoldattal (pH 3,6) mostuk. Ezután puffert adtunk 50 ml végtérfogathoz, és az oldatot későbbi felhasználásra mentettük. A teljes alkaloidtartalom mérésére savfesték-kolorimetriát használtunk. A teljes alkaloid hozam 0,81 mg alkaloid volt a kezdeti gyógynövénypor grammjára számítva.
2.2. Reagensek
A polién-foszfatidilkolint (PP) a Sanofi-Aventis Ukrajna Korlátolt Felelősségű Társaságtól vásároltuk. A Trizol készletet, az M-MLV első szálú cDNS szintézis készletet és a Taq DNS polimerázt a Life Technologies-től (Carlsbad, CA, USA) szereztük be; A SuperScript II reverz transzkriptázt a Promega-tól (Madison, WI, USA) szereztük be; A Biowest Agarose gélt Spanyolországból vásárolták. A trigliceridek (TG), az összes koleszterin (TC), a nagy sűrűségű lipoprotein (HDL-C) és az alacsony sűrűségű lipoprotein (LDL-C) aktivitásának mérésére szolgáló készleteket a Jiancheng Biotechnológiai Intézetből (Nanjing, Kína) szereztük be. Minden más vegyi anyagot, hacsak másként nem jelezzük, a Sigma-Aldrich Chemicals-tól (St. Louis, MO, USA) szereztük be.
2.3. A NAFLD állatmodell fejlesztése
Hím 8 hetes Sprage-Dawley (SD) patkányok (Slike Co. Ltd, Shanghai, Kína), súlya 180
200 g-ot ketrecenként ötöt egy környezettel szabályozott helyiségben, amelynek hőmérséklete kb
° C, relatív páratartalom 40–60%, a levegő szellőztetése 12–18-szor/h, és 12:12 órás mesterséges fény/sötét ciklus 150–300 lux. A patkányokat táplálékkal és vízzel látták el ad libitum. Minden állatkísérletet a Fujian Tradicionális Kínai Orvostudományi Intézet állatetikai bizottsága hagyott jóvá (Fuzhou, Kína). A kísérleti eljárások összhangban voltak a Fujian Tradicionális Kínai Orvostudományi Egyetem (Fuzhou, Kína) állatkísérletekkel kapcsolatos irányelveivel.
2.4. Szövettani vizsgálat
Kis májszövetdarabokat gyűjtöttünk minden patkány azonos helyzetéből, és 10% -os formalinnal rögzítettük 24 órán át. A mintákat paraffinba ágyazottuk, majd 4-5 mm-es szakaszokat készítettünk. A metszeteket ezt követően hematoxilinnal és eozinnal (H&E) festettük. A szövettani kiértékelést két alkalommal végezte el egy patológus, aki nem volt tisztában a kezelésekkel. Félkvantitatív pontozási rendszert alkalmaztunk a máj steatosisának és a gyulladásos sejtekbe való beszivárgás súlyosságának értékelésére 10 mikroszkopikus mezőben, az előzőekben leírtak szerint [15]. Röviden, a következő kritériumokat alkalmazták a máj steatosisának pontozásához: 0 fokozat (-), nincs zsír; 1. fokozatú (+) zsíros hepatociták, amelyek a máj parenchyma 33% -át foglalják el; 2. fokozatú (++) zsíros májsejtek, amelyek a máj parenchyma 33–66% -át foglalják el; és 3. fokozatú (+++) zsíros hepatociták, amelyek a máj parenchymájának> 66% -át foglalják el.
2.5. Biokémiai vizsgálatok
A vértartalmú csöveket szobahőmérsékleten 2 órán át állni hagytuk. A szérumokat 3000 x g-vel 20 percig 4 ° C-on végzett centrifugálással nyertük, és -20 ° C-on tároltuk. A szérumok TG-, TC-, HDL-C- és LDL-C-szintjét a készletek szerint mértük a gyártó utasításai szerint.
2.6. RNS extrakció és RT-PCR elemzés
A teljes RNS-t friss májszövetből izoláltuk Trizol reagens alkalmazásával. Oligo (dT) alapú RNS (1 μg) a gyártó utasításainak megfelelően reverz átírással SuperScript II reverz transzkriptázzal írták le. A kapott cDNS-t használtuk a PCR-hez. GAPDH-t használtunk belső kontrollként. A FAS, ACC, CPT és GAPDH gének amplifikálásához használt primerek a következők voltak: FAS F: 5′-CCT TAG TAC TGC GTG GTC GTA T-3 ′, R3: 5′-CAG AGG GTG CTT GTT AGA AAG AT -3 '(301 BP); ACC F: 5′-TGA GGA GGA CCG CAT TTA TC-3 ′, R: 5′-GAA GCT TCC TTC GTG ACC AG-3 ′ (565 bp); CPT F: 5′-TAT GTG AGG ATG CTG CTT CC-3 ′, R: 5′-CTC GGA GAG CTA AGC TTG TC-3 ′ (629 bp); GAPDH F: 5′-AGA TCC ACA ACG GAT-3 ′, R: 5′-TCC CTC AAG ATT GTC AGC AA-3 ′ (308 bp). Az egyes gének amplifikációját hőciklerrel (GE9600, USA) hajtottuk végre, a következő ciklusparaméterek alkalmazásával: denaturálás, 95 ° C 5 percig, 30 ciklus 95 ° C 30 másodpercig, és izzítási hőmérséklet 30 s és 72 ° C-on 1 percig, majd 10 percig tartó végső meghosszabbítással 72 ° C-on. Az egyes csoportokból véletlenszerűen kiválasztott 6–8 mintára meghatároztuk a génexpressziót, és mindegyik mintát háromszor replikáltuk. A PCR termékeket elektroforézissel elválasztottuk 1,5% agaróz gélen. A DNS-sávokat géldokumentációs rendszerrel (BioRad, Model Gel Doc 2000, USA) vizsgáltuk.
2.7. Immunhisztokémiai vizsgálat
Minden patkány májszövetéből 0,5 cm × 0,5 cm × 0,1 cm szövettömböt gyűjtöttünk. A szövetblokkot foszfátpufferoldattal (PBS) öblítettük, 10% formaldehiddel rögzítettük 12–24 órán át, majd paraffinba ágyazottuk, archiváltuk, majd metszettük. A paraffin metszeteket használtuk FAS, ACC és CPT immunhisztokémiai festéshez. Az elsődleges antitestek poliklonális nyúl anti-patkány FAS, ACC és CPT voltak (mindez 1: 200 hígításban, Santa Cruz Biotechnology). PBS-t használtunk az elsődleges antitest negatív kontrollként történő helyettesítésére. PBS-sel végzett mosás után a tárgylemezeket biotinilezett szekunder antitesttel inkubáltuk, majd konjugált torma-peroxidázzal (HRP) jelölt streptavidinnel (Dako) inkubáltuk, majd PBS-sel mostuk. A színt DAB kromogén felhasználásával fejlesztették ki a gyártó utasításai szerint. Festés után öt nagy teljesítményű mezőt (400x) választottak ki véletlenszerűen minden egyes dián, és az egyes mezőkben a pozitív sejtek átlagos arányát megszámolták a valódi színes multifunkcionális sejtképelemző kezelő rendszerrel (Image-Pro Plus, Media Cybernetics, USA ).
2.8. Statisztikai elemzések
Minden adat három mérés átlagát jelenti, és az adatokat az SPSS for Windows (11.5 verzió, USA) segítségével elemeztük. Az adatok statisztikai elemzését Student's-szal végeztük
-tesztet és ANOVA-t post-hoc elemzéssel meghatároztuk. Különbségek a
statisztikailag szignifikánsnak tekintették.
3. Eredmények
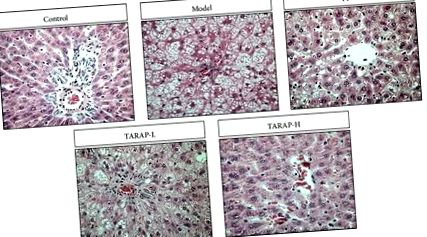
3.1. A TARAP javította a máj steatosisát a NAFLD patkányokban
A szövettani vizsgálatot az „aranystandardnak” tekintik a NAFLD jelenlétének és súlyosságának meghatározásában [16]. Ezért megvizsgáltuk a TARAP terápiás hatékonyságát, megvizsgálva annak hatását a NAFLD patkányok májszöveteinek szövettani változásaira. A normál májszövettanú kontroll patkányokkal összehasonlítva a modellcsoport patkányaiban máj steatohepatitis alakult ki, amelynek jellemzője a zsír felhalmozódása, a hepatocita ballonosodása, a szórt lobuláris gyulladásos sejtek beszivárgása és a gyulladásos gócok (1. ábra). A TARAP kezelés dózisfüggő módon jelentősen enyhítette a máj steatosisát és gyulladását.
3.2. A TARAP megváltoztatta a TG, TC, HDL-C és LDL-C szérumok szintjét a NAFLD patkányokban
A TARAP anti-NAFLD hatásának további megerősítése érdekében megvizsgáltuk a TG, TC, HDL-C és LDL-C szérumok szintjét. A modellcsoport patkányainak szignifikánsan magasabb volt a szérum TC, TG és LDL-C szintje, és alacsonyabb volt a HDL-C szintje a normál patkányokhoz képest () (2. (a) és 2. (b) ábra). A TC, TG és LDL-C szint emelkedését és a HDL-C csökkenését NAFLD patkányokban TARAP kezeléssel semlegesítették ().
(modell versus vezérlés), #
(magas vagy alacsony versus modell), ANOVA és post hoc teszt.
3.3. TARAP elnyomta az ACC, FAS és CPT expresszióját a NAFLD patkányokban
A TARAP anti-NAFLD aktivitásának mechanizmusának feltárásához megvizsgáltuk az ACC, FAS és CPT mRNS és fehérje expresszióját a májszövetekben RT-PCR assay és immunhisztokémiai elemzés (IHC) segítségével. Az eredmények azt mutatták, hogy az ACC és FAS mRNS és fehérje szintje jelentősen megemelkedett, míg a CPT szint szignifikánsan csökkent a modellcsoport májszöveteiben a kontroll csoporthoz képest () (3. ábra). A TARAP kezelés szignifikánsan semlegesítette az ACC, FAS és CPT mRNS és fehérje szintjének változását NAFLD patkányokban () (4. és 5. ábra).
- Zsírmájbetegség kezelései Alkoholmentes zsírmájbetegség
- Vancouveri zsíros máj természetes kezelése Vitalia Healthcare Naturopath
- Mi a zsírmájbetegség, és mit teszünk annak kezelésére Digestive UT Southwestern Medical
- Melyek a zsírmájbetegség szövődményei POZ
- Kinek kell kezelnie a zsírmáj betegség alapellátását vagy a hepatológiát