A fürjtojás-homogenizátum enyhíti az ételallergia által kiváltott eozinofil nyelőcsőgyulladást, mint a betegség a PAR-2 transzdukciós útvonal modulálásával mogyorószenzibilizált egerekben
Tárgyak
Absztrakt
Bevezetés
Az eozinofil nyelőcsőgyulladás (EoE) egy krónikus gyulladásos betegség, amely 1,2,3 ételallergiával társul, és amely komolyan befolyásolja a beteg normális életét. Ez a betegség a páciens nyelőcsövében nyilvánul meg, amelyet végtelen gyulladásos állapot jellemez. A nyugati országokban az EoE előfordulása drámai módon 10-ről 50-re nőtt minden 100 000 lakosra 4. Időközben, bár az EoE ázsiai országokból közzétett jelentései korlátozottak. Kinoshita et al. nemrégiben végzett szisztematikus irodalmi áttekintést végzett az EoE-ről az ázsiai országokban, amely összehasonlító EoE-betegség patogenezist tárt fel a nyugati és ázsiai betegek körében 5. Az EoE előfordulása az ázsiai országokban közel 17–6557/100 000 vizsgált endoszkópia, ami széles skálát mutat, amely potenciálisan az implicit vizsgálati torzításnak tulajdonítható, mint kis mintaméret és/vagy az endoszkópia indikációjának különböző formáinak alkalmazása. Annak ellenére, hogy az ázsiai populációban az EoE előfordulási gyakorisága jelentısen változó volt, az EoE betegség patogenezisének jellemzıi hasonlóak voltak a nyugati populációban tapasztaltakkal. Ami azt illeti, az EoE mára nemcsak a nyugati országokban, hanem Ázsiában is súlyos betegségnek bizonyult 5 .
Mostantól az EoE alapvető farmakoterápiája alapvetően az inhalációs kortikoszteroidoktól függ. Annak ellenére, hogy a szájon át szedett topikális szteroidok sikeresen korlátozhatják az EoE-vel kapcsolatos gyulladásokat, aggályok merülnek fel a szteroidok, például oropharyngealis, oesophagealis candidiasis, csont ásványi sűrűség-rendellenességek, glaukóma, hyperglykaemia, és egyéb antagonista hatások 2,6,7,8. Sürgető szükség van új és erőteljes gyulladáscsökkentő gyógyszerek keresésére és létrehozására az EoE számára.
Egy korábbi vizsgálatból kiderült, hogy a fürjtojás eltér a többi madártojástól. Különbség a tojásfehérjében van, a fürjtojás olyan fehérjékben gazdagabb, amelyek antiallergiás és gyulladáscsökkentő hatással bírnak 9 . In vitro tanulmány megállapította, hogy a fürjtojás olyan ovomucoidot és ovoinhibitort tartalmaz, amely enyhítheti az allergiás reakciókat a triptáz vagy bármely más tripszin homológ és proteáz-aktivált receptor 2 (PAR-2) 10 kötődésének blokkolásával. Ezenkívül 2015-ben az Egyesült Államok (a szabadalmi szám: US2015/0057232A1) 11 szabadalmat adott ki a fürjtojás szerepéről az immunsejtek működésének modulálásában, különösen az eozinofilek és a neutrofilek allergia kezelésében (szabadalmi szám: US2015/0057232A1) 11. a fürjtojások különleges szerepe.
A fürjtojás szerepét az allergiás asztmás 12,13 és a nátha 14 kezelések összefüggésében határozták meg, de az ételallergiában nem, különösen az élelmiszerallergia által kiváltott EoE-szerű betegségek kezelésében betöltött szerepéről korábban nem számoltak be. Ezért ez a tanulmány a földimogyoró-allergén által kiváltott EoE-szerű betegség egérmodelljét használta a fürjtojás gyulladáscsökkentő és antiallergiás hatásainak és mechanizmusának tanulmányozására az élelmiszerallergia kezelésében.
Eredmények
Az orális fürjtojás-kezelés enyhítette az EoE-szerű ételallergiás betegség tüneteit Balb/c egerekben
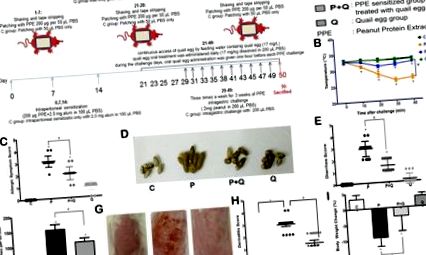
Az ételallergia előfordulását általában szisztémás és helyi allergiás tünetek és/vagy jelek jelzik 15. Annak eldöntése érdekében, hogy a fürjtojás képes-e enyhíteni az ételallergia által kiváltott EoE-szerű betegség tüneteit, megfigyeléseket végeztünk a szisztémás (testhőmérsékleti és túlérzékenységi válasz) és helyi allergiás reakciókról (hasmenés, karcolási viselkedés, dermatitis és testtömeg-csökkenés). egerek 40 percen belül a bőr vagy az intragasztrikus provokáció után. A földimogyoró-allergének által kiváltott EoE-szerű betegséget az egér modelljében az 1A. Ábra írja le.
A fehérje mogyorókivonat (PPE) szenzibilizált csoport (P csoport) testhőmérséklete a fertőzés után 40 percen belül a legalacsonyabb pontra csökkent. A kontrollcsoporthoz (C csoport) képest a P egércsoport testhőmérséklete 6,50 ± 0,76 ° C-kal csökkent (P 16, tükrözheti a test immunállapotát. A testben található antitestek számának körülbelül 80% -a IgG, nyomokban IgE 17. Annak a ténynek köszönhetően, hogy a fürjtojás lehetővé teszi a test számára, hogy specifikus antitesteket termeljen, elemzést végeztünk a mogyoró- és fürjtojás-specifikus IgE és IgG1 antitest szinteken. Amint a 2A. Ábra mutatja, a PPE-fertőzés kezdetén (28. nap) a PPE-specifikus IgE szintje a P-csoportban szignifikánsan megemelkedett a kontroll csoporthoz képest (P 2. ábra
Ezenkívül az IgG1 szint változása általában összhangban van az IgE szint változásával. Amint a 2B. Ábra mutatja, a szenzibilizációs szakaszban (28. nap) a P csoport magas szintű PPE-specifikus IgG1-t mutatott, a magas IgG1 szint a kísérlet végéig folytatódott (P 18,19. Ezért annak érdekében, hogy meghatározzuk a hízósejt és az eozinofil aktiváció mértékét a kísérleti egerekben, elemzést végeztünk a szérumban felszabaduló allergiás mediátorokról, valamint a hisztamin, triptáz és eozinofil kationos fehérje (ECP) szintjéről (2C-E ábra). A kontrollhoz (C csoport) képest ez a három allergiás mediátor szignifikánsan megnőtt a P-csoportban, míg az orális fürjtojás-kezelés (P + Q-csoport) jelentősen gátolni tudta e három mediátor felszabadulását (P 20. Az eozinofilek az allergia központi effektor sejtjei, amelyek növelik az allergiás inflációt 20, a hisztamin az effektor molekulák, amelyek felszabadulnak az allergén reakció során, ezek a kettő az allergiás reakció kulcsfontosságú összetevője, ahol ezek mennyisége növekszik, de ha az allergia modulálódik, mennyiségük csökken 20 .
Az orális fürjtojás-kezelés csökkentette a lépsejtekből az EoE-vel kapcsolatos citokineket
Egereken és embereken végzett klinikai vizsgálatok feltárták a Th2 sejtek és az iNKT-sejtek szerepét a betegség patogenezisében 21. Ezért megvizsgáltuk a fürjtojás kezelésének a Th2-citokinekre (IL-4, IL-5 és IL-13), a negatív regulátorra (IL-10), az iNKT sejt citokinre (IL-15) és az atópiás dermatitiszre gyakorolt hatását. rokon citokin (TSLP). A kontroll csoporthoz képest a PPE-szenzibilizált és fertőzött egerek (P csoport) szignifikáns növekedést mutattak a Th2 IL-4 és IL-5 citokinekben (P 3. ábra
Az orális fürjtojás-kezelés csökkentette az eozinofil számokat és a kapcsolódó mediátorokat
Tanulmányok arról számoltak be, hogy az ételallergének behatolhatnak a szervek szövetébe, stimulálhatják a hámsejteket a gyulladásgátló citokinek felszabadítására, és ezáltal megkönnyíthetik az eozinofil utólagos aktiválódását, valamint támogathatják az EoE-szerű betegség kialakulását allergiás betegeknél 2,21,22. Egy nemrégiben készült állatallergia-élelmiszer-allergia által kiváltott EoE-kórvizsgálat kimutatta, hogy az orális földimogyoró-allergén kihívás elősegítheti az eozinofil infiltráció felhalmozódását a nyelőcsőben, a tüdőben és a vékonybélben 21 Ezért további elemzéseket végeztünk, hogy meghatározzuk az orális fürjekezelés hatását az eozinofil infiltráció modulálására az EoE-betegség progressziója alatt.
Először a nyelőcsőben, a tüdőben és a vékonybélben az eozinofil infiltráció számát számoltuk nagy nagyítással. Az eredmények az eozinofilek számának jelentős növekedését mutatták a P csoport három gyulladt szövetében (P 2, tüdő: (11,60 ± 1,70) × 10 2, vékonybél: (9,34 ± 1,96) × 10 2/mm2 szövetréteg). Az orális fürjtojás-kezelés szignifikánsan csökkentette az eozinofil infiltráció számát, amint azt a P + Q csoportban megfigyelték (P 2, tüdő: (6,62 ± 1,46) × 10 2, vékonybél: (6,05 ± 0,48) × 10 2/mm 2 szövetréteg), míg PPE-vel nem érzékenyített egerek (Q csoport) fürjtojás-kezelése, a vékonybél kivételével (( 5,87 ± 0,95) × 10 2/mm 2 szövetréteg), nem mutatott eozinofil szám növekedést a kontrollcsoport vékonybélében az eozinofil infiltráció számához képest ((5,688 ± 1,34) × 10 2/mm 2 szövetréteg ) (4A – B. Ábra).
Gyulladásos gócoknál az eozinofilek allergén által vezérelt toborzása olyan kritikus mediátorokon keresztül történik, mint az IL-5 és az eotaxin-1 kemokinek 23 családja, amelyek az eozinofilek aktivációját indukálják. A gyulladás ezen helyén az eozinofilek aktiválódnak; lipid mediátorok, például leukotrién (LTC4) és toxikus szemcsefehérjék, például eozinofil kationos fehérje (ECP) szintézisét indukálja, ami szövetkárosodáshoz vezet és allergiás gyulladásos tüneteket vált ki 24. Ezért felmértük e szövetekben felszabaduló eozinofil rokon mediátorok expresszióját. A PPE allergén hatására az IL-5 (4C. Ábra), az eotaxin-1 (4D. Ábra), az LTC4 (4E. Ábra) és az ECP (4F ábra) szintemelkedés indukálódott a három szövetben (P 25,26. Ezért kimutattuk a pro-gyulladásos citokinek és kemokinek (TNF-α, IL-6, IL-8, RANTES, TGF-β) és az adhéziós molekulák mRNS-szintjét (ICAM-1 és VCAM-1) a a nyelőcső, a tüdő és a belek szövetei. Az eredmények azt mutatták, hogy a fürjtojás jelentősen csökkentheti a gyulladásgátló citokinek és a PPE által indukált adhéziós molekulák szintjét (P 5. ábra
Ezenkívül ugyanazt az eredményt figyelték meg a felszabadult szérum- és splenocita-mediátorok és citokinek esetében, a fürjtojás beadása jelentősen csökkentette a triptáz, az IL-15 és a TSLP szintjének emelkedését (P A 27. ábrán azt találtuk, hogy az mMCP-8 szintje a PPE-szenzibilizált és a provokációs (P) egerek csoportjában szignifikánsan megnőtt (P 10. Ezért tovább vizsgáltuk a fürjtojás kezelésének PAR-2 receptor aktiválódására gyakorolt hatását az EoE, például ételallergia egér modellünkben. Immunhisztokémiai módszerrel megfigyeltük a PAR-2 expressziójának kvalitatív és kvantitatív értékelését nyelőcsőben, tüdőben és vékonybél szövetekben. A kontroll csoporthoz képest az eredmények azt mutatták, hogy az ismételt PPE-fertőzés után a PAR-2 expressziós szintje szignifikánsan megemelkedett a P-csoport nyelőcsövében (59,75 ± 18,55%) és a tüdő (79,00 ± 39,03%) szövetében (P 6. ábra
A PAR-2 képes aktiválni a downstream NF-κB jelátviteli utat, és fontos szerepet játszik a gyulladás kiváltásában 28. A p65 foszforilációja az NF-KB jelátviteli út aktiválásának fő kulcsa 29. Eredményeink azt mutatták, hogy a PPE stimuláció után a p65 (Ser536) foszforilációs szintje a P csoportban szignifikánsan megemelkedett (P
Vita
Eközben nagyrészt ismert, hogy a fürjtojás maga tartalmazott tojásallergéneket, amelyek szintén hatással lehetnek az immunút szabályozására, hogy előnyöket biztosítsanak az allergiás reakciók előfordulásában. Bár ebben a tanulmányban azt is megállapítottuk, hogy a fürjtojás orális kezelése a fürjtojás-specifikus IgE jelentős növekedését indukálhatta a 35. napon, a PPE-specifikus IgE és IgG1 jelentős csökkenését találtuk a mogyoróallergénekkel szenzibilizált egerekben is fürjtojással. A fürjtojás-specifikus IgE jelentős emelkedése a későbbiekben csökkent, ami a fürjtojás allergének iránti tolerancia kialakulását jelzi. A fürjtojás elleni IgE antitest termelése ebben az egércsoportban nem volt meglepő, mivel a fürjtojásfehérje sok ismertetett allergént tartalmazott, és a kísérletben használt egerek mindegyike kapott adjuvánst a válasz elősegítésére. Érdekes módon a PPE robusztus földimogyoró-allergénekre specifikus IgE-t és IgG1-t váltott ki érzékenyített egerekben, míg a fürjtojás csak mérsékelt címet váltott ki a fürjtojás-specifikus IgE és IgG1-ben. Ez a jelenség valószínűleg az allergén expozíció útjával függ össze, mivel leírták, hogy a bőr expozíció hajlamos allergiás immunválasz kialakulására, míg a szájon át történő expozíció általában toleranciát mutat 47 .
A fürjtojás antiallergiás és gyulladásos hatásának mechanizmusának sematikus diagramja az ételallergia által kiváltott EoE-szerű betegség-allergiás reakcióhoz.
- Az Egyesült Államokban minden tíz felnőttből ételallergiás, de majdnem minden ötödik azt gondolja, hogy a felnőttek csaknem fele
- ALKALIN KÖRNYEZETBEN NEM LEHET BETEGSÉG - Természetes Élőkamra Online StorePoint Balance 0
- Menütervezés az ételallergia szakács számára
- Táplálkozási szakértőnk beszél ezekről a mindennapi ételekről, amelyek ételallergiát okozhatnak
- Bevált étkezési receptek a gyomorbetegségek kezelésére