Galleria mellonella (nagyobb viaszmoly) lárvák mint modell az antibiotikum-érzékenység tesztelésére és az akut toxicitási vizsgálatokra
Absztrakt
Háttér
A fertőző vizsgálatok és a rágcsálókon végzett toxicitási vizsgálatok fontos előfeltételei a vegyületek emberben történő alkalmazásának. Patkányokon és egereken végzett vizsgálatok azonban költségesek, és vannak etikai megfontolások. Galleria mellonella (nagyobb viaszmoly) lárvák potenciális alternatívát jelentenek. Értékeltük ezen rovarok alkalmazhatóságát fertőzőségi vizsgálatokban és toxicitási tesztekben.
Megállapítások
Négy baktériumfaj (két Gram-negatív és két Gram-pozitív) felhasználásával megvizsgáltuk négy antibiotikum hatékonyságát Gallériában a fertőzésekkel szemben, és összehasonlítottuk az antibiotikum-érzékenységet az embereknél. Általában jó összefüggést találunk. Hasonlóképpen, 11 vegyületet vizsgáltunk (kezdetben vakon tesztelték) toxicitását Gallériában, és összehasonlítottuk ezt egerek és patkányok toxicitási kísérleteivel. Ismét jó összefüggést találtunk a Galleria és a rágcsálók toxicitása között.
Következtetés
A kezünkben azt találtuk G. mellonella a lárvák felhasználhatók fertőzőképességi vizsgálatokban és toxicitási tesztekben, és hogy ezek a vizsgálatok olcsó és könnyen végrehajtható alternatívát jelentenek a rágcsálókon végzett tesztelés számára.
Háttér
6 hét) olcsón és speciális felszerelés nélkül; ráadásul általában nem vonatkoznak rájuk etikai megfontolások. A galleria lárvák nagyok, az ötödik pillanatban elérik a 250–300 mm hosszúságot, ami elegendő a tesztvegyületek intraperitoneális injekciójához. Ezenkívül a rovarok immunrendszere funkcionálisan és szerkezetileg hasonló az emlősök veleszületett immunrendszeréhez [7, 8].
Galleria mellonella a lárvákat használták először az antibiotikum hatékonyságának felmérésére Acinetobacter baumannii [9]. A cefotaximot, a tetraciklint, a gentamicint és a meropenemet szisztémás rendszerrel szemben vizsgáltuk A. baumannii fertőzés. Gentamicin és meropenem, amely A. baumannii érzékeny, jelentősen meghosszabbította a fertőzött lárvák túlélését, míg a fertőzött, de kezeletlen lárvák és a cefotaximmal és tetraciklinnel kezelt lárvák, amelyeknek a baktériumok ellenállóak, túlélés 5 nap alatt kevesebb mint 25% volt. A modell számos tudományos csoportban gyorsan felkeltette az érdeklődését, és standard tesztmodellként használta. G. mellonella lárvákat alkalmaztak feltörekvő kórokozók [10] és a perzisztáló kórokozók új kezelési módszereinek vizsgálatára [3].
Jelen munka célja a G. mellonella antibiotikum-érzékenységi vizsgálatokban és annak feltárása, hogy rutinszerűen alkalmazhatóak-e azok akut toxicitási vizsgálatokban is. Konkrétan az antibiotikum hatékonysági vizsgálatokhoz azt akartuk megállapítani, hogy a viaszmoly lárvákban megállapított terápiás dózisok korrelálnak-e az emberi felhasználásra ajánlott dózisokkal, és a toxicitási vizsgálatok során azt szerettük volna megállapítani, hogy a viaszlepke lárvákra megállapított LD50 értékek korrelálnak-e az értékekkel rágcsálókban megalapozott.
Mód
Baktériumtörzsek és táptalajok
Két Gram-pozitív és két Gram-negatív baktérium törzset választottunk, amelyek klinikai szempontból relevánsak ezekhez a vizsgálatokhoz; ezek voltak: Escherichia coli (ATCC 25922), Mycobacterium smegmatis (ATCC 700084), Pseudomonas aeruginosa (ATCC 15692) és Staphylococcus aureus (ATCC 29213), és az Egészségvédelmi Ügynökség kultúragyűjteményéből szereztük be (Public Health England, Porton Down, Egyesült Királyság). Glicerin törzsekből tenyésztettük és megfelelő táptalajon tartottuk agarlemezeken [Middlebrook táptalaj (BD Difco 7H9) M. smegmatis, LB (LMM0202, Formedium) minden máshoz], mielőtt 37 ° C-on aerob módon növekedne az LB-táptalajban. A tenyészeteket legalább kétszer szubkultúráztuk, mielőtt a vizsgálatokban felhasználtuk őket.
Vegyületek
Ampicillint, ciprofloxacint, rifampicint és tetraciklint az antibiotikum hatékonyságának vizsgálatához a Sigma Chemicals-tól szereztünk be. Az Inspiralis Ltd. által szállított vegyületek toxicitási vizsgálatához a források a következők voltak: ciprofloxacin (Fluka), etopozid, novobiocin, amsakrin, NaCl, tetraciklin, DMSO, klorokin, sztreptomicin és ATP (Sigma), klóramfenikol (Duchea Biochemie), doxorubicin (Calbiochem) és a glükóz (Fisher Chemicals) (1. táblázat). Oldhatatlansági problémák miatt az amszakrint 8 mg/ml koncentrációban adtuk 50% DMSO-ban vízben; a doxurubicint 5,5 mg/ml koncentrációban 50% DMSO-ban, vízben adtuk be. A toxicitási vizsgálatokhoz az összes vegyületet kezdetben számozott csövekben szolgáltattuk vegyületnév nélkül, az elkerülhetőség elkerülése érdekében. A vegyületek azonossága csak a vizsgálati eljárás befejeztével derült ki, és a G. mellonella összehasonlították a vegyületekkel elérhető anyagbiztonsági adatlapokkal (MSDS).
Rovarnevelés
Gyarmata G. mellonella a John Innes Center Entomology Facility-től szerezték be (eredetileg a Livefood UK Ltd.-től származott). A telepet sötétben, 37 ° C-on tartottuk, nagy Petri-csészékben (140 mm, Sterilin), amelyek mesterséges táplálékkal voltak tele. A mesterséges étel 300 ml mézből (Sainsbury's Honey, Clear), 400 ml glicerolból (G5516, Sigma Chemicals), 200 g tejporból (szárított sovány tejpor, Marvel), 200 g teljes kiőrlésű lisztből (Strong Stoneground 100% teljes kiőrlésű liszt) állt., Sainsbury's), 100 g élesztőpor (103753, Merck), 100 g búzacsíra (Neal's Yard Wholefoods természetes búzacsíra) és 400 g korpa (Neal's Yard Wholefoods természetes búzakorpa). Először a száraz és a nedves összetevőket külön-külön összekeverték, majd az elegyeket egyesítették. Az étrendet méhviasz pellettel keverték 2: 1 arányban. A fel nem használt ételeket 4 ° C-on tároltuk. Az ételt hetente legalább egyszer kicserélték, hacsak nem maradt elegendő mennyiség a lárvák táplálkozásához, amely esetben több ételt adtak a tartályokhoz.
G. mellonella injekciós eljárás
Öt-tíz lárvát (egyenként 250–320 mg) szelektáltunk véletlenszerűen az eljárás minden lépéséhez. A kutikula elsötétedésével járó lárvákat eldobtuk. A tesztvegyületeket a hemocoelbe DMSO vagy PBS pufferbe injektáltuk az utolsó bal proleg (Hamilton fecskendő 701N, 10 μl térfogat, tűméret 26 s, kúpcsúcs) keresztül [10], hacsak másként nem jelezzük. A lárvákat orvosi szövetekre (Kimtech) helyezték, hogy megakadályozzák a hemolimfa szivárgását. A lárvákat 5 napig sötétben inkubáltuk, és naponta regisztráltuk a mortalitást.
A baktériumok fertőző dózisának meghatározása
A baktériumok fertőző dózisát úgy határoztuk meg, hogy öt lárvából álló csoportokat injektáltunk bakteriális szuszpenzióval: injekciónként 5 × 104 4 telepképző egység (cfu), 5 × 105 cfu, 5 × 10 6 cfu és 5 × 107 cfu. A lárvákat 5 napig inkubáltuk. A fertőző dózist úgy definiálták, mint amely immunválaszt váltott ki, amely a kutikula sötétedésével felismerhető [10]. Ban ben G. mellonella a lárvák immunválasza az immunrendszer sejtjeivel immobilizált baktériumok körül melanin plakkok kialakulásához vezet. Ezek a plakkok sötétnek tűnnek a kutikulán keresztül. A baktériumok fertőző dózisa 60-80% -os letalitást okozott 48 órán belül, de nem 100% -os letalitást 24 órán belül. A lárvákat 37 ° C-on inkubáltuk, amikor a baktériumok virulenciája változik a hőmérséklettel, és a kísérletet úgy tervezték, hogy utánozza az emberek fertőzését.
Antibiotikum hatékonyságvizsgálat
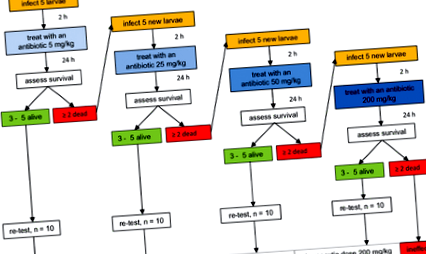
Az antibiotikum hatékonysági teszt egymást követő lépéseit bemutató folyamatábra. 5 mg/testtömeg-kg kezdő dózist adtunk be, és a rovarokat a túlélés szempontjából pontoztuk. Ha a mortalitás 40% alatt volt, akkor a vegyületnek a legkisebb terápiás dózist adták. Ha a mortalitás meghaladta a 40% -ot, akkor magasabb dózist teszteltek a terápiás dózis megállapításáig
Toxicitásvizsgálati eljárás
Az akut toxicitási vizsgálat egymást követő lépéseit bemutató folyamatábra. 5 mg/testtömeg-kg kezdő dózist adtak be, és a rovarok pontozását a mortalitás alapján értékelték. Ha a mortalitás meghaladta a 40% -ot, akkor a vegyületet a legmagasabb toxicitási osztályba sorolták. Ha a mortalitás 40% alatt van, az adagot újra tesztelték, és a tesztet addig folytatták, amíg egy toxikus dózist megállapítottak
Eredmények és vita
Dizájnt tanulni
Mind az antibiotikum hatékonysági vizsgálatok, mind a toxicitási tesztek az OECD egereken és patkányokon végzett toxicitási vizsgálatára vonatkozó iránymutatásokon alapultak [15]. Az irányelveket a G. mellonella mert ezek statisztikailag megbízható módszerek, és lehetővé teszik az egyszerű és egyértelmű kezdő és végpontú munkafolyamatot.
Antibiotikum hatékonyság
Kezdetben minden baktériumfajra meghatározták a baktériumok megfelelő fertőző dózisát. A fertőző dózis olyan immunreakciót váltott ki, amely a kutikula sötétedése és 60-80% -os letalitása volt 48 órán belül, de nem 100% -os letalitás 24 órán belül. Megállapítottuk, hogy ez 5 × 10 6 cfu 10 µl-ben E. coli, M. smegmatis és S. aureus, és 5 × 104 cfu 10 µl-ben P. aeruginosa.
Négy antibiotikum hatékonysága: ampicillin, ciprofloxacin, tetraciklin és rifampicin G. mellonella a lárvákat négy bakteriális kórokozóval értékeltük: Gram-pozitív M. smegmatis és S. aureus, és gram-negatív E. coli és P. aeruginosa. Minden baktériumtörzsnél volt legalább egy antibiotikum, amely az adott törzs által okozott fertőzés kezelésében javallt, és legalább egy olyan antibiotikum, amely az előrejelzések szerint nem távolítja el a fertőzést, hogy megerősítse, hogy az antibiotikum hatása, és nem a rovarok immunitása felelős. a gyógyuláshoz.
Az antibiotikumok hatékonyságának tesztelését a „Módszerek” részben leírtak szerint végeztük. Az antibiotikum terápiás dózisát akkor határozták meg, amikor az antibiotikum megmentette a bakteriális fertőzés okozta halálozást. Amikor még az antibiotikum legmagasabb dózisa sem tisztította a fertőzést, az antibiotikumot hatástalannak tekintették az említett baktériumokkal szemben. Az eredményeket a 2. táblázat foglalja össze. Az antibiotikum-tesztelésnek négy lehetséges eredménye van: „(1) az antibiotikum előre jelzett dózisa kitisztítja a bakteriális fertőzést, (2) az előre jelzett dózistól eltérő dózis kitisztítja a fertőzést, (3) antibiotikum hatástalannak jósolják, hatástalan, (4) hatástalannak vélt antibiotikum tisztítja a bakteriális fertőzést. A legtöbb esetben az antibiotikumok megközelítőleg az előrejelzés szerint teljesítettek, vagy fertőzést kezeltek az előre jelzett dózison belül, vagy hatástalanok voltak egy rezisztens törzs ellen.
Ezek az antibiotikum-hatékonysági vizsgálatok a meglévő szakirodalomon alapultak [2]. G. mellonella a lárvákat korábban a baktériumok virulenciájának és az antibiotikumokra való hajlamának tanulmányozására használták, és tanulmányunk megerősítette, hogy a lárvák alkalmas gazdaszervezetnek az antibiotikum hatékonysági vizsgálatokhoz. Ezenkívül megállapítottuk, hogy az antibiotikum terápiás dózisa a G. mellonella gyakran megegyezik az embereknél javasolt dózisokkal.
Kísérleteink alátámasztják azt a javaslatot, hogy az antibiotikum hatékonyságának vizsgálata elvégezhető G. mellonella és az emberi felhasználásra ajánlott terápiás dózisok átválthatók a viaszmoly lárvák dózisaivá. A legtöbb esetben a szisztémás fertőzés klinikai kezelésére ajánlott pontos dózis kiszámítható a lárvák testtömegére és megtisztíthatja a fertőzést. Ilyen összefüggés azért lehetséges, mert a mikrobiális virulencia mechanizmusai gyakran nem gazdaszervezet-specifikusak. Ahol az előrejelzések nem egyeztek az eredményekkel, különféle lehetséges magyarázatok vannak, pl. különbségek az immunválaszokban a különböző organizmusokban, stb. Korábbi vizsgálatok kimutatták, hogy a gombás kórokozó Candida albicans rovarok és emlősök ellen ugyanazt a gomba virulenciában és az élesztő-hipa átmenetben részt vevő effektorok repertoárját használja [4]. Hasonlóképpen a bakteriális kórokozó P. aeruginosa hasonló virulencia génkészletet alkalmaz a viaszmoly lárvák és egerek immunrendszerének leküzdésére [6], és a lárvák felhasználhatók az emlősök fertőzéséhez szükséges virulencia faktorok azonosítására.
Toxicitásvizsgálat
Az Inspiralis Ltd. 11 vegyületet bocsátott rendelkezésre toxicitásuk tesztelésére G. mellonella lárvák. A vegyületeket kezdetben vakon tesztelték, azaz számozott csövekben szállították őket, és csak a vizsgálati eljárás befejezése után kapcsolták a számokat a vegyületek nevéhez. Ennek a megközelítésnek az volt a célja, hogy elkerülje az elfogultságot, vagyis alacsonyabb toxikus dózisokat rendeljen az ismert mérgező vegyületekhez, a magasabbakat pedig a biztonságosabb vegyületekhez.
A rovarokat (5–10 lárva) 10 µl vegyülettel injektáltuk a leghátsó szárba. Az intraperitoneális injekciót alkalmazták a mérgező vegyület vagy a bakteriális kórokozó mennyiségének szigorú ellenőrzésére, amelynek a lárvák ki voltak téve. A jelen tanulmányban nem alkalmazott alternatív megközelítések etetési eljárásokat [16] vagy kontakt expozíciót alkalmaznak [17]. Egy vegyületnek való expozíció számszerűsítése kevésbé pontos az ilyen eljárásoknál, de néha megfelelőbb módszer, ha ismert az expozíciós út. Például a rovarok tesztelésénél alkalmazott peszticid-toxicitás általában etetési vizsgálatokat alkalmaz [18], mivel ez a szokásos expozíciós út.
A rovarokat először alacsony dózisban (5 mg/testtömeg-kg) injektálták a vegyületekből, és a mortalitást naponta 5 napig regisztrálták. Ha nem tapasztaltak mortalitást, új lárvacsoportokat injektáltak 50 mg/testtömeg-kg vegyületekkel, és a mortalitást ismét naponta 5 napig regisztrálták. Amikor a lárvák legalább 60% -ában elhullást figyeltek meg, a vegyületet ugyanabban a koncentrációban tesztelték a toxicitás megerősítése érdekében. Amikor 60% alatti mortalitást figyeltünk meg, a vegyületeket ezt követően 125, 300 és 2000 mg/testtömeg-kg dózisban teszteltük. Mindegyik vegyülethez LD50 értéket rendeltek (3. táblázat), és az értékeket összehasonlították az MSDS oldalakon rendelkezésre álló toxicitási adatokkal. Egyetlen vegyületet sem teszteltek 2000 mg/testtömeg-kilogramm felett az OECD irányelveivel összhangban [15]. Az ilyen magas vegyületkoncentrációk oldhatósági problémákat vetnek fel, és az irányelvek nem kívánatosak és etikátlanok. Általában azokat a vegyületeket, amelyek 2000 mg/testtömeg-kg dózisban nem mutatják a toxicitást, nem toxikusnak tekintik.
A toxicitási vizsgálatok összehasonlítása G. mellonella rágcsálókon végzett vizsgálatokkal
A viaszmoly lárvák és a rágcsálók toxicitásának összehasonlításának három lehetséges eredménye van. Először is, a toxicitás lehet azonos vagy nagyon hasonló. Másodszor a mérgező dózisok G. mellonella nagyobb lehet, mint a rágcsálóké, és végül a mérgező dózisok G. mellonella alacsonyabb lehet, mint a rágcsálók dózisa. A szokásos injekciós közegünk, 50% DMSO vízben, halálos volt a lepkék viaszának 100 mg/testtömeg-kilogrammnak megfelelő dózisban (4 μl törzsoldat injekciója vagy több, mint 2 μl tiszta DMSO injekciónként). Valamennyi 100 mg/testtömeg-kilogramm felett mérgező vegyületet módosított injekciós közegben, csökkent DMSO-mennyiségű (
Következtetés
Összefoglalva: kísérleteink alátámasztják azt a javaslatot, hogy az antibiotikum hatékonysága in vivo tesztelhető in Galleria mellonella lárvák. Megállapítottuk, hogy az emberi felhasználásra ajánlott dózisok hatékonyak lehetnek a lárvák szisztémás fertőzésében, és hogy a viaszmoly lárvákban lévő vegyületek akut toxicitása korrelál az egerek és patkányok toxicitásával. G. mellonella olyan szervezet, amelyet különféle vizsgálatokkal könnyen be lehet fogadni. Nem képes teljes mértékben pótolni az emlősök modelljeit, de sokkal olcsóbb, és statisztikai stabilitást biztosíthat a jelenlegi állatmodellek hiányában.
- A glicin helyreállítja a leucinra adott anabolikus választ az akut gyulladás amerikai egérmodelljében
- Az új válaszok megzavarása a modell öngyilkosságában
- A magas zsírtartalmú étrend hatása a bél mikrobiomák dysbiosisára az Öböl-háborús betegség egérmodelljében
- A Helix DNS-tesztelés valóban meghatározhatja-e a tökéletes étrendet és edzést
- Nagy-völgy YMCA