A glicin helyreállítja a leucinra adott anabolikus választ az akut gyulladás egérmodelljében
Alap- és Klinikai Myológiai Laboratórium, Élettani Tanszék, Melbourne-i Egyetem, Melbourne, Victoria, Ausztrália;
Alap- és Klinikai Myológiai Laboratórium, Élettani Tanszék, Melbourne-i Egyetem, Melbourne, Victoria, Ausztrália;
Alap- és Klinikai Myológiai Laboratórium, Élettani Tanszék, Melbourne-i Egyetem, Melbourne, Victoria, Ausztrália;
Alap- és Klinikai Myológiai Laboratórium, Élettani Tanszék, Melbourne-i Egyetem, Melbourne, Victoria, Ausztrália;
Táplálkozás és anyagcsere, Dél-ausztrál Egészségügyi és Orvosi Kutatóintézet, Adelaide, Dél-Austrailia, Ausztrália; és
Biológiai Tudományok Iskola, Adelaide Egyetem, Adelaide, Dél-Ausztrália, Ausztrália
Táplálkozás és anyagcsere, Dél-ausztrál Egészségügyi és Orvosi Kutatóintézet, Adelaide, Dél-Austrailia, Ausztrália; és
Biológiai Tudományok Iskola, Adelaide Egyetem, Adelaide, Dél-Ausztrália, Ausztrália
Alap- és Klinikai Myológiai Laboratórium, Élettani Tanszék, Melbourne-i Egyetem, Melbourne, Victoria, Ausztrália;
Alap- és Klinikai Myológiai Laboratórium, Élettani Tanszék, Melbourne-i Egyetem, Melbourne, Victoria, Ausztrália;
Az újranyomtatási kérelmek és egyéb levelezések címe: R. Koopman, Physiology of Physiology, Univ. of Melbourne, Melbourne, Victoria 3010 Australia (e-mail: [email protected]).
Absztrakt
az aminosavak, különösen a leucin, hatékonyan serkentik a fehérjeszintézist és csökkentik a fehérje lebontását az egészséges vázizomzatban (34). Ennek eredményeként a leucinban gazdag aminosav-kiegészítést javasolták izom-pazarló állapotok lehetséges kezelésére. A mai napig azonban nem végeztek hosszú távú, izokaloros, placebo-kontrollos humán vizsgálatokat, amelyek a leucin-kiegészítés jótékony hatását mutatták volna a vázizom tömegére vagy funkciójára (25). Annak ellenére, hogy az egészséges vázizomzatban a leucinban gazdag kiegészítők bevitele után fokozott fehérjeszintézist mutatnak be, a leucin beadása nem feltétlenül fokozza a fehérjeszintézist izompazarló körülmények között. Ezt az aminosavakra adott csökkent fehérjeszintetikus reakciót (vagy teljes hiányát) „anabolikus rezisztenciának” nevezik (46), és számos izompazarló állapotban figyelték meg, ideértve az immobilizációt (19), az öregedést (9), a rákos cachexiát (54)., 55) és a vérmérgezés (17). A normál aminosavval stimulált fehérjeszintézis zavara jelentős izomtömeg-vesztés fő tényezője számos izompazarló állapotban, és fontosak az anabolikus rezisztencia kezelésére irányuló stratégiák (9, 19, 40, 46).
Annak ellenére, hogy az anabolikus rezisztenciáért felelős pontos mechanizmusok nem tisztázottak, vélhetően központi szerepet játszik a sok izompazarló állapothoz kapcsolódó proinflammatorikus citokinek és reaktív oxigénfajok (ROS) túltermelése (3, 9, 28). A gyulladás és a ROS gátolja az 1 rapamicin komplex (mTORC1) mechanisztikus célpontjának aktivitását, és csökkenti az eukarióta iniciációs faktor 4E-kötő fehérje 1 (4E-BP1) és a p70 S6 kináz 1 (S6K1) foszforilációját (17). Az mTOR és szubsztrátjainak 4E-BP1 és S6K1 leucin-indukálta foszforilációjának ~ 80% -os csökkenését és a leucinnal stimulált fehérjeszintézis gátlását mind megfigyelték a vázizomsejtekben a gyulladás során (36). A leucinnal szembeni anabolikus rezisztencia gyulladásos állapotokban összhangban áll a klinikai vizsgálatok kiábrándító eredményeivel, amelyek az elágazó láncú aminosavban gazdag táplálék-kiegészítők alkalmazásával próbálják ellensúlyozni a traumás betegek izomsorvadását (10). Tekintettel arra, hogy az étkezési aminosav beadása nem volt stratégia az anabolikus rezisztencia leküzdésére és az izomsorvadás mérséklésére, feltételeztük, hogy egy ígéretesebb stratégia az izomsorvadás elleni küzdelemre az aminosavak normális anabolikus reakciójának helyreállítására összpontosít.
Megvizsgáltuk a glicin azon képességét, hogy helyreállítsa az alapfehérje anyagcserét és az aminosavakra adott normális anabolikus választ, a vázizomzatban jól bevált akut gyulladás modell segítségével. A gyulladást C57BL/6 egerekben indukálták 1 mg/kg lipopoliszacharid (LPS) beadásával intraperitoneális injekcióval, és 4 órával később megmértük a bazális és a leucin által stimulált fehérjeszintézis relatív sebességét. Bár köztudott, hogy az egér LPS modelljeiben a betegség klinikai lefolyása és progressziója sokkal gyorsabb, mint az embereknél, az LPS modell az akut gyulladás jól elismert, egyszerű és reprodukálható endotoxémiás modelljét képviseli (18, 45). Sőt, ez a protokoll korábban kimutatták, hogy csökkenti az alapfehérje szintézist és teljesen megszünteti a fehérje-szintetikus reakciót a leucinnal szemben (37). Feltételeztük, hogy az 1 g/kg glicinnel történő előkezelés csökkenti a gyulladást és megőrzi az anabolikus választ a leucinra (0,5 g/kg) az LPS-sel kezelt egerekben.
Állatok.
Protein szintézis.
A fehérjeszintézis relatív sebességének meghatározásához SUnSET módszertant alkalmaztunk a korábban leírtak szerint (22). Röviden, puromicint adtunk egereknek (ip) 0,04 μmol/kg dózisban 30 percig 0,5 g/kg leucin vagy ennek megfelelő térfogatú sóoldat injekciója után. Pontosan 30 perccel a puromicin beadása után az egereket méhnyak diszlokációval eutanizálták, és a tibialis anterior (TA) és a quadriceps (QUAD) izmokat gyorsan feldarabolták, szűrőpapírra foltozták és lefagyasztották (
1. táblázat: Felhasznált alapozó szekvenciák
A génneveket a következőképpen ismerjük: Trim63, izomspecifikus RING ujj 1; Fbxo32, MAFbx vagy atrogin-1; Bnip3, BCL2/adenovírus E1B 19-kDa-kölcsönhatásban lévő fehérje 3; Ccl2, kemokin (C-C motívum) 2. ligandum; Ccl5 (kemokin (C-C motívum) 5. ligandum; Socs3, A citokinek szignalizációjának szuppresszora 3. A primereket Invitrogen szoftver segítségével terveztük meg a GeneBank-tól kapott génszekvenciákból. Az alapozó specifitást az Alapvető Helyi Igazítás Kereső eszközzel határoztuk meg.
Vázizom szövettan.
Immunblot.
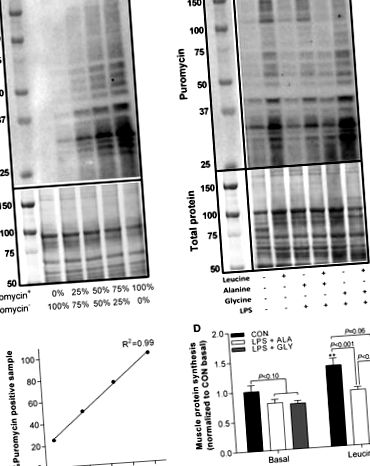
1. ábra.A glicin ellensúlyozza az LPS által kiváltott anabolikus rezisztenciát a leucinnal szemben. A reprezentatív Western blot soros hígításainak standard görbéje (A) és puromicin-pozitív puromicin-negatív fehérje mintával (B). A puromicinnel jelölt fehérjék mennyiségi meghatározása (fehérjeszintézis) reprezentatív Western-blotokkal korrigálva (C) és a puromicin standard görbéje (D). Jelentős különbségek (P
statisztikai elemzések.
Valamennyi értéket átlagként ± SE-ben fejeztük ki. Az adatokat a megfelelő kontrollcsoportra normalizáltuk a megjelenítés megkönnyítése érdekében, hacsak másképp nem jelöljük. Az adatokat a normalitás és a variancia homogenitása szempontjából Shapiro-Wilk és Levene teszttel teszteltük. Kétirányú ANOVA-kat (kezelés × bazális/táplált) alkalmaztunk a csoportok közötti összehasonlításhoz, ahol ez helyénvaló, míg az egyirányú ANOVA-kat használtuk az összes többi összehasonlításhoz. Tukey post hoc tesztjét alkalmazták a szignifikáns fő hatások meghatározásához, míg Fisher legkevésbé szignifikáns különbségtesztjét alkalmazták az egyes csoportok közötti interakciók összehasonlításához. Az átláthatóság érdekében mindkét jelentős különbség (P
2. ábra.Az LPS gyengíti a leucinnal stimulált puromicin festési intenzitást mind a IIa, mind a IIb típusú vázizomrostokban. A laminin, az N2.261 (MyHCIIa) és a puromycin (fehérjeszintézis) reprezentatív képei és a három kép egyesült (A), a rosttípus-specifikus puromicin festési intenzitás számszerűsítése (B) és a rosttípus% -át (C) glicinnel (GLY) és alaninnal (ALA; kontroll aminosav) kezelt egerekben 4 órával fiziológiás sóoldat (CON) vagy LPS (1 mg/kg) injekció beadása után, és 1 órával fiziológiás sóoldat (bazális) vagy leucin injekciója után . Jelentős különbségek (P
A fehérjeszintézis alacsonyabb relatív fehérje-szintjének tendenciája egyes (de nem az összes) fehérjeszintézis szabályozásában szerepet játszó szignálfehérjék alacsonyabb aktiválódásával járt (3. ábra). Az Akt-mTORC1 útvonalon alacsonyabb foszforilált és teljes Akt arányt figyeltünk meg (p-Akt/Akt, ALA: −52 ± 7%; GLY: 50 ± 7%, P
3. ábra.A glicin javítja a rapamicin (mTOR) 1. komplex aktivációjának leucinnal stimulált emlős célpontját. Az mTOR foszforilezett és az összes fehérje arányának számszerűsítéseA), S6 (B), eukarióta iniciációs faktor 4E-kötő fehérje 1 (4E-BP1; C), eukarióta megnyúlási faktor 2 (eEF2; D), Akt (E) és az ERK (F) és reprezentatív Western blot-ok (G) glicinben (GLY) - és alaninnal (ALA; kontroll aminosav) kezelt egerekben 4 órával fiziológiás sóoldat (CON) vagy LPS (1 mg/kg) injekció beadása után, és 1 órával bármelyik sóoldat (bazális) injekció után vagy leucin. Jelentős különbségek (P
0,5 g/kg leucin beadására válaszul fehérjeszintézis (35 ± 12%, P
4. ábra.A glicin helyreállítja az autofág jelzés leucin által kiváltott gátlását. mRNS expressziója Fbxo32 (atrogin-1; A), Trim63 (MurF1; B), és Bnip3 (D) és a fehérje expressziójának mennyiségi meghatározása a 3f eukarióta iniciációs faktor (eIF3f; C) és az LC3BII és az LC3BI aránya (E) és reprezentatív Western blot-ok (F) glicinben (GLY) - és alaninnal (ALA; kontroll aminosav) kezelt egerekben 4 órával fiziológiás sóoldat (CON) vagy LPS (1 mg/kg) injekció beadása után és 1 órával bármelyik sóoldat (bazális) injekció után vagy leucin. Jelentős különbségek (P
A glicin csökkenti az oxidatív stresszt, de a vázizomzat gyulladásos jelzését nem.
A CON-hez képest a DHE festés intenzitása szignifikánsan magasabb volt az LPS injekciót követően az ALA csoportban, a leucin beadásának nincs hatása (5. ábra, A és B). Ezzel szemben a DHE festés intenzitása alacsonyabb volt a GLY csoportban, mint mind a CON, mind az ALA csoportban, a leucin hatása nélkül. A 4HNE-jelölt fehérjék felhalmozódását 4 órával az LPS beadása után nem figyelték meg, és egyik csoportban sem volt különbség (5. ábraC). Érdekes módon a p38 MAPK foszforilációs státusza, amely az oxidatív stressz és a fehérje-anyagcsere károsodása közötti potenciális kapcsolat, markánsan magasabb volt (P
5. ábra.Az LPS elősegíti és a glicin csökkenti az oxidatív stresszt a vázizomzatban. A reaktív oxigénfajok markerének dihidroetídium-bromid festéséről reprezentatív képek (A) és a festés intenzitásának számszerűsítése (B), a 4HNE-jelölt fehérjék számszerűsítése (C), a foszforilezett és az összes 38 MAPK aránya (D) és reprezentatív Western blot-ok (E) glicinhez (GLY) - és alaninnal (ALA; kontroll aminosav) kezelt egerekhez 4 órával fiziológiás sóoldat (CON) vagy LPS (1 mg/kg) injekció beadása után, és 1 órával bármelyik sóoldat (bazális) injekció után vagy leucin. Jelentős különbségek (P
Az LPS beadása robusztusan megnövelte a mRNS expresszióját Il-6 (∼80-szoros), Tnfα (∼15-szeres), Socs3 (∼35-szeres), Ccl2 (~ 65-szeres), és Ccl5 (∼7-szeres) és a STAT3 (Tyr 705) foszforilációs állapota a quadriceps izomzatában (6. ábra, A – F). Volt azonban tendencia (P = 0,09) alacsonyabb IL-6 fehérjekoncentrációra a GLY csoportban, mint az ALA csoportban. A glicinnel kezelt egerek tompított DHE festési intenzitása ellenére a gyulladásos szignalizáció nem volt különbözõ az ALA és a GLY csoportok között bazális vagy leucinnal stimulált körülmények között. Hasonlóképpen, a glicin-kezelés nem változtatta meg az LPS-re adott gyulladásos választ a tenyésztett C2C12 vázizom myotubusokban (7. ábra, A – E). Váratlanul úgy tűnt, hogy a leucin beadása egerekben fokozza az LPS-re adott gyulladásos reakciót, és a Tnfα és Socs3 és a trend magasabbra Il-6 (P = 0,11) és Ccl2 (P = 0,06) mRNS. A változatlan gyulladásos válasz ellenére a glicin gyengítette a C2C12 miocső átmérőjének LPS-indukálta csökkenését, amikor a sejteket 24 órán át 1 μg/ml LPS-ben inkubálták (7. ábra, F és G).
6. ábra.A glicin nem csökkenti a vázizomzat gyulladásos válaszát az LPS-re. mRNS expressziója Il-6 (A), Tnfα (B), a 3. citokin szignál szuppresszora (Socs3; C), Ccl2 (D), és Ccl5 (E) glicinben (GLY) - és alaninnal (ALA) kezelt egerekben 4 órával fiziológiás sóoldat (CON) vagy LPS (1 mg/kg) injekció beadása után, és 1 órával fiziológiás sóoldat (bazális) vagy leucin injekciója és mennyiségi meghatározása után fehérje expressziójának IL-6 (G), SOCS3 (H), valamint a foszforilezett és az összes STAT3 arányát (F) és reprezentatív Western blot-ok (én). Az mRNS expresszióját cDNS tartalomra normalizáltuk. A kezelés vagy a leucin fő hatásait a bal felső az egyes grafikonok sarka adott esetben.
7. ábra.A glicin megőrzi a cső átmérőjét, de nem csökkenti a gyulladásos választ az LPS-re a C2C12 vázizomsejtekben. mRNS expressziója Il-6 (A), Tnfα (B), Socs3 (C), Ccl2 (D), és Ccl5 (E) 2,5 mM glicinnel (GLY) vagy alaninnal (ALA) kezelt, majd 1 μg/ml LPS-ben 0 (kontroll) vagy 1, 2 vagy 4 órán át inkubált érett, 5 napos myotube-okban (reprezentatív képek) (F) és számszerűsítés (G24 óra inkubálás után PBS-sel (CON), LPS-sel és alaninnal (LPS + ALA) vagy LPS-sel és glicinnel (LPS + GLY) kezelt differenciáló táptalajban. mRNS expresszióját normalizáltuk Gapdh kifejezés. Különböző betűk jelentenek jelentős különbséget a P b> c és bc nem különbözik b vagy c értéktől.
A nem esszenciális aminosav-glicin javította az mTORC1 jelátvitelt és hatékonyan helyreállította a fehérje szintetikus választ a leucinra az LPS-sel kezelt egerek vázizmaiban. A fehérje anyagcsere javulása a vázizom ROS csökkenésével járt, de nem változtatta meg a vázizom gyulladásos jelzését in vivo vagy in vitro. A glicin ígéretes táplálkozási beavatkozást jelent a csontvázizom-veszteség csillapításában.
A glicin javítja a leucinnal stimulált mTORC1 jelátvitelt és a fehérjeszintézist LPS-sel kezelt egerekben.
Az embereken (52) és a patkányokon (36–38) végzett korábbi megfigyelésekkel összhangban tendenciát (P Európai Klinikai Táplálkozási és Anyagcsere Társaság .
A szerzők nem jelentenek be pénzügyi vagy egyéb összeférhetetlenséget.
D.J.H. és R.K. a kutatás megtervezése és megtervezése; D.J.H., M.K.C., V.C., A.C., X.W. és R.K. elvégzett kísérletek; D.J.H. és M.K.C. elemzett adatok; D.J.H., M.K.C., C.G.P. és G.S.L. értelmezett kísérletek eredményei; D.J.H. elkészített figurák; D.J.H. megfogalmazott kézirat; D.J.H., C.G.P., G.S.L. és R.K. szerkesztett és átdolgozott kézirat; D.J.H., M.K.C., V.C., A.C., X.W., C.G.P., G.S.L. és R.K. a kézirat jóváhagyott végleges változata.
HIVATKOZÁSOK
SZERZŐ MEGJEGYZÉSEK
* D. J. Ham, M. K. Caldow és R. Koopman egyformán járultak hozzá ehhez a cikkhez.
- A magas zsírtartalmú étrend hatása a bél mikrobiomák dysbiosisára az Öböl-háborús betegség egérmodelljében
- Diéta és testmozgás a hiperlipidémia kezelésében - amerikai családorvos
- Az étrend és a testsúly befolyásolhatja a bipoláris rendellenesség kezelésére adott választ - ScienceDaily
- Lehet-e a kutyáknak zöldbabja; American Kennel Club
- Motiválás egy virtuális modell fogyás szimulátor használatával