A gasztrointesztinális gát
VIVO kórélettan
A gasztrointesztinális gát
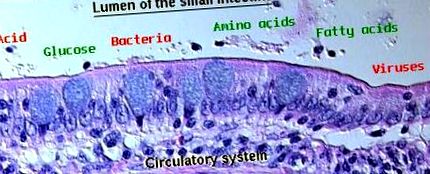
A gyomor-bélrendszer nyálkahártyája gátat képez a test és a lumenális környezet között, amely nemcsak tápanyagokat tartalmaz, hanem potenciálisan ellenséges mikroorganizmusokkal és méreganyagokkal terhelt. A kihívás az, hogy lehetővé tegyük a tápanyagok hatékony szállítását a hámban, szigorúan kizárva a káros molekulák és organizmusok állatba való bejutását. A gyomor és a bél nyálkahártyájának kizáró tulajdonságait "emésztőrendszeri gátnak" nevezik.
Nyilvánvaló, hogy számos primer gasztrointesztinális betegség a nyálkahártya gátjának megzavarásához vezet, lehetővé téve a szisztémás megbetegedéssé való fokozódást. Ugyanilyen egyértelmű, hogy számos szisztémás betegségfolyamat a gyomor-bél gátjának károsodását eredményezi, ezáltal további sértést adva a már veszélyeztetett rendszerhez. A gát természetének megértése segíthet az ilyen események előrejelzésében, és elősegítheti a megelőző vagy aktív terápiákat.
A gasztrointesztinális gátról gyakran két komponenst tárgyalnak:
-
A belső gát az emésztőrendszert bélelő hámsejtekből és az őket összekötő szoros csatlakozásokból áll.
A belső gasztrointesztinális gát
A tápcsatornát hámsejtek borítják, amelyek a nyálkahártya meghatározó struktúráját alkotják. Kevés kivételtől eltekintve a gyomor és a belek hámsejtjei kerületi összefüggésben vannak egymással szoros csatlakozásokkal, amelyek lezárják a paracelluláris tereket és ezáltal létrehozzák az emésztőrendszer alapvető gátját. Az egész emésztőrendszerben az ép hám fenntartása kritikus fontosságú a gát integritása szempontjából. Általában azok a toxinok és mikroorganizmusok, amelyek képesek megtörni az hámsejtek egy rétegét, akadálytalanul hozzáférnek a szisztémás keringéshez.
Amint az várható volt, a különféle hámsejtek sokfélesége van specifikus gátfunkciókban. Például a gyomor parietális és fõsejtjeinek apikális plazmamembránja atipikusan alacsony permeabilitással rendelkezik a protonok iránt, ami segít megelõzni a savnak a sejtekbe történõ diffúziójának miatti károsodást. A vékonybél hámsejtjeiben hiányzik ez a speciális képesség, ezért sokkal érzékenyebbek a sav által kiváltott károsodásokra.
A gyomor-bél traktus hámsejtjeit körülvevő szoros csomópontok a belső gát kritikus elemei. Ezeket a szerkezeteket korábban passzív szerkezeteknek tekintették, amelyek hasonlóak a hegesztésekhez, de a legújabb tanulmányok azt mutatják, hogy sokkal dinamikusabbak, mint korábban gondolták, és permeabilitását számos olyan tényező szabályozhatja, amelyek befolyásolják a hámsejteket.
A gyomor-bél hámját az őssejtek szaporodásából származó, funkcionálisan érett különféle sejtek népesítik be. Az érett hámsejtek többsége, beleértve a gyomor nyálkahártya-sejtjeit és a vékonybél abszorpciós sejtjeit, gyors forgalmi sebességet mutat, és kialakulása után néhány napon belül elpusztul. A hám integritásának fenntartása tehát pontos egyensúlyt igényel a sejtproliferáció és a sejthalál között.
Az őssejtek, amelyek támogatják a gyomor-bél hám folyamatos pótlását, a gyomor gödrének közepén, valamint a vékonybél és a vastagbél kriptáiban helyezkednek el. Különösen jól tanulmányozták a vékonybél hámsejt-dinamikáját. Ezek az őssejtek folyamatosan szaporodnak, hogy olyan sejteket biztosítsanak, amelyek abszorpciós enterocitákká, nyálkaszekréciós serlegsejtekké, enteroendokrin sejtekké és Paneth-sejtekké differenciálódnak. A kriptákban maradó Paneth-sejtek kivételével a többi sejt érett formájúvá válik, amikor a kriptákból felfelé vándorolva a villiák csúcsaiból extrudált sejteket helyettesítik. Ez a migráció körülbelül 3-6 napot vesz igénybe.
A külső gasztrointesztinális gát
Nyálka és bikarbonát
A teljes gyomor-bél hámot nyálka borítja, amelyet a hám részét képező sejtek szintetizálnak. A nyálka fontos szerepet játszik a hám nyírófeszültségeinek enyhítésében, és több szempontból is hozzájárul a gát működéséhez. A mucinmolekulákon található bőséges szénhidrátok kötődnek a baktériumokhoz, amelyek segítenek megakadályozni a hám kolonizációját, és az aggregációt előidézve gyorsítják a kiürülést. A hidrofil molekulák diffúziója a nyákban lényegesen alacsonyabb, mint a vizes oldatban, amelyről feltételezik, hogy késlelteti a károsító vegyületek, köztük a gyomorsav diffúzióját a hám felszínén.
A gyomor és a nyombél hámsejtjei azon kívül, hogy nyálka réteggel vannak bevonva, csúcsfelületükön hidrogén-karbonát ionokat választanak ki. Ez a semleges pH fenntartását szolgálja a hámplazma membránja mentén, annak ellenére, hogy a lumenben erősen savas körülmények vannak.
Hormonok és citokinek
A gyomor és a bél hámsejtjeinek normális szaporodását, valamint az ilyen sérülésekre, például fekélyre adott proliferációt számos endokrin és parakrin faktor befolyásolja. Az enterális hormonok közül több ismert, hogy fokozza a proliferáció sebességét. A hám különböző károsodási formái a sejtszaporodás fokozott vagy elnyomott sebességéhez vezethetnek. Például bebizonyosodott, hogy a kutya vékonybél egy részének reszekcióját hámsejtek hiperpláziája és megnövekedett villus hosszúság követi orálisan etetett állatoknál. A parenterálisan táplált állatok nem mutatták ugyanazt a kompenzációs hiperpláziát, ami azt jelzi, hogy egyéb tényezők mellett a helyi tápanyagok fontos szerepet játszanak a sejtdinamikában.
A prosztaglandinoknak, különösen a prosztaglandin E2-nek és a prosztaciklinnek régóta ismert, hogy "citoprotektív" hatása van a gyomor-bél hámjára. Sok emlősnél gyakori klinikai összefüggés az, hogy az aszpirin és más nem szteroid gyulladáscsökkentők (NSAID-ok) alkalmazása, amelyek gátolják a prosztaglandin szintézist, gyakran társulnak a gyomor erózióival és fekélyeivel. A kutyák különösen érzékenyek erre a mellékhatásra. A prosztaglandinok a nyálkahártyán belül szintetizálódnak az arachidonsavból, a ciklooxigenázok hatására. Citoprotektív hatásuk a nyálkahártya nyálka és a hidrogén-karbonát szekréciójának serkentésére, a nyálkahártya véráramlásának fokozására és különösen a gyomorban történő visszafejtésének korlátozására vezethető vissza. Jelentős erőfeszítések folynak olyan NSAID-ok kifejlesztésére, amelyek nem gátolják a nyálkahártya prosztaglandin szintézisét.
Két peptid, amelyek figyelemre méltóak voltak a gát fenntartásában játszott potenciális szerepük miatt, az epidermális növekedési faktor (EGF) és a transzformáló növekedési faktor-alfa (TGF-alfa). Az EGF a nyálban és a nyombélmirigyekből választódik ki, míg a TGF-alfát a gyomor hámsejtjei termelik. Mindkét peptid egy közös receptorhoz kötődik és stimulálja a hámsejtek szaporodását. A gyomorban szintén fokozzák a nyálka szekrécióját és gátolják a savtermelést. Kísérleti modellekben kimutatták, hogy más citokinek, például a fibroblaszt növekedési faktor és a hepatocita növekedési faktor fokozzák a gyomor-bélrendszeri fekélyek gyógyulását.
A trefoil fehérjék a kisméretű peptidek családja, amelyeket a serlegsejtek bőségesen választanak ki a gyomor és a bél nyálkahártyájából, és bevonják a hámsejtek apikális arcát. Megkülönböztető molekulaszerkezetük úgy tűnik, hogy ellenállóvá teszi őket a proteolitikus rombolással szemben. Számos tanulmány kimutatta, hogy a trefoil peptidek fontos szerepet játszanak a nyálkahártya integritásában, az elváltozások helyreállításában és a hámsejtek proliferációjának korlátozásában. Kimutatták, hogy megvédik a hámot a mérgező vegyi anyagok és gyógyszerek széles skálájától. Úgy tűnik, hogy a trefoil fehérjék központi szerepet játszanak a hámkárosodás helyreállításának restitúciós fázisában is, ahol a hámsejtek ellapulnak és a seb széléről vándorolva lefedik a denuded területeket. A trefoil gének célzott deléciójával rendelkező egerek eltúlzott reakciókat mutattak az enyhe kémiai sérülésekre és a késleltetett nyálkahártya gyógyulásra.
Egy másik molekula, amely döntő szerepet játszik a nyálkahártya integritásában és a gát funkciójában, a nitrogén-monoxid (NO). Paradox módon a NO számos emésztőrendszeri betegségben hozzájárul a nyálkahártya sérüléséhez is. Ezt a molekulát argininből szintetizálják a nitrogén-oxid-szintáz (NOS) három izoformájának egyikével. Az ezen a területen végzett kutatások nagy része az NO donorok, például a gliceriltrinitrát vagy a NOS inhibitorok alkalmazásának hatásainak megértésére összpontosított. Számos modellben az NO donorok jelentősen csökkentették a toxikus vegyi anyagok (pl. Etanol) által okozott, vagy iszkémiával és reperfúzióval társuló nyálkahártya-sérülések súlyosságát. Hasonlóképpen a patkányok gyomorfekélyeinek gyógyulását NO donorok alkalmazásával felgyorsították. Egy másik érdekes megfigyelés az, hogy a NO donorok és az NSAID-ok együttes beadása gyulladáscsökkentő tulajdonságokat eredményez, amelyek hasonlóak az önmagában alkalmazott NSAID-okhoz, de kevésbé károsítják a gyomor-bélrendszer nyálkahártyáját. A NOS-gátlókat olyan helyzetek kezelésében vizsgálják, amikor az NO túltermelődik, és hozzájárul a nyálkahártya sérüléséhez.
Antibiotikus peptidek és antitestek
A gátfunkció fontos része a baktériumok lumenből történő átjutásának megakadályozása a hámon keresztül. A Paneth sejtek számos emlős vékonybél kriptájában található hám granulociták. Számos antimikrobiális peptidet szintetizálnak és szekretálnak, amelyek közül az alfa-defenzinek főként kriptdinek (más néven kriptadefeninek) izoformái. Ezek a peptidek antimikrobiális aktivitással rendelkeznek számos potenciális kórokozóval szemben, beleértve számos baktérium nemzetséget, egyes élesztőket és Giardia trophozoitákat. Hatásmechanizmusuk valószínűleg hasonló a neutrofil alfa-defenzinekhez, amelyek permeabilizálják a célsejt membránjait.
A nem specifikus antimikrobiális molekulák mellett a gát funkciót a gyomor-bél rendszer immunrendszere támogatja. Ennek a védekező rendszernek az egyik aspektusa az, hogy a hám nagy részét szekréciós immunglobulin A-ban fürdik. Az antitestek ezen osztálya a subepithelialis plazma sejtekből választódik ki, és az epitheliumon keresztül transzcitózik a lumenbe. A Lumenal IgA antigén gátat biztosít a baktériumok és más antigének megkötésével. Ez a gát funkció bizonyos antigénekre specifikus, és a reakció kialakulásához előzetes expozíciót igényel.
Az akadály működésének megzavarása
Robusztus és sokoldalú jellege ellenére a gasztrointesztinális gát megszakadhat. A baktériumok és vírusok által okozott helyi fertőzések, a toxinoknak való kitettség vagy fizikai sértések, valamint a különféle szisztémás betegségek megzavarásához vezetnek. Az ilyen problémák enyheek és könnyen orvosolhatók, vagy súlyosak és végzetesek lehetnek.
Az alábbi mikrográfiák a gát súlyos megszakadását mutatják be. Bal oldalon a normál kutya vékonybélből származó nyálkahártya található, a nagy bolyhokat ép hám borítja a lumenbe. A jobb oldali képen (ugyanaz a nagyítás) a Salmonella enteritis miatt elhullott kutya vékonybél nyálkahártyája látható - vegye figyelembe a teljesen lebetegedett hámot és a villi pusztulását.
Ischaemia és reperfúziós sérülés
Az ischaemia és a reperfúziós sérülés következtében a gyomor-bél gátjának károsodása gyakori és súlyos állapot. Az iszkémia akkor fordul elő, ha a véráramlás nem elegendő ahhoz, hogy a sejtek integritásának fenntartásához szükséges mennyiségű oxigént és tápanyagot juttassa el. A reperfúziós sérülés akkor fordul elő, amikor a véráramlás helyreáll az iszkémiás szövetekben.
A gasztrointesztinális ischaemia két alapvető rendellenesség-típusból származik, amelyek mindkettő veszélyeztetheti a hámgátat:
- Nem okkluzív ischaemia szisztémás állapotok, például keringési sokk, szepszis vagy szívelégtelenség következményei.
- Okluzív ischaemia olyan állapotokra utal, amelyek közvetlenül megzavarják a gyomor-bél véráramlását, mint például fojtás, volvulus vagy tromboembólia.
A gyomor-bélfal reperfúziós sérülése, elsősorban a nyálkahártya, elsősorban reaktív oxigénfajok, köztük szuperoxid, hidrogén-peroxid és hidroxil gyökök keletkezésének tudható be. Ezek az oxidánsok a nyálkahártyán belül és az iszkémia során aktiválódó számos helyi leukocitában keletkeznek.
A reperfúzió során keletkező oxigén eredetű szabad gyökök olyan eseménysorozatot indítanak el, amely nyálkahártya károsodást és a gát megszakadását okozza. Közvetlenül károsítják a sejtmembránokat lipid-peroxidok képződésével, ami számos foszfolipidből származó gyulladásos mediátor termeléséhez is vezet (pl. Trombocita-aktiváló faktor és leukotriének). Ezek a gyulladáscsökkentő szerek a neutrofilek kemoattraktánjaiként működnek, amelyek a nyálkahártyába vándorolva felszabadítják saját reaktív oxigén-metabolitjaikat, és további károsodásokat okoznak a belső hámgátban. Az ischaemia eredetileg csekély hatása így felerősödik a gátfunkció nagyon jelentős károsodásában. Ezenkívül a gyomor-bél traktusban keletkező gyulladásos mediátorok károsíthatják a távoli szöveteket, ami szisztémás betegséghez vezethet.
Az ischaemia-reperfúziós sérülés megfigyelt hatásai a megnövekedett érpermeabilitástól és az ebből következő szubepiteliális ödémától kezdve a hámsejtek és bolyhok hatalmas veszteségéig terjednek. Még a hám viszonylag enyhe károsodása is megzavarja a gátfunkciót, és a baktériumok és toxinok transzlokációjához vezethet a lumenből a szisztémás keringésbe. Számos kezelést fejlesztenek és tesztelnek a károsodás ezen lépcsőjének megelőzésére, ideértve az antioxidánsok, például a szuperoxid-diszmutáz alkalmazását és a gyulladásos mediátorok hatásának blokkolásához olyan gyógyszerek, mint például a vérlemezke-aktiváló faktor antagonisták alkalmazását.
Neutrofilek és nyálkahártya sérülések
A bélnyálkahártya sokfélesége, beleértve a fertőző folyamatokat, az iszkémiát és a káros vegyszereket, elősegíti a neutrofilek behatolását. Ez a közös végpont azt eredményezi, hogy a sérülések sok típusa a neutrofil kemoattraktánsok, például a leukotriének, az interleukinek és az aktivált komplementkomponensek helyi termeléséhez vezet. A kemoattraktánsokra reagálva a neutrofilek kivándorolnak a kapillárisokból, beszivárognak a szubepiteliális nyálkahártyába, és gyakran vándorolnak át a gyomor vagy a bél hámjában. A hám átkelésénél a neutrofileknek meg kell szakítaniuk a hámsejtek közötti csatlakozási komplexeket. Ez a szűk kereszteződéseken keresztüli "bejáratás" szükségszerűen átmeneti növekedést okoz a permeabilitásban. Ha a sértés kisebb, a csomópontok gyorsan visszazáródnak, de nagyszámú neutrofil transzmigrációja jelentős károsodást okoz a gát működésében.
A stressz hatásai
A stressz számtalan formában jelentkezik, és szerves része minden betegségnek és traumának. A stresszválasz szó szerint hormonok és citokinek tucatjainak modulációját, valamint a neurotranszmisszióra gyakorolt jelentős hatásokat foglalja magában. A stressz elsődleges hatása a gyomor-bél traktusra azonban a nyálkahártya véráramlásának csökkentése és ezáltal a nyálkahártya gát integritásának veszélyeztetése. Többek között a csökkent nyálkahártya véráramlás elnyomja a nyálka képződését és korlátozza a hátsó diffúziós protonok eltávolításának képességét. Ennek eredményeként a jelentős stressz szinte mindig a nyálkahártya eróziójával jár, különösen a gyomorban. Ezen elváltozások többsége szubklinikai jellegű, de a gyomor-bélrendszeri vérzés és a szepszis nem ritka következmény.
A cukorbetegség és az elhízás jól ismert rizikófaktor a GI-gát diszfunkciójában, és az ezekhez a rendellenességekhez kapcsolódó elhúzódó hiperglikémia lehet az elsődleges mechanizmus az ilyen zavarokhoz.
Helyreállítás és sérülés utáni gyógyulás
A gasztrointesztinális epithelium megszakadását követően a kritikus első feladat a denuded terület lefedése és a belső gát helyreállítása. A hám ezen gyors helyreállítását az úgynevezett restitúcióval hajtják végre - a hibával szomszédos hámsejtek ellaposodnak és vándorolnak a szabadon lévő bazális membrán felett. A vékonybélben ezt a folyamatot segíti az érintett villiák gyors összehúzódása és megrövidülése, ami csökkenti az alapmembrán területét, amelyet el kell fedni.
A helyreállítás gyors mechanizmust biztosít a gát hibájának fedezésére, és nem jár a hámsejtek szaporodásával. Olyan területet eredményez, amely védett, de fiziológiailag nem funkcionális. A gyógyulás megköveteli, hogy a hiba peremén lévő hámsejtek szaporodjanak, differenciálódjanak és a sérült területre vándoroljanak, hogy helyreállítsák a normál sejtszerkezetet és működést.
A helyreállítást számos, főleg parakrin szabályozó stimulálja. A helyi prosztaglandinok és a leveles fehérjék egyértelműen részt vesznek ebben a folyamatban, és termelésük elnyomása jelentősen késlelteti a helyreállítást. A restitúcióban részt vevő molekulák másik csoportja a poliaminok, például a spermin, a spermidin és a putrescin. Ezek a molekulák számos étrendben vannak jelen, és a gyomor-bélrendszer nyálkahártyája szintetizálja őket. Kísérleti modellekben kimutatták, hogy a poliaminok enterális beadása felgyorsítja a nyálkahártya elváltozásainak helyreállítását és gyógyulását.
Hivatkozások és áttekintések
Gyomor: Bevezetés és index
Gyomor: Bevezetés és index
Frissítve 2018. május. Küldje meg észrevételeit [email protected] címre
Az oldal cseh fordítását Maxwell Edward készítette, és elérhető a cseh fordításban
Az oldal francia fordítását Erin Melissa készítette, és elérhető a francia fordításban
Ennek az oldalnak a görög fordítását az Utalványfa készítette, és elérhető a görög fordításban
Az oldal hindi fordítását Nikol Barton készítette, és hindi fordításban érhető el
Ennek az oldalnak a pandzsábi fordítását a Bydiscountcodes Team készítette, és a pandzsábi fordításban érhető el
Ennek az oldalnak a román nyelvű fordítását Sarah Richards, az Essay Writing Service készítette, és román fordításban érhető el
Az oldal ukrán fordítását Sergey Cosbuk, a PickWriters készítette, és elérhető az ukrán fordításban
Az oldal urdu fordítását Ahsan Soomro készítette, és az urdu fordításban érhető el
- Fekélyes vastagbélgyulladás gyomor-bélrendszer Andrew Weil, M
- Gyomor-bélrendszeri rendellenességek gyógyászati ételeinek feltörekvő terápiás szerepe - PubMed
- Frissítés a gyomor-bél rendellenességeinek kezeléséről
- A hígított nátrium - hipoklorit oldat és hidratálók hatása a bőrkorlát működésére
- Mi az a gyomor-bélrendszeri karcinoid tumor