Hámgát biológia: a jó kerítések jó szomszédokat alkotnak
A limfocita jelzés és fejlesztés laboratóriuma, Babraham Intézet, Cambridge, Egyesült Királyság
A limfocita jelzés és fejlesztés laboratóriuma, Babraham Intézet, Cambridge, Egyesült Királyság
A limfocita jelzés és fejlesztés laboratóriuma, Babraham Intézet, Cambridge, Egyesült Királyság
A limfocita jelzés és fejlesztés laboratóriuma, Babraham Intézet, Cambridge, Egyesült Királyság
Összegzés
A test külső felületei, például a bőr és a gyomor-bél traktus nyálkahártyája, fontos védelmi vonalat jelentenek, amely megakadályozza a mikroorganizmusok és termékeik invázióját. A nyálkahártya immunsejtjei, különösen az intraepitheliális limfociták, részt vesznek ezen hámgátak integritásának fenntartásában. Hozzájárulnak az ugyanazt a helyet elfoglaló kommenzális organizmusok toleranciájához, valamint a káros organizmusok és termékeik elleni immunválaszhoz. A mikrobiota összetételét az immunsejtek, valamint a külső környezeti tényezők, különösen az antibiotikumok és az étrend befolyásolják. Egyre inkább felismerik, hogy a mikrobiota a helyi immunitás mellett befolyásolja a szisztémás immunválaszokat. Ha a mikroorganizmusok nem tudják leküzdeni a foglaltságot, az a hasznos és káros mikroorganizmusok közötti finom homeosztázis megszakadásához vezethet, és hozzájárulhat a gyulladásos patológiák kialakulásához. Ez az áttekintés az immunsejtek és az étrend mikrobiotára gyakorolt hatásának jelenlegi megértését tárgyalja.
Bevezetés
Úgy tűnik, hogy a házigazda és szimbiontusai együtt fejlődtek a kölcsönösen előnyös együttélési állapot felé. Keresztbeszédük megkönnyíti a gazda emésztési és anabolikus funkcióit, és megvédi a hámgátakat a kórokozók általi kolonizációtól. 7 A mikrobák versenyeznek a tápanyagokért és a hámsejtekhez való kötődési helyekért. Egyesek akár vegyi harcokban is részt vehetnek, és baktériumokat termelhetnek, vagy antimikrobiális anyagokat indukálhatnak, közvetlenül megölve a versenytársakat. A mikrobiota összetételének megváltozása, a dysbiosis hozzájárulhat a különböző gyulladásos rendellenességek kialakulásához. Az immunválasz szoros kezelése ezért kritikus fontosságú a gazda funkciója és a túlélés szempontjából, fenntartva az optimális egyensúlyt az ártalmatlan vegyületek, valamint a kommenzális flóra toleranciája között, miközben hatékonyan kitisztítja a kórokozókat és azok toxinjait. 8.
A nyálkahártya felületek szerkezeti szervezete
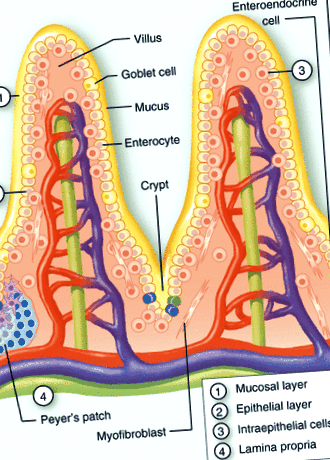
A nyálkahártya immunrendszere felosztható induktív és effektor helyekre. Az induktív helyeket szervezett nyálkahártyával társult limfoid szövet, valamint nyálkahártyát ürítő nyirokcsomók alkotják, míg az effektor helyeket a lamina propria, az exokrin mirigyek stromája és a felszíni hám képezi. 9, 10 A luminalis mikrobaközösség és a bélfelület közötti érintkezés korlátozása tekinthető az első védelmi vonalnak (1. ábra). A nyálkahártya-réteget képező glikoproteinek, az immunglobulinok (IgA) gradiensei és az antimikrobiális peptidek megakadályozzák a legtöbb baktérium behatolását. Bár az antimikrobiális peptidek mikrobicid hatását gyakran enyhenek tartják, a kriptákban a koncentrációk elérhetik az erős baktériumok líziséhez elegendő szintet. 11.
A bél nyálkahártyájának szerkezeti szervezete. A vékonybél nyálkahártya-gátlójának sematikus ábrázolása, amely egy nyálkahártyarétegből (1), valamint az IgA és antimikrobiális faktorok gradienséből, az epithelsejtekből (2) enterocitákból, Paneth sejtekből, serlegsejtekből és enteroendokrin sejtekből, intraepithelialis limfocitákból áll (3) és a lamina propria (4). További másodlagos limfoid struktúrák, például kriptopatchok és Peyers-foltok vannak a lamina propriában.
Az intraepithelialis limfoid sejtek
Az emlős felszíni bélésének hámrétege egy speciális limfoid populációt, az intraepithelialis limfocitákat (IEL) tartalmaz, amelyek közvetlenül részt vesznek a gazda védekezésében, valamint a gát fenntartásában; a harmadik védelmi vonalat képezi (1. ábra). Az IEL-ek a test összes felületét benépesítik. Ezek az egyik legnagyobb limfocita populációt képviselik az emlősökben, ugyanakkor a legkevésbé érthetők, és főleg nem konvencionális T-sejtekből álló heterogén populáció. Az IEL-ek sok tulajdonsággal rendelkezhetnek a hagyományos T-sejtekkel, amelyek expresszálják a TC-α és TCR-β láncokból álló T-sejt-receptort (TCR), de léteznek döntő különbségek. A hagyományos T-sejtekkel ellentétben az IEL-ek korlátozott sokféleséggel expresszálják az antigénreceptorokat, 24 és fokozott aktiválási állapotban tartják őket, elkerülve a teljes aktiválás és felesleges késleltetés előtti alapozó lépést. 25 Ezenkívül reagálhatnak anélkül, hogy szükség lenne egy ritka prekurzor sejt klonális terjeszkedésére, amely egy adott TCR-t expresszál, amely felismeri a kívánt antigént. Aktiválás után az IEL-ek azonnal felszabadítják a citokineket, amelyek hozzájárulnak a veleszületett immunsejtek aktiválásához és toborzásához, és amelyek hozzájárulhatnak egy későbbi adaptív immunválasz hangszereléséhez.
Az alternatív TCR-t expresszáló limfociták, amelyek a TCR-γ és TCR-5 láncokból állnak, a gerincesek viszonylag kicsi populációja, de minden hám helyén erősen dúsítottak. Az epidermiszben a TCR-γδ T-sejtek a limfociták egyedüli populációja, míg a légzőszervi és béltraktusokban együtt élnek a TCR-αβ T-sejtekkel. A vékonybél IEL-ek a TCR-γδ T-sejteken kívül nem konvencionális jellegű TCR-αβ T-sejteket tartalmaznak, amelyek CD8αα homodimer receptorokat expresszálnak, vagy sem CD4, sem CD8. Érdekes módon a TCR-γδ T-sejtek szöveti eloszlása az egérben a TCR-y-láncuk expressziójának felel meg. A bélben az egér TCR-γδ T-sejtjeinek klonális repertoárja a TCR-Vγ5-re korlátozódik, Vδ4-gyel vagy Vδ6-tal párosítva. Az epidermális TCR ‐ γδ populáció kizárólag a TCR ‐ Vγ3-ra korlátozódik, a TCR ‐ Vδ1-gyel párosulva, és nagyon korlátozott, ha van ilyen, változékonyság. A TCR ‐ Vγ3 IEL ekvivalense az emberben nincs jelen, mivel nincs tímiás stroma immunglobulin-szerű determináns skint1. 28 A TCR ‐ Vγ4 látszólag szélesebb eloszlású, elfoglalja a tüdő, a női reproduktív szervek és a nyelv hámrétegeit.
A jó és a rossz megkülönböztetése?
Az EC-k és a mikrobák közötti kölcsönhatás általában nem eredményezi a gyulladásos válaszok megindulását, ehelyett az ilyen, egyelőre még nem azonosított jellegű kölcsönhatások rendkívül előnyösek. A mikrobiális kolonizáció kiemelkedő fontosságú a bél mikrovaszkulatúrájának kialakulásában és számtalan gén expressziójának kiváltásában, amelyek szerepet játszanak az anyagcserében, az immunválaszban és a bélgát integritásában. 29, 30 A teljes EC-bélés egy héten belüli visszafejlődése a bél őssejtjeinek szaporodásától függ, 31 és mikrobák hiányában a fele a normális sebességnek. A csökkent proliferáció eredménye fokozott érzékenység a hámsejtek károsodására. Azonban azt a korlátozott megértésünket, hogy a mikrobiota hogyan befolyásolja hámgátjainkat, kiemelik azok a megfigyelések, miszerint a károsodásra való hajlamot negatívan befolyásolja mind a mikrobiális komponensek hiánya, mind jelenléte. 15., 33., 34. Ez a mikroorganizmusoknak az immunrendszer (strukturális) kifejlődéséhez és feltöltéséhez szükséges követelményére vonatkozik, amelynek hiánya a válasz kialakításának képtelenségét eredményezheti, míg más mikroorganizmusok sajátos jelenléte negatívan hozzájárul az immunopatológiához 35 (2. ábra).
A bél mikrobiális összetételét és a gát homeosztázisát befolyásoló hatások. A gazda genetikája, a véletlenszerű találkozások, a stressz és az öregedési hatások mellett az étrendnek nagy hatása van a bél mikrobiális összetételére. Különösen a rosttartalomnak és anyagcseretermékeiknek, például a rövid láncú zsírsavaknak (SCFA), az acetátnak, a propanoátnak és a butirátoknak van nagy hatásuk a gazda és a mikrobiota kölcsönösen előnyös kapcsolatára (szimbiózisára). Ezenkívül mikrobiális tényezők, mint például a poliszacharid A (PSA) és a peptidoglikánok (PTGN), közvetlenül hozzájárulnak ehhez a kapcsolathoz. A mikrobiális összetétel megváltozása, a dysbiosis epiteliális gát károsodást és stresszt okozhat a védő mikrobiális tényezők csökkenésének és a patogén mikroorganizmusok növekedésének eredményeként.
Az akadály fenntartása
A hagyományos T-limfocitákkal ellentétben az IEL-ek születés előtt népesítik be az epitheliális gát helyeit. 24 A születéskor és röviddel azután az emlősök mikroorganizmusoknak vannak kitéve és megszerzik mikrobiotájukat. A luminalis mikroorganizmusok ezt követően befolyásolják az IEL-ek fejlődését és működését. A csíra nélküli tenyésztett egerekben kevesebb IEL található, és a TCR-γδ-t hordozó IEL-ek mikrobák hiányában csökkent citolitikus kapacitást mutatnak. 56, 57 Számos laboratórium tanulmányai azt mutatják, hogy az IEL-ek egyedülálló szerepet játszanak az EC homeosztázisának fenntartásában, valamint a szövetek helyreállítására és rosszindulatú daganatokra adott válaszokban. Az IEL-ek, az epitheliális gát és a mikrobiota összefonódó kapcsolatát tovább szemlélteti az IEL-ek képessége a mikrobiota mellett az EC növekedésének és forgalmának támogatására. 58, 59 Ez azt sugallja, hogy az IEL-ek a citokinek, kemokinek és növekedési faktorok termelésén keresztül fontosak a hámgátak fenntartásában, és közvetetten befolyásolhatják a bél mikrobiális közösségeit (3. ábra).
A „kerítés” fenntartása. A hámgát egészségének kiegyensúlyozása az epithelsejtek és a luminalis mikroorganizmusok, valamint az immunrendszer sejtjeinek, különösen az intraepithelialis limfocitáknak (IEL), amelyeket étrendből származó aril-szénhidrogén-receptor (AhR) ligandumok, például indol-3-karbinol, tartanak fenn (I3C). Az IEL-ek a növekedési faktorok felszabadulásával és az antimikrobiális peptidek aktiválásának támogatásával fenntartják az epitheliális gátat. A gát áttörése után az IEL-ek közvetlenül részt vesznek a citolitikus immunválaszban, eltávolítják a fertőzött sejteket, és összehangolják a későbbi adaptív immunitást, valamint a gát helyreállítási válaszát.
Diétás poliszacharidok
A nem és az életkor mellett az étrendnek nagy hatása van a bél mikrobiota összetételére. 67-69 Cserébe a mikrobiális összetétel és metabolitjaik megváltozása néha váratlan hatással lehet a gazda helyi és szisztémás immunitására, amit csak nemrégiben ismertek fel. 45, 70-73, mint ilyen, az étrend jelentősen hozzájárulhat a gyulladásos betegségek, például az asztma, a sclerosis multiplex, az 1-es típusú cukorbetegség és a Crohn-betegség drámai növekedéséhez, amelyet az elmúlt 50 évben regisztráltak. 74, 75 Ilyen összefüggést már kialakítottak az elhízás és a cukorbetegség, a 76 elhízás és az asztma, a 77 étrend és az asztma, a 78 és az alacsony gyümölcs- és zöldségtartalmú étrend és gyulladásos bélbetegség (IBD) közötti összefüggés ingadozó epidemiológiai adataival. 79-81 Ha az étrend olyan jelentős mértékben hozzájárul a bélsorompó integritásához, valamint az allergiák és az autoimmun rendellenességek gyors növekedéséhez a fejlett világban, ez azt jósolja, hogy a mikrobiota összetétele jelentősen eltér Európában és Afrika vidékén. Az afrikai gyerekek valóban sokkal magasabb rosttartalmú étrendet fogyasztanak, és mikrobiotájuk speciális szimbiotikumokkal gazdagodik Bacteriodetes fajok és csökkent Firmicutes összehasonlítva az európai gyerekekkel. 67
A bél mikrobiota nagyrészt az anyától származik a szülés során, de ezt követően az étrend és a környezeti véletlen találkozások, például fertőzések és antibiotikumok alkalmazása módosítja. A kezdeti bevitel kizárólag tej, amely az emlőmirigyben laktózágakat tartalmazó módosított poliszacharidok sokféleségéből áll. Különösen fontosak a laktóz és a sziálsav kombinációi. Mint említettük, a bélhám glükánjainak fukozilezése bizonyos baktériumok bakteriális kolonizációját ösztönzi. 12 A tejoligoszacharidok, amelyeket a gazdaszervezet nem képes felszívni vagy megemészteni, és szerkezetükben hasonlóak az EC-glikánokhoz, neutralizáló ligandumokként hatnak, megakadályozva egyes baktériumok kapcsolódását a kívánt szimbiotikum felett Bifidobaktériumok faj. A szialilezett oligoszacharidok hiányában tenyésztett egerek mikrobiotájának összetétele megváltozott, ami hatással van a hámgát fenntartásának képességére. 82
Jelentős mikrobiális változás történik, ha szilárd anyagot visznek be, és a növényi rostok formájában lévő poliszacharidok és metabolitjaik, rövid láncú zsírsavak, acetát, butirát és propanoát pozitívan befolyásolják a bél mikrobiális felépítését (2. ábra ). A rövid láncú zsírsavak receptorai a G fehérjéhez kapcsolt receptorok, például a GPR41 és a GPR43, amelyek közül az utóbbiak a veleszületett immunrendszer sejtjein expresszálódnak. Meglepő módon a GPR43 hiánya súlyosbodott és rosszul oldódó immunválaszt eredményez, 72 hasonló ahhoz, mint a csíra mentes egereknél, amelyek kevés rövid szénláncú zsírsavat tartalmaznak. 35, 72, 83. Megjegyzendő az a megfigyelés, hogy a rövid láncú zsírsavak szintje általában alacsonyabb az IBD-ben szenvedő betegeknél. 81.
Diétás vitaminok és fitokémiai anyagok
A mikrobiota és az étrend nélkülözhetetlen szubsztrátja a fontos vitaminok, különösen a kobalamin (B12-vitamin) bioszintézisének és anyagcseréjének, amelyek szerkezetileg bonyolultak és jelenleg még csak bakteriális fermentációs szintézis útján termelődnek, valamint a leveles zöldségfélékben szintetizált K-vitamin, mint filokinon, amely bélbaktériumokat igényel a K-vitamin több formájává történő átalakuláshoz és azok felszívódásához. A közelmúltban két további vitamint, a D- és az A-vitamint közvetlenül érintenek a bélsorompó integritásának fenntartásában. Az első és annak receptora (VDR) fontosnak tűnik az egyik bél IEL-populáció, a TCR-αβ + CD8αα + kialakulásához, a TCR ‐ γδ IEL-ek befolyásolása nélkül. 84 A VDR vagy a D-vitamin hiánya fokozza a gyomor-bél traktus gyulladását, ami ennek a vitaminnak sokrétű igénye lehet. A TCR-αβ CD8αα IEL-ek csökkenése csökkentheti a gát homeosztázisát és a citolitikus aktivitást, de a TCR-γδ IEL-ek képesek lennének kompenzálni. A D-vitamin azonban szükséges a mikrobicid katelicidinek előállításához is, 85 amelyek hiánya a bél mikrobiális terhelésének vagy összetételének megváltozásához is hozzájárulhat.
Az A-vitamin metabolikusan aktív származékai közé tartozik a retinsav, amely a nukleáris hormon receptoraihoz kötődve indukálhatja a gének transzkripcióját. Az első jelentések szerint a retinsav szerepet játszik a kiegyensúlyozott bél TCR-αβ + CD4 + T segítő (Th) sejtrekesz fenntartásában, növeli a gyulladásgátló szabályozó T-sejteket, miközben gátolja a pro-gyulladásos Th17 sejteket. 86-90 Bár ez azt sugallta, hogy az A-vitamin fogyasztása gyulladáscsökkentő, két közelmúltbeli tanulmány vitatta ezt. 91, 92 A retinsav fontosnak tűnik az általános Th-közvetített válaszok szempontjából, hiányában az egerek nem képesek robusztus Th1 és Th17 választ adni. A hely és a kontextus szintén kulcsfontosságú lehet az A-vitamin hatásában. Az A-vitamin koncentrációja a felszívódási pontjukon, a bélnyálkahártyán lehet a legmagasabb, amelynek biológiai hatása eltérő lehet. Ennél is fontosabb, hogy a mikroorganizmusokkal társult molekuláris mintázatok kontextust adhatnak az A-vitamin szignáljának. 94 Érdekes módon úgy tűnik, hogy az IL-15, amely az IEL-ek elengedhetetlen túlélési tényezője, és a retinsav jelenléte különösen kedvező feltételeket teremt a Th1 és Th17 fejlődéséhez, amely mechanisztikus betekintést nyújt a lisztérzékenység okába. 91.
A bél homeosztázisát befolyásoló élelmiszerek szorosan kapcsolódnak az étrendi növényi komponenshez, vitaminokat és rostokat egyaránt biztosítva. Legfrissebb adataink egy újabb növényi eredetű fitokémiai anyagot emelnek ki, amely meglepő és drámai hatást gyakorol a gát immunitására. Az indol-3-karbinolt a triptofánból származó fotoszintézis során keletkező glükozinolát-glükobrassicin lebontásával állítják elő. Magas mennyiségben van jelen a bazilika növényekben, és az étrend részét képezi a keresztesvirágú zöldségek, például káposzta és brokkoli révén. A gyomorsavak az indol-3-karbinolt kondenzálják diindolil-metánné és indolokarbazollá, amelyek az aril-szénhidrogén-receptor (AhR) két nagy affinitású liganduma. Érdekes módon az összes IEL viszonylag magas AhR-szintet expresszál, és aktiválódásához sejt autonóm követelménye van, amely nélkül nem képesek túlélni a célszövetekben. 71 Noha a Th17 és a szisztémás TCR ‐ γδ kimutatja az AhR, 95, 96 hiányát, csak a bél TCR ‐ γδ és TCR ‐ αβ CD8αα IEL-ek és TCR ‐ Vγ3 epidermális IEL-ek szelektív eltűnését eredményezi, és az egerek alacsony tápértékű zöldséggel táplálkoznak a tartalom elveszíti a bél IEL-jének többségét. 71.
A beszámolók szerint az intraepithelialis limfociták antimikrobiális peptideket szabadítanak fel az epithelium sérülése esetén, kölcsönhatásba lépnek az epithelialis réteg sejttípusaival, és ezáltal közvetlenül korlátozhatják a bél mikroorganizmusainak transzlokációját és disszeminációját a gát károsodásakor. 97 Érdekes, hogy az AhR-hiányos vagy alacsony növényi anyagú étrendben lévő egereknél megnövekedett CD4-közvetített interferon-γ-termelés, EC-hiperplázia, csökkent epitheliális forgalom, apikális citoplazmatikus mucin-disztenzió, csökkent antimikrobiális peptidek expressziója és megnövekedett baktériumterhelés a fajok fokozottabb hozzájárulásával a törzsben Bacteroidetes. 71 Ezek a megfigyelések mind az IBD, 98, 99 jellemzői, és összhangban vannak azzal az előfeltevéssel, hogy az IBD genetikailag fogékony gazdaszervezetekben alakul ki, de a környezeti tényezők előidézik a betegség kialakulását vagy reaktivációját és súlyosságát.
Következtetések és perspektívák
A gazda ugyanezekkel a baktériumokkal való keresztbeszélgetés útján ellenőrzi az EC reakcióképességét a baktériumok elfogadására, ezáltal korlátozva a gyulladást a hámgát helyén. Ez nagyrészt felelős az immun tolerancia állapotáért, amely fokozza és ápolja a gazda és annak mikrobiális lakói közötti kölcsönösen előnyös kölcsönhatásokat, hacsak nem törik meg az akadályokat és nem okoz károsodást. Ennek a keresztbeszédnek a megszüntetése az EC homeosztázisának elvesztésével és az ezeket a felületeket elfoglaló, egymástól függő mikrobiális fajok bonyolult hálózatának megzavarásával jár. Az eredmény a pro-gyulladásos útvonalak aktiválása, az egyensúlyhiány terjedésének lehetőségével, és ha nem oldódik meg, végül krónikus gyulladást és immunopatológiát eredményez.
Köszönetnyilvánítás
A szerzők szeretnék elismerni a BBSRC (M.V.) és a Wiener-Anspach Fondation (E.M.) finanszírozását.
Közzétételek
A szerzőknek nincsenek ellentmondó pénzügyi érdekeik.
- A ketogén étrend hatékonysága Mely epilepsziák reagálnak Thammongkol - 2012 - Epilepszia - Wiley
- Diéta és táplálkozás 3 olyan étel, amely teltebbnek érzi magát, jó lehetőségek az alternatív napon történő étlapra
- Egyél helyesen, harapás harapással Hogyan lehet a jó táplálkozás bevált
- Annyira jó ételírás, hogy megkóstolhatja Dianne Jacob
- Celeb trendje; IV vitaminok; Nem jó ötlet Rihanna Live Science