Helicobacter pylori invazív, és fakultatív intracelluláris organizmus lehet
Gasztrointesztinális és májvizsgálatok laboratóriuma, Orvostudományi Intézet, USUHS, Bethesda, MD 20814-4499, USA.
* E-mail: [email protected]; Tel. (+1) 301 295 3607; Fax (+1) 301 295 3676 vagy (+1) 301 295 3557. Keresse meg a szerző további cikkeit
Orvosi Biokémiai és Biofizikai Tanszék, Umeåi Egyetem, SE ‐ 901 87 Umeå, Svédország.
Gasztrointesztinális és májvizsgálatok laboratóriuma, Orvostudományi Intézet, USUHS, Bethesda, MD 20814-4499, USA.
* E-mail: [email protected]; Tel. (+1) 301 295 3607; Fax (+1) 301 295 3676 vagy (+1) 301 295 3557. Keresse meg a szerző további cikkeit
Orvosi Biokémiai és Biofizikai Tanszék, Umeåi Egyetem, SE ‐ 901 87 Umeå, Svédország.
Összegzés
A gyomor-bél traktusban kolonizáló baktériumok patogenitása gyakran attól függ, hogy képesek-e hozzáférni a normálisan nem fagocita sejtekhez. Helicobacter pylori gyarmatosítja a világ népességének több mint felét, és ez a fő oka a gyomorfekélynek és a gyomorráknak. Általában nem invazív kórokozónak tekintik, amely csak a gyomor lumenében van jelen és a gyomor hámsejtjeihez kapcsolódik, bár számos in vivo és in vitro tanulmányok bebizonyították H. pylori valójában invazív. Továbbá, H. pylori újratelepítheti az extracelluláris környezetet, miután az extracelluláris baktériumokat gentamicinnel teljesen megszüntette, ami arra utal, hogy fakultatív intracelluláris baktériumnak tekinthető. Ez az áttekintés megvizsgálja ezen megfigyelések érvényességét és leírja azokat a bizonyítékokat, amelyek arra utalnak, hogy a H. pylori szerepet játszik a betegségek kiváltásában, az immunmegkerülésben és az ember többségének gyomrában a baktérium egész életen át tartó megmaradásában.
Bevezetés
A gyomor lumenjét már régóta steril környezetnek tekintik, bár ma már kiderült, hogy a gyomorban sok baktérium jelenléte detektálható. A 20. század eleje óta számos szerző megfigyelte a spirális organizmusok jelenlétét a gyomorban, és felvetette, hogy ezek a baktériumok gyomor betegségeket okoznak. Megfigyeléseiket többnyire figyelmen kívül hagyták 1985-ig, amikor Warren és Marshall ezt meggyőzően bizonyították Helicobacter pylori gastritist okoz (Marshall et al., 1985a), egy felfedezés, amelyért 2005-ben fiziológiai vagy orvosi Nobel-díjat kaptak. Ezen felül a jelenléte H. pylori szorosan kapcsolódik a peptikus fekélybetegséghez (Marshall et al., 1985b; Anonymous, 1994a) és gyomorrák (Anonymous, 1994b). Ma ezt tudjuk H. pylori a népesség több mint felének gyomrát gyarmatosítja és következetesen krónikus aktív gyomorhuruthoz kapcsolódik, bár a H. pylori pozitív alanyok gyomorbetegségeket tapasztalnak, és egyes betegeknél gyomorfekély vagy gyomorrák fordul elő H. pylori negatív.
Ez a látszólagos paradoxon azt sugallja, hogy a H. pylori a gyomorban való jelenlét nem elegendő a gyomorbetegség kialakulásához, és egy vagy több további feltételnek teljesülnie kell. Például, H. pylori specifikus virulencia géneket kell hordoznia (pl cag patogenitási sziget és a vacA és babA gének) (Peek és Blaser, 2002), és a gazdaszervezetnek hajlamosnak kell lennie a fertőzés során fellépő rendellenességek kialakulására [pl. IL ‐ 1β vagy NOD génpolimorfizmus bizonyos populációkban (El ‐ Omar et al., 2000; Rosenstiel et al., 2006)]. Emellett meghatározhatatlan környezeti tényezők is jelen lehetnek, amelyek kiváltják a betegség előfordulását, és úgy gondolják, hogy a védő faktorok, például a vitaminok, védenek. Végül más tényezők is szerepet játszhatnak a H. pylori patogenitás, élethosszig tartó perzisztencia és rezisztencia az antibiotikumokkal szemben.
Mivel úgy gondolják, hogy számos kórokozó invazivitása szerepet játszik virulenciájukban és patogenitásukban, lehetséges, hogy az invazivitás szerepet játszik a H. pylori patogenitás, 2003-ban áttekintve (Petersen és Krogfelt, 2003). Jelen áttekintés frissíti az akkor rendelkezésre álló információkat, és összefoglalja a következőket in vivo és in vitro ezt bizonyító adatok H. pylori behatolhat a gyomor nyálkahártyájába, és jelen lehet a gyomor hámsejtjeiben és immunocitáiban. Az áttekintés azt is megvitatja, hogy H. pylori az invazivitás szerepet játszik a baktérium perzisztenciájában és patogenitásában.
Megfigyelések H. pyloriFertőzött embereket és állatokat
Az elismerés hiánya H. pylori intracelluláris lehet annak az oka, hogy az elektronmikroszkópia kevésbé alkalmazkodik nagyszámú minta szűréséhez, nehezen alkalmazható az archivált anyagokra, és a minták kiváló megőrzését is megköveteli. Ezzel szemben a nagy teljesítményű hisztokémia, az IHC és a FISH alkalmazása hatékony a nagyszámú biopszia (beleértve az archivált szöveteket is) szűrésében és a kis organizmusok jellemzésében (Makristathis et al., 2004). Ilyen módszerek alkalmazásakor, H. pylori gyomor betegségben szenvedő betegek lamina propriájában, gyomor hámsejtjeiben és immunocitáiban mutatható ki (Andersen és Holck, 1990; Genta et al., 1996; Engstrand et al., 1997; Semino ‐ Mora et al., 2003; Necchi et al., 2007).
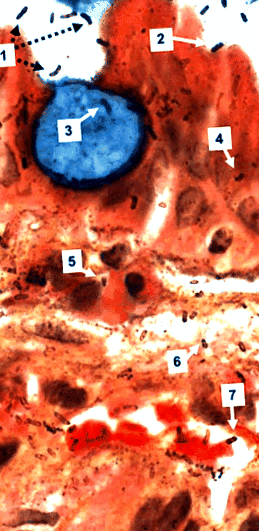
A Genta-foltos biopsziák nagy nagyítású megfigyelése könnyedén szemlélteti az ezüsttel festett spirális organizmusokat nemcsak a gyomor lumenében, hanem a normál és metaplasztikus gyomor hámsejtjeiben, a lamina propriában és a poszt-vénás kapillárisokban is, ahol látszólag ragaszkodjon a vörösvértestekhez (1. ábra). Ezenkívül a ezüstfoltos szervezetek mérete és megjelenése a lamina propriában feltűnően hasonló az intraluminális H. pylori. Az ezüst azonban megfestheti a gazda szövetmembránjait, és nem specifikus H. pylori és sok patológus elveti az ilyen megfigyeléseket. Ezzel szemben az IHC és a FISH készítmények konfokális mikroszkópos megfigyelései és az ultraszerkezeti vizsgálatok immungoldal feltárták a szervezetek specifikus azonosságát és intracelluláris lokalizációját (Semino ‐ Mora et al., 2003; Necchi et al., 2007), és szintén megerősítette H. pylori jelenlét a gyomor lamina propria kapillárisaiban (Aspholm et al., 2006; Necchi et al., 2007).
Bélmetapláziában szenvedő beteg gyomorbiopsziája (Genta folt, eredeti nagyítás × 1000). A kék színű serlegsejtet többé-kevésbé normális hámsejtek veszik körül. Intraluminális H. pylori vagy szabadon lebegnek (1), vagy tapadnak a hámsejtekhez (2), de nem a serlegsejtekhez. Rúd-, vessző- és spirál alakú H. pylori láthatóak a serlegsejtben (3), a hámsejtekben (4), a gyulladásos sejtekben (5), a lamina propriában (6) és egy poszt-kapilláris venulában, ahol szorosan kapcsolódnak az eritrocitákhoz (7) . Érdekes, hogy az intraluminális ezüstfeszültsége H. pylori erősebbnek tűnik, mint az intracelluláris és interstitialis baktériumoknál.
In vitro megfigyelések hámsejtek és immunociták sejttenyészeteiben
Jelenleg azonban nincs közvetlen bizonyíték arra H. pylori képes intracellulárisan replikálódni, mert időintervallumú tanulmány nem mutatott be H. pylori a sejteken belüli osztódás és a kolóniaképző egységek (cfu) száma nem növekedett a gentamicinnel kezelt AGS sejtekben (Amieva et al., 2002). Ez utóbbi megfigyelés azt jelzi, hogy ezek a specifikus in vitro a kísérleti körülmények nem biztosítanak önfenntartó környezetet, de nem zárják ki teljesen az intracelluláris replikációt H. pylori. Valójában az intracelluláris cfu szám komplex egyensúlyt képvisel a belépés, az intracelluláris növekedés, az intracelluláris halál és a sejtekből való kilépés között, és ezt a kényes egyensúlyt az extracelluláris gentamicin megzavarhatja. In vivo, lehetséges, hogy H. pylori ideiglenesen intracellulárisan elrejtőzik, majd a veszély elmúlása után eltávozik, hasonlóan ahhoz, ami történhet Campylobacter jejuni, egy másik fakultatív intracelluláris organizmus.
Közötti komplex kapcsolat H. pylori és az eliminációjukkal megbízott immunociták segíthetnek megmagyarázni, miért tart fenn a fertőzés általában az egyén életében. In vitro, fagocitált H. pylori ultrastruktúrálisan nem sérült, ha polimorfonukleáris leukocitákkal és monocitákkal inkubáltuk komplement vagy szérum hiányában, míg a komplement vagy szérum hozzáadása az inkubációs közeghez a baktériumok pusztulásához vezetett (Andersen et al., 1993; Kist et al., 1993). Hasonlóképpen az immunszérum és a monociták feleslegének hozzáadása csökkentette a sejtek számát H. pylori, mivel a PMN-k felesleges mennyisége teljesen megölte H. pylori (Andersen et al., 1993). Azonban a fagocitázott baktériumok egy része a monocitákkal és a szérummal végzett inkubálás után nem volt hatással, és gyakran nagy vérlemezke-aggregátumok vették körül őket (Andersen et al., 1993). Ez utóbbi megfigyelés releváns lehet a vérlemezkeszám normalizálása szempontjából, amelyet az immun trombocitopéniás purpurában szenvedő betegek majdnem felénél észleltek. H. pylori felszámolás (Kuwana és Ikeda, 2006).
Helicobacter pyloriAz emberi neutrofilek indukált, nem opszonikus aktiválása lektinofagocitózis útján következik be, vagyis a szialinsavhoz kötődő SabA adhezin tapadása a fagocitózist aktiváló neutrofilek felszíni gangliozidjaihoz (szialilezett glikolipidekhez) (Unemo et al., 2005). A SabA-t nemrégiben a régóta keresett sziálsav-függőként azonosították H. pylori haemagglutinin, amely a baktériumsejteket eritrocitákkal aggregálja in vitro. Továbbá, H. pylori a gyomornyálkahártya kis erekben lévő eritrocitákhoz kapcsolódik, ami arra utal, hogy a hemagglutináció közvetlen biológiai jelentőségű és mechanisztikusan aktív lehet in vivo (Aspholm et al., 2006). A gyomor nyálkahártyájában, H. pylori gyakran meghaladja a fagocitákat. Ha a in vitro eredmények tükrözik a in vivo helyzetben a fagociták hatástalanok lehetnek H. pylori megölése, amely szerepet játszhat a H. pylori a gyomor hámjában.
Hasonló eseményeket figyeltek meg a makrofágokban. Az immunfluoreszcencia és az elektronmikroszkóp kimutatta, hogy virulens H. pylori tartalmazó cag patogenitási sziget gyorsan aktivizálódott aktinban gazdag fagosomákba (Allen et al., 2000). A homotípusos fagoszóma fúzió ezután többszöröset tartalmazó „megazómák” kialakulásához vezetett H. pylori amelyek életképesek ≥ 24 órán át (Allen et al., 2000). Ellentétben, H. pylori olyan törzseket, amelyek nem expresszálták a CagA-t vagy a VacA-t, könnyen fagocitizálták és elpusztították, és nem észleltek megaszómákat (Allen et al., 2000). Megasome képződés és H. pylori Kimutatták, hogy a túlélés az ureáztól és az ureáz eredetű ammóniától, valamint a phagosomák savanyulásától függ (Schwartz és Allen, 2006). Az intracelluláris jelenléte H. pylori Az immunocitákon belül az apoptózis termelődése társult a T- és B-sejtvonalakban (Singh et al., 2006) és in vivo (Semino ‐ Mora et al., 2005), amely szerepet játszhat a fertőzés fennmaradásában (Singh et al., 2006).
A mechanizmus és az idő lefutása H. pylori invazivitás
Időzített pásztázó elektronmikroszkópia (SEM) és TEM dokumentálta a kezdeti tapadás és a H. pylori HEp2 sejtekbe (2. ábra) (Lofman et al., 1997). Úgy tűnik, hogy a belépés más mechanizmust foglal magában az AGS sejtekben, intim tapadással H. pylori az AGS-sejtekből kibontakozó álpodákra, amelyek az H. pylori cipzárszerű módon (3. ábra) (Kwok et al., 2002).
A. SEM képe H. pylori bejegyzés egy HEp2 cellába (M. Block engedélyével, Engstrand és Graham után, 1997). B és C. Kettő gyorsított megfigyelése H. pylori pirossal körvonalazva mutatja a progresszív belépést egy HEp2 cellába 49 s idő alatt. A Macmillan Publishers Ltd. engedélyével adaptálva. Természetgyógyászat3: 930–931, szerzői jog 1997.
SEM és TEM elemzése H. pylori 26695 betartás és belépés az AGS cellákba. Fertőzött AGS sejtek H. pylori 26695, 100 fertőzés sokaságával 12 órán át 37 ° C-on. A különböző időpontokban kapott mintákat SEM és TEM elemezte. H. pylori az AGS sejtekhez tapadva, a gazdasejt mikrovilláival intim kontaktus útján (30 perc, nyilak). A cipzárszerű elnyelés jellemzői a fertőzés után 1, 90 és 3 órával figyelhetők meg. Rúd, 1,5 μm. Kwok engedélyével et al. (2002).
Molekuláris vizsgálatok azt mutatták, hogy a hámsejtekbe való bejutást receptor által közvetített endocitózis (Evans et al., 1992), valamint a baktériumok mozgékonyságának és a sejtmembránok behatolásának aktív folyamatán keresztül (Bjorkholm et al., 2000). Ezután a baktériumokat szoros vakuolokban kötötték meg, szoros összefüggésben a kondenzált filamentális aktin és a tirozin foszforilációs szignáljaival. Ezeket az eseményeket dózisfüggően gátolták a TNF-α, valamint a foszfatidil-inozitol-3-kináz és a protein-kináz C inhibitorai, és fokozták a tirozin-foszfatázok és ATP-ázok inhibitoraival (Kwok et al., 2002).
A differenciális interferencia kontraszt videó és az immunfluoreszcens mikroszkópia (4. ábra) ezt szemléltette H. pylori bejuthat több hámsejtvonal nagy citoplazmatikus vakuolusába, beleértve a gyomor és a vastagbél adenokarcinómáját és a vesesejtvonalat (Amieva et al., 2002). A citokalazin D kezelés nem befolyásolta a vakuol képződését, de elnyomta a sejtekbe való bejutást, ami arra utal, hogy az aktin citoszkeleton szerepet játszik a sejtek bejutásában (Amieva et al., 2002). A cellákba kerülve, H. pylori a vakuolusokban több órán keresztül mozgékony maradt, amint azt a time-lapse mikroszkópia bizonyítja. Pulzáló gentamicinnel végzett kezelés azt mutatta, hogy az intravacuoláris baktériumok felezési ideje körülbelül 24 óra volt, és néhány intravacuoláris baktérium életképes maradt, felszabadultak, és a gentamicin eltávolítása után újratelepítették az extracelluláris környezetet.
Az együtt tenyésztett AGS-sejtek differenciális immunfestésének illusztrációja H. pylori. Amint azt a sárga nyíl szemlélteti, a legtöbb H. pylori sárga színűek és a sejteken kívül helyezkednek el. Az egyik H. pylori intracelluláris (piros nyíl) és vörös színű (Amieva után) et al., 2002 engedéllyel).
Ezek egyike lehet egy invasin (InvA) fehérje, hasonló az enteropatogén által termelt fehérjéhez Yersinia és amely kötődik a bél M sejtjeinek integrin receptoraihoz, és lehetővé teszi a bejutást ezekbe a sejtekbe (Isberg et al., 2000). Abban az esetben H. pylori, a J99 törzs homológ invazin protein InvA és an invA gén, míg hasonló szekvenciákat NudA és nudA a 26695 törzsben, és jelen vannak a nemrégiben publikált HPAG1 teljes genomokban (CP000241 és NC_008086 hozzáférési számok), bár nevet nem adtak (Oh et al., 2006).
A relevancia H. pylori invazivitás
Végül intracelluláris H. pylori jobban ellenállnak az antibiotikum-kezelésnek, és csak a magas intracelluláris aktivitású antibiotikumok képesek eltávolítani a baktériumot a HEp2 sejtekből. In vivo, Az IHC kimutatta, hogy a tartósan intracelluláris betegeknél a fertőzést nem gyógyították meg antibiotikumokkal H. pylori fertőzés, még akkor is, ha az extracelluláris baktériumok eltávolítása a kezelés után 14 nappal teljes volt (Engstrand et al., 1997). Tehát az intracelluláris aktivitású antibiotikumokat (például makrolidokat) kell előnyben részesíteni a kezelésre H. pylori fertőzés (Hulten et al., 1996; Pechere, 2001).
Következtetések
Negyed évszázad felfedezése után H. pylori és annak bemutatása, hogy a baktérium gyomor adenocarcinoma, MALT lymphoma és peptikus fekélyeket okoz, meggyőzően in vivo bizonyítékok bizonyítják, hogy a baktérium beléphet és expresszálhatja az mRNS-t és az antigéneket a gyomor lamina propriájában. Továbbá, in vitro tanulmányok kimutatták, hogy életképes H. pylori túlélik a hámsejtekben és az immunocitákban, irányított mozgásokat mutatnak az intracelluláris vakuolákban, és újratelepítik az extracelluláris teret, miután az extracelluláris baktériumpopulációt gentamicin ölte le akár 3 napig. A közvetlen időintervallumú megfigyelések azonban nem szolgáltattak közvetlen bizonyítékot az intracelluláris replikációra H. pylori a hámsejteken belül osztódó baktériumok vizualizálásával és az intracelluláris szám növekedését nem figyelték meg. Ezen kívül nem H. pylori faktor ismert, hogy elengedhetetlen az invázióhoz vagy az intracelluláris túléléshez. Végül az intracelluláris és az intraluminális frakció H. pylori a gyomor-bél hámsejtjeiben kb. 1%, a HeLa sejtekben jelentéktelen volt, és csábító arra gondolni, hogy a baktérium invazivitása klinikailag nem fontos.
Mindazonáltal néhány gyorsan osztódó és stratégiailag elhelyezkedő sejt citoplazmájában elhelyezkedő baktériumok kis száma számos citoplazmatikus és nukleáris folyamat módosítását eredményezhetik, és CpG-metilációt és DNS-mutációkat okozhatnak, különösen azért, mert a virulencia génekről ismert, hogy hámsejtekben expresszálódik (Semino ‐ Mora et al., 2003; Necchi et al., 2007). Tehát, mivel úgy gondolják, hogy számos rák egyetlen sejtből, néhány sejten belül fejlődött ki H. pylori immun, karcinogén vagy más fejlődési reakció útvonalakat válthat ki, különösen akkor, ha a gyorsan osztódó epiteliális progenitor sejtekben vannak (Oh et al., 2005; Semino ‐ Mora et al., 2007). Ez a folyamat intuitív módon vonzó az adenokarcinómához vezető hámsejtek és a MALT-limfómához vezető immunociták neoplasztikus átalakulásának magyarázatához. Ezenkívül a H. pylori és az immunociták mérsékelhetik a gazda immunitását, és fontos szerepet játszhatnak a baktérium perzisztenciájában.
A már elért haladás ellenére egyértelmű, hogy további in vitro és állatkísérleteket kell végezni, és a megfigyeléseket integrálni kell az új klinikai megfigyelésekkel, mielőtt ezt meggyőződhetnénk H. pylori az invazivitás szerepet játszik a baktériumok patogenitásában, perzisztenciájában és az antibiotikumokkal szembeni rezisztenciában.
Köszönetnyilvánítás
Köszönjük Dr. V. Simkónak, hogy gyomorbiopsziákat kapott emberi alanyokból, és Dr. Semino ‐ Morának, hogy elkészítette az 1. ábrát. Köszönetet mondunk Dr. Engstrandnak, Meyernek és Amievának, hogy a 2–3. 4. Részben a Nemzeti Egészségügyi Intézetek által támogatott (CA82312/AD).
- A Helicobacter pylori megakadályozza a gyomorhurutot a vastagbélgyulladásban
- Helicobacter pylori antitest reaktivitás és vastagbélrák kockázat egy eset-kontroll tanulmányban
- Helicobacter pylori fertőzés, reflux oesophagitis és atrófiás gyomorhurut Felfedezetlen háromszög -
- A Helicobacter pylori fertőzés és az alacsony étrendi vas-viselkedés megváltoztatja a vashiányos vérszegénységet,
- A Helicobacter pylori fertőzés súlyosbítja az étrend által kiváltott inzulinrezisztenciát a bélrendszerrel együtt