A hiperkoleszterinémia zsírzavart vált ki elhízás és elhízás esetén 1
Absztrakt
Bevezetés
A WHO szerint a koszorúér-betegség (CHD) 2 volt a halálozás legfőbb oka az elmúlt évtizedben, és 2011-ben az összes halálozás 11,2% -áért felelős (1). A hiperkoleszterinémia vagy a magas vér koleszterin-koncentráció a nem HDL lipoproteinek által hordozott koleszterinre vonatkozik, és ez az egyik legismertebb tényező a CHD kialakulásában (2). Tehát a ≥5,2 mmol/l plazmakoleszterin-koncentráció vagy ≥2,6 mmol/L LDL-koleszterin-koncentráció pozitív kapcsolatban áll az érelmeszesedés és a CHD kialakulásával. A zsírszövetben kimutatták, hogy a magas keringő LDL koncentrációk jelenléte rontja a TG clearance-t és más káros hatásokat vált ki (3). A hiperkoleszterinémia (HCE) hatása a véren kívüli egyéb szövetekben, valamint a szövetek közötti szisztémás keresztbeszélés nem teljesen ismert (4).
A legújabb állatkísérletek azt mutatták, hogy a májban, amely a koleszterin metabolizmusában szerepet játszó fő szerv, a HCE májsejtek diszfunkcióját, fibrózisát és az alkoholmentes steatohepatitis korai stádiumának kialakulásának indukcióját okozhatja (5). Ezt figyelembe véve fontos foglalkozni a HCE hatásával a koleszterin metabolizmusának és tárolásának más fő szerveire, például a zsírszövetre.
Emberben az adipocita koleszterin koncentrációja elérheti az összes lipid 0,5% -át, és a zsírszövet képezi testünk legnagyobb koleszterin készletét (6). Megállapították, hogy az elhízás a túlzott TG és a koleszterin felhalmozódása miatt hipertrófiás adipocitákhoz vezet (7–9). Ez viszont kóros koleszterineloszlást eredményez. Ennek eredményeként csökkent plazmamembrán (PM) koleszterinszint, majd fokozott folyékonyság figyelhető meg ezekben a sejtekben (10). Összességében ezek a TG és a koleszterin túlterhelés által kiváltott jellemzők a diszfunkcionális adipociták jellemzői (9, 11). Mindazonáltal kevés figyelmet fordítottak a HCE elhízástól független, a zsírműködésre gyakorolt hatására.
A közelmúltban végzett állatkísérletek során, amelyekben a súly és a zsírösszetétel nem változott, a HCE diéták hipertrófiás adipocitákat és rendellenes zsírfunkciókat eredményeztek (12, 13). Emberekben a közelmúltbeli kísérletek azt mutatták, hogy a HCE-vel és a megváltozott plazma lipidprofillal rendelkező egyének megzavarták az adipokin szekréciót, emellett megemelkedtek az előgyulladásos markerek és a zsírszövet diszfunkcióval kapcsolatos egyéb jellemzők (14). Ezenfelül ezeket a hatásokat a plazma koleszterinszint-csökkentő gyógyszerek, például 3 hidroxi-metil-glutaril-koenzim A (HMG-CoA) reduktáz inhibitorok (15) és a Niemann-Pick C1-szerű 1-hez kötődő, a koleszterint gátló ezetimibe gyengítették. felszívódás (16).
A koleszterin-túlterhelés negatív visszacsatolással is befolyásolhatja a szterin szabályozó elemeket kötő fehérjék (SREBP) expresszióját (17). A SREBP-k csökkent expressziója csökkent peroxisome PPARγ2-expressziót és az adipocita-fejlesztésben részt vevő downstream gének későbbi csökkenését eredményezi (18–20). Ezt az utat egy PPARγ2 agonista alkalmazásával igazolták, amely visszanyerte az egér zsírszármazékaiból származó sztrómasejtek (mASC) adipocytikus differenciálódási képességét (17).
Jelen áttekintés célja a HCE zsírszövet elhízástól független hatásáról szóló új bizonyítékok perspektívája, és szembeállítani ezeket az információkat az elhízás jobban felismert szerepével az adipocita diszfunkcióban.
A tudás jelenlegi állapota
A koleszterin elhízástól függő hatásai az adipocitában.
Az adipociták egyedülálló jellemzője, hogy észterezett formában nagyon alacsony mennyiségű koleszterint tartalmaznak (6). Ez különbözik több sejttípustól, beleértve a hepatocitákat, a mellékvese sejteket, a hab makrofágokat és másokét (5, 21). Valójában csak + monocitákban (40).
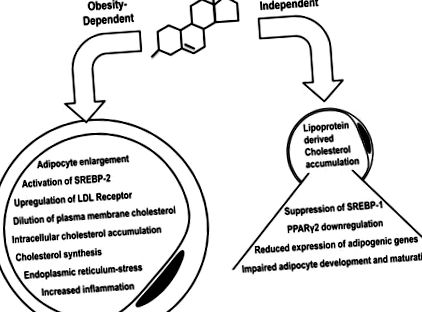
Egy másik fontos in vitro vizsgálatban a mASC-ket Chol: MbCD-vel kezelték a koleszterin túlterhelés utánozására. Megállapították, hogy a Chol: MbCD növelte az észterezett koleszterinszintet és alacsony hatást fejtett ki a szabad koleszterin intracelluláris koncentrációiban. Ez megnövekedett proliferációt és csökkent érett adipociták differenciálódását eredményezte (17). Ezenkívül a SREBP, az adipocita differenciálódás szempontjából kulcsfontosságú transzkripciós faktor (41), valamint a lefelé irányuló PPARγ2, számos adipocita lipidtároló gén fő transzkripciós szabályozója (19) plazma és fehérje koncentrációját szabályozták. Összefoglaló az adipociták koleszterin elhízástól és elhízástól független hatásairól 1. ábra .
Az adipocita koleszterin-egyensúlyhiányát elhízásfüggő és elhízástól független mechanizmusok válthatják ki. Elhízástól függő körülmények között az adipociták megnövekedése a plazma membránfelületének növekedését eredményezi, ami a membrán koleszterinének hígításához vezet. A SREBP-1 ekkor érzékeli a koleszterin kimerülésének hamis jelét, és aktívvá válik, ami a koleszterin szintézisének és felvételének szabályozását eredményezi, ami intracelluláris koleszterin túlhalmozódást eredményez. Elhízástól független körülmények között a koleszterin túlságosan felhalmozódhat az adipocytákban az SREBP-1 és annak downstream PPARγ2 elnyomását eredményező lipoprotein felvétel révén, ami az adipogén módon rokon gének visszaszorítását eredményezi, tompítva ezzel az adipocita differenciálódást és érést. SREBP-1, szterin szabályozó elemeket megkötő fehérje 1.
A zsírszövet válaszai a koleszterinszint kihívásaira: állatkísérletek.
A tengerimalacok nagyon hasonló lipoprotein- és koleszterin-anyagcsere-profillal rendelkeznek az emberekkel, ami kiváló modellt jelent az étrend okozta érelmeszesedés tanulmányozásához (5, 21, 44). Elhízástól független, étrend által kiváltott HCE hatásokat teszteltünk (13). A koleszterin felhalmozódása nagyobb volt a zsírszövetben a magas koleszterintartalmú étrenddel etetett tengerimalacokban. Ezenkívül a proinflammatorikus citokin (IL-2, TNF-α, MCP-1) koncentrációjának növekedését figyelték meg ebben a szövetben. Ezekkel az eredményekkel összhangban a HCE tengerimalacok adipocytái fokozott makrofág infiltrációt, hiperpláziát és fokozott nekrózist mutattak.
Keresztbeszélgetés a zsírszövet és más szervek között.
Fontos megemlíteni, hogy ezen állatkísérletek többségében a zsírszövet gyulladása és működési rendellenessége együtt jár az érelmeszesedés és a májbetegség kialakulásával. Jelenleg nem világos, hogy melyik szövet indítja el elsőként a káros proinflammatorikus visszacsatolási hurok keresztbeszélgetését a HCE által érintett szövetek között. A bizonyítékok azonban rámutatnak arra, hogy a máj a lipoprotein metabolizmus szabályozásának fő szerve (45). A hiperkoleszterinémiás tengerimalacokról kimutatták, hogy kialakulnak az alkoholmentes zsírmájbetegség jellemzői, mielőtt az ateroszklerózisra utaló jeleket mutatnának (5). LDL-receptor-hiányos egerekben a magas zsírtartalmú HCD 7 napon belül hepatocita-gyulladást eredményezett (46). A májszérum amiloid A (SAA) és a C-reaktív fehérje (CRP) plazmakoncentrációja több HCE diétával táplált állatmodellben megnőtt (13, 45). Az SAA fokozza a lipoprotein-proteoglikán kötődését az érszövetben, amely potenciálisan aterogén lehet (47). Ezenkívül számos proinflammatorikus citokin szekréciója figyelhető meg a májban a HCE állapotok alatt (12, 13). Ez hozzájárulhat a krónikus alacsony fokú szisztémás gyulladás visszacsatolásához e szövet és a zsírraktárak között, súlyosbítva a CHD kialakulását.
Az emberi zsírszövet reakciója a HCE-re.
Embereken végzett családi HCE-vizsgálatok sok bizonyítéka igazolta ennek az állapotnak az érelmeszesedés és szisztémás gyulladás kialakulására gyakorolt erős hatásait (48–52). Kimutatták, hogy a zsír egy kivételesen aktív metabolikus és endokrin szövet, amely számos patológiában vesz részt (53–55). Mivel a zsírszövet a koleszterin nagy részét a testünkben tárolja, logikusnak tűnik értékelni a HCE hatását ebben a szövetben és annak szerepét az érelmeszesedés kialakulásában. Ennek ellenére kevés humán vizsgálatot végeztek a HCE zsírszövetben kifejtett hatásainak vizsgálatára; ezért ez lesz a következő szakasz középpontjában.
Veilleux és munkatársai elegáns tanulmánya. (56) 2013-ban az adipocita hipertrófia és a metabolikus rendellenesség kapcsolatát vizsgálta nőknél. A szerzők arról számoltak be, hogy azoknak a résztvevőknek (n = 207), akik hipertrófiás omentális adipocitákat mutattak be, magasabb volt a teljes/HDL-koleszterin arány is. Nevezetesen ez független volt a zsír összetételétől és eloszlásától.
A CHD-ben szenvedő betegeknél megváltozott az adipokin szekréció, a proinflammatorikus citokinek megnövekedett koncentrációja és a makrofágok beszűrődése többféle zsírszövetben, például epikardiális és omentális (9, 57). Bár ezeknek az anomáliáknak a HCE-vel való kapcsolata nem teljesen világos, a sztatinok kimutatták, hogy csökkentik és modulálják ezeket a káros hatásokat (57).
Következtetések
Köszönetnyilvánítás
Mindkét szerző elolvasta és jóváhagyta a végleges kéziratot.
Lábjegyzetek
2 Használt rövidítések: CD, differenciálási klaszter; CE, koleszterin-észter; CETP, koleszterin-észter transzfer fehérje; CHD, szívkoszorúér-betegség; Chol: MbCD, koleszterin metil-β-ciklodextrinnel; CRP, C-reaktív fehérje; DD, diabetogén étrend; ER, endoplazmatikus retikulum; HCD, magas koleszterinszintű étrend; HCE, hiperkoleszterinémia; HMG-CoA, 3-hidroxi-3-metil-glutaril-koenzim A; mASC-k, egér zsírszármazékú sztrómasejtek; MCP-1, monocita kemoatraktáns fehérje 1; ox-LDL, oxidált LDL; PM, plazma membrán; SAA, szérum amiloid A; SR-B1, B1 megkötő receptor; SREBP, szterin szabályozó elem-kötő fehérje; WAT, fehér zsírszövet.
- Az inzulinreceptor szubsztrát-1 gátolja a magas zsírtartalmú étrend okozta elhízást azáltal, hogy megpirul a fehér zsír
- Az IRhom2 elősegíti az elhízást azáltal, hogy fokozza a zsírgyulladást és az inzulinrezisztenciát
- Az elhízással járó magas zsírtartalmú étrend az egér corpus cavernosum válaszainak károsodását idézi elő -
- Az elhízás endotheli diszfunkciójának mechanizmusai - ScienceDirect
- Az elhízás elnyomásának mechanizmusa a zsírszövet kreatinenergiájával - Kazak - 2018 - A FASEB