A hipotalamikus Creb-kötő fehérje szerepe az elhízásban és a metabolikus szubsztrátok molekuláris átprogramozásában
Cesar L. Moreno
1 Idegtudományi Tanszék és a Friedman Brain Institute, az Icahn Orvostudományi Egyetem, a Sínai-hegyen, New York, New York, Amerikai Egyesült Államok
Linda Yang
1 Idegtudományi Tanszék és Friedman Brain Institute, Icahn Orvostudományi Egyetem, a Sínai-hegyen, New York, New York, Amerikai Egyesült Államok
Penny A. Dacks
1 Idegtudományi Tanszék és Friedman Brain Institute, Icahn Orvostudományi Egyetem, a Sínai-hegyen, New York, New York, Amerikai Egyesült Államok
Fumiko Isoda
1 Idegtudományi Tanszék és Friedman Brain Institute, Icahn Orvostudományi Egyetem, a Sínai-hegyen, New York, New York, Amerikai Egyesült Államok
Jan M. A. van Deursen
2 Gyermek- és serdülőkori osztály, Mayo Clinic College of Medicine, Rochester, Minnesota, Amerikai Egyesült Államok
Charles V. Mobbs
1 Idegtudományi Tanszék és Friedman Brain Institute, Icahn Orvostudományi Egyetem, a Sínai-hegyen, New York, New York, Amerikai Egyesült Államok
Fogalomalkotás: CLM LY PAD CVM FI JMAD.
Hivatalos elemzés: CLM LY CVM FI JMAD.
Finanszírozás megszerzése: CLM CVM.
Vizsgálat: CLM LY PAD FI.
Módszertan: CLM LY CVM FI JMAD.
Projekt adminisztráció: CLM LY PAD CVM FI JMAD.
Erőforrások: CVM JMAD.
Felügyelet: CVM FI JMAD.
Érvényesítés: CLM LY PAD CVM FI JMAD.
Megjelenítés: CLM LY PAD CVM FI JMAD.
Írás - eredeti vázlat: CLM CVM.
Írás - áttekintés és szerkesztés: CLM LY PAD CVM FI JMAD.
Társított adatok
Minden lényeges adat a dokumentumban és az azt alátámasztó információs fájlokban található.
Absztrakt
Beszámoltunk összefüggésről a Creb-kötő fehérje (Cbp) hipotalamusz expressziója és az élettartam között, és hogy a Cbp gátlása megakadályozza az étrendi korlátozás védőhatásait az öregedés során, ami arra utal, hogy a hipotalamusz Cbp szerepet játszik a táplálkozási állapotra és az energiaegyensúlyra adott válaszokban. A legutóbbi GWAS és hálózati elemzések a Cbp-t is a fehérje-fehérje kölcsönhatások leginkább összekapcsolt génjévé tették a humán 2-es típusú cukorbetegségben. Jelen tanulmányok a Cbp cukorbetegségben játszott szerepét közvetítő mechanizmusokkal foglalkoznak a hipotalamusz Cbp gátlásával Cre-lox stratégia alkalmazásával. A hipotalamusz Cbp gátlása mély elhízást és a glükóz homeosztázis károsodását, fokozott táplálékfelvételt és csökkent testhőmérsékletet eredményez. Ezenkívül ezeket a változásokat molekuláris bizonyítékok kísérik a hipotalamuszban a leptin és az inzulin szignalizációjának károsodása, a glükózról a lipid anyagcserére való áttérés és a csökkent Pomc mRNS-ek mellett, a mozgás szempontjából nincs hatással. A metabolikus kapcsolás jelentőségének további értékelése kimutatta, hogy a hipotalamusz Cpt1a fokozott expressziója, amely elősegíti a lipid anyagcserét, hasonlóan megnövekedett testtömeghez és csökkent Pomc mRNS-hez vezetett.
Bevezetés
Az elhízással járó növekvő 2-es típusú cukorbetegség az egyik legnagyobb fenyegetést jelent a világ egészségére nézve a 21. században [1], de ezekhez a szindrómákhoz hozzájáruló mechanizmusok még tisztázatlanok. A tápanyag-érzékelő hipotalamusz neuronok kulcsfontosságú helyet jelentenek az energiaegyensúly és a glükóz-anyagcsere érzékelésében és szabályozásában, ezért ezek a hipotalamusz-funkciókat közvetítő mechanizmusok általános aggodalomra adnak okot. Míg a leptin és az inzulin hipotalamusz érzékelése közvetíti az energia és a glükóz homeosztázis aspektusait [2], addig a speciális hipotalamusz neuronok a hasnyálmirigy béta sejtjeihez hasonló mechanizmusokkal is érzékelik a glükózt [3], és ezek az idegsejtek képesek szabályozni a vér glükózt [4]. A hipotalamusz glükózérzékelő idegsejtjeiről már régóta feltételezik, hogy szerepet játszanak az energiaegyensúly szabályozásában [5], de ezen neuronok szerepe az energiaegyensúly szabályozásában még meghatározatlan. Mindazonáltal a legújabb tanulmányok azt sugallják, hogy a metabolikus elmozdulás a hipotalamusz glükóz metabolizmusától a hipotalamusz lipid metabolizmusa felé elősegíti az elhízott fenotípusokat [6,7].
Korábban beszámoltunk arról, hogy a Creb-kötő fehérje (Cbp) hipotalamusz-expressziója pozitív korrelációt mutat az egér törzsek élettartamával [8]. Újabban megfigyeltük, hogy az étrendi korlátozás hipotalamusz Cbp-t indukál egerekben, a proteotoxicitás elleni védőhatásokkal társulva [9]. Hasonlóképpen, a táplálékkorlátozás Caenorhabditis elegans-ban indukálja a Cbp-t, és ennek az indukciónak a blokkolása megakadályozza az étkezéskorlátozás védő hatásait az öregedés során [8]. Ezenkívül a közelmúltbeli GWAS és hálózati elemzések a Cbp-t, mint a fehérje-fehérje kölcsönhatások leginkább összefüggő génjét vonták be a 2-es típusú cukorbetegségben [10]. Ezek a jelentések a Cbp függvényét javasolják a tápanyagok érzékelésében és az energiaegyensúlyban.
Jelen tanulmányok a hipotalamusz Cbp szerepét vizsgálták az energia egyensúlyban és a glükóz homeosztázisban. Ezek a tanulmányok azt mutatják, hogy a hipotalamusz Cbp gátlása robusztus elhízott fenotípusokat eredményez, amelyek mind a megnövekedett táplálékfelvételt, mind a csökkent testhőmérsékletet eredményezik, összefüggésben a glükóz homeosztázis károsodásával. Ezek a változások olyan hipotalamusz molekulaprofillal társulnak, amely elmozdulást jelez a glükóz-anyagcserétől a lipid-anyagcsere felé, még páros táplálású és súly-egyeztetett kontrollokban is, ami alátámasztja, hogy ez a molekulaprofil okozza az elhízott fenotípusokat, nem pedig annak eredményét. . Az ok-okozati szerepet tovább támogatva bebizonyítjuk, hogy a karnitin-palmitoil-transzferáz 1A (Cpt1a), a lipid-anyagcserét elősegítő kulcsfontosságú enzim fokozott hipotalamusz-expressziója hasonló elhízott fenotípusokat hoz létre, amelyek a hipotalamusz Pro-opiomelanokortikotropin (Pomc) csökkent hipotalamuszával társulnak. Ezek a tanulmányok azt mutatják, hogy a csökkent hipotalamusz Cbp elősegíti az elhízott fenotípusokat, részben elfogadható módon azáltal, hogy fokozza a hipotalamusz lipid anyagcseréjét és csökkenti a hipotalamusz glükóz metabolizmusát, ami a csökkent hipotalamusz Pomc.
Anyagok és metódusok
Állatok
Cbp (flox/flox) tenyészpárokat a Jan van Deursen laboratóriumtól (Mayo Clinic, Rochester, MN) kaptunk; ezeket a leírtak szerint állítottuk elő [11]. Valamennyi egérvizsgálatot engedélyével és a Sínai-hegyi Icahn Orvostudományi Iskola Intézményi Állatgondozási és Felhasználási Bizottságának (IACUC 12–0044 és 12–0169 protokoll) szerint hagyták jóvá. Az egereket 12 órás fényben tartottuk: 12 órás sötét ciklusokban.
Műtéti eljárások és vírusszállítás
Immunhisztokémia
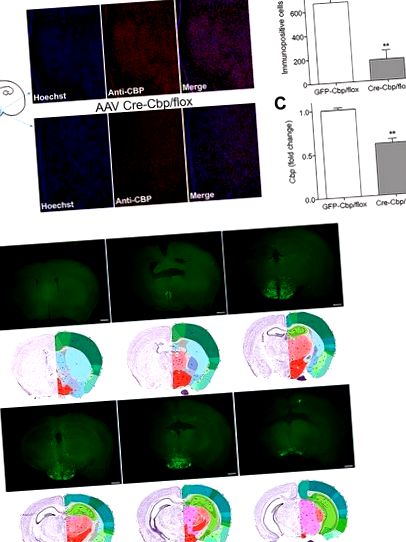
Az állatokat perfundáltuk 4% hideg paraformaldehiddel PBS-ben, a leírtak szerint [13]. Az agyat extraháltuk és 4% paraformaldehidbe helyeztük 4 ° C-on egy éjszakán át. Szabadon úszó szakaszokat készítettünk 75 μm vastagságú szeleteléssel vibratómával és PBS-ben gyűjtöttük össze. Az agyszeleteket 1,5 órán át mostuk és blokkoltuk 5% normál kecskeszérumban és 0,3% Triton X-ben. A szeleteket Anti-CBP-vel (SC-1211; 1: 100) (Santa Cruz Biotechnology, Dallas, TX) O/N inkubáltuk. 4 ° C. Inkubálás után a metszeteket Alexa Fluor 658 anti-nyúl IgG-vel (A-11011; 1: 400) és Hoescht-vel (H1399; 2μg/ml) (Life Technologies) festettük. Ezután a metszeteket a tárgylemezekre rögzítettük a Fluoromount G (Beckman Coulter, Fullerton, CA) alkalmazásával. Az összes képet Zeiss LSM 780 konfokális mikroszkóppal készítettük 10x Neofluar objektív alkalmazásával. 1024x1024 12 bites képeket készítettek a ZEN 2012 8.1-es verziójával, és Fidzsi-szigeteken dolgozták fel. Állatonként egyetlen tárgylemezről (75 μm vastagságú) CBP immunpozitív sejteket, amelyek ugyanezen területre kiterjedő ROI maszkot (S1 ábra) használva infúziós helyet tartalmaztak a mediobasalis hipotalamuszban, megvakult tervezéssel és a Fidzsi-szigeteki Analyze Particle jellemzővel értékeltük.
Vércukorszint és inzulin mérések
A farok vért összegyűjtöttük és a vércukorszintet Bayer Contour glükózmérővel (Bayer, Mountain View, CA) mértük. A glükóz tolerancia teszteket 4 órás gyorsböjt után követtük, majd 20% glükóz intraperitoneális (i.p) injekciót adtunk a testtömeghez igazított sóoldatban (10 μl/g). A vérinzulint ultraérzékeny egér inzulin ELISA készlettel (Crystal Chem, Downers Grove, IL) nyertük.
Élelmezés és állatnyilvántartás
Valamennyi állatot egyedileg ketrecbe helyeztük a vírusinjekciók után. A táplálékfelvételt 2 héttel a vírusos szállítás után mértük. A kiömlött ételeket összegyűjtötték és kivonták az élelmiszer-bevitel méréséből. Két AAV-Cre-vel vagy AAV-GFP-vel injektált kontrollcsoport szabad hozzáférést biztosított a chow-étrendhez. További két kísérleti csoportot állítottunk fel a következő protokoll alkalmazásával, hogy megegyezzenek a műtét időpontjától számított testtömegekkel. Ez utóbbiakat naponta lemértük, és megfelelő gramm ételt kaptunk az eredeti testsúly fenntartása érdekében. A műtét után egy héttel kezdődő energiafelhasználás tanulmányozásához az AAV-Cre vagy AAV-GFP infúzióval kezelt csoportokat páros táplálékkal láttuk el étkezési pelletek 1 órával a világítás előtt. Az állatok kapták az NIH-31 chow formulát (Harlan Teklad Laboratories, Madison, WI), vagy magas zsírtartalmú étrendet 20% fehérje, 35% szénhidrát, 45% zsír). A testhőmérsékletet rektális szondával végzett lefejezés után rögzítettük, IT-1E hőelem mikropondával és Bat-12 hőmérővel (Physitemp, Clifton, NJ).
Az mRNS mennyiségi meghatározása
(A) Reprezentatív képek a nukleáris Hoescht festéssel (kék), az immunreaktív CBP (piros) és a kolokalizációval (rózsaszín) 3 hét AAV-GFP vagy AAV-Cre (B) hipotalamusz infúzió után, az immunopozitív sejtek száma ± SEM a mediobasalis hipotalamuszban ( n = 5–6) (C) Egér hipotalamusi Cbp ± SEM, számszerűsítve RT-PCR-rel (n = 14–20). (D) A koronaszelvények reprezentatív képei 3 héttel gyűjtöttek a sztereotaxikus szülés után. A képek a rostralis-caudalis-ra vannak rendezve, az Allen Atlas megfelelő szakaszaival együtt [16]. Méretarány = 800 μm.
Statisztikai analízis
Az összes állatfiziológiai rekordot a PRISM 5 szoftver segítségével elemeztük kétutas ANOVA alkalmazásával, amelyet Bonferroni, vagy adott esetben Student t-tesztje követett.
Eredmények
A hipotalamusz Cbp gátlása Cbp flox/flox egerekben AAV-Cre segítségével
A hipotalamusz Cbp gátlása növeli a testtömeget és az élelmiszer-bevitelt, és rontja a glükóz homeosztázisát
(A) A testhőmérséklet ± a kontroll és a leütéses egerek testhőmérsékletének ± SEM-étkezése (ad libitum (AL)), vagy korlátozott étrend a testtömegnek megfelelő (egyező BW) (n = 5–10). (B) A kontroll- és a kopogtató egerek testtömege ± SEM a vírus infúziója után 6 hétig fix diétát ad libitum táplálékfelvétel alatt. Folyamatos vonalak = GFP-Cbp/flox (vezérlők); fehér sávok = Cre-Cbp/flox (kísérleti). A hipotalamusz relatív transzkriptum bősége ± SEM az nCounter által mért értékek normalizálódnak az ad libitum kontrollhoz. Fehér oszlopok = GFP-Cbp/flox (kontrollok); Szilárd rudak = Cre-Cbp/flox (kísérleti). Egérgének (C) Pomc, (D) Bdnf, (E) Lepr, (F) Irs4 és (G) Gck (n = 8). *, p 3C. ábra), valamint a Bdnf (3D ábra) és más génexpresszió akkor is fennmaradt, ha a testtömegeket kalóriakorlátozással párosított fogyasztás alatt egyeztettük. Kimutatták, hogy mindkét gén csökkent expressziója elhízást és károsodott glükóz homeosztázist okoz, és legalább részben közvetíti az elhízott fenotípusokat a leptinhiányos egerekben [20,22]. A hipotalamusz Pomc és Bdnf csökkenése összhangban volt a leptin receptor (Lepr), az inzulin szignál (Irs4) és a glükokináz (Gck) (3E – 3G ábra) expressziójának csökkenésével, amelyek mind közvetítik a táplálkozási állapotra vonatkozó hipotalamusz válaszokat [23, 24]. Az energiaegyensúlyba bevont más gének, például az Agrp expresszióját nem befolyásolta a hipotalamusz Cbp-jének csökkentése, míg az Npy mérsékelten csökkent (az adatokat nem mutatjuk be).
A hipotalamusz Cbp gátlása olyan transzkripciós profilt eredményez, amely csökkent glükóz metabolizmusra és fokozott lipid metabolizmusra utal
Beszámoltunk arról, hogy az éhezés egy hipotalamusz gén expressziós profilt eredményez, amely jelzi az elmozdulást a glikolízisről a lipid anyagcsere felé és a glükóz metabolizmus alternatív útvonalaira [7]. Összhangban azzal a megfigyeléssel, hogy az éhgyomorra kiváltott hipotalamusz-változások várhatóan elhízott fenotípusokat eredményeznek élelmiszer jelenlétében, a hipotalamusz Cbp gátlása hasonló hipotalamusi elmozdulást eredményezett a glikolízistől (és a glükóz metabolizmusának alternatív útjai felé) és a fokozott lipid anyagcseréhez ( Ábrák (4. és 4., illetve 5., 5. ábra). Amint a 4. ábra mutatja, a hipotalamusz Cbp gátlása olyan génexpressziós profilt eredményez, amely várhatóan csökkenti a glikolízist. Például a Cbp gátlása csökkenti a hipotalamusz érzékenység szempontjából kritikus glükokináz expresszióját Ezenkívül a negatívan szabályozott piruvát-dehidrogenáz markerei (pl. a megnövekedett Pdk4 és a Pdp1 csökkenése) a glikolízisből származó csökkent glükózfelhasználást is javasolják [26]. Továbbá a G6pdx fokozott expressziója és a H6pd elmozdulást jelez a glükóz metabolizmusában a glikolízistől távol a pentóz út felé [27], végül fokozott expresszió a Foxo1, a Hif1a és a Txnip mind megfelelnek a csökkent glikolízisnek [7].
Az egér relatív transzkriptum-relatív mennyisége ± SEM az nCounter által mért értékekkel normalizáltuk az ad libitum kontrollra. Fehér oszlopok = GFP-Cbp/flox (kontrollok); Szilárd rudak = Cre-Cbp/flox (kísérleti). Egérgének (A) Pdk4, (B) Pdp1, (C) G6pdx, (D) H6pd, (E) Foxo1, (F) Hif1a és (G) Txnip (n = 8). *, p 5A – 5C. ábra) vagy peroxiszómák (Crot, Acox3; 5D és 5E. ábra). Az Acyl-Coa tioészterázok családja közvetíti a szabad zsírsavak oxidációját [28]. Így az Acadl, az Acads és az Acadvl jelentős növekedése alátámasztja, hogy a hipotalamusz Cbp gátlása növeli a zsírsav oxidációját (5F – 5H. Ábra). A szabad zsírsav-anyagcsere növekedését potenciálisan közvetítő egyéb gének közé tartozik az Apod és az Apoe, amelyek megkönnyítik a szabad zsírsavak felszabadulását a triacil-gliceridekből [7,29] (5I. És 5J. Ábra).
A hipotalamusz Cpt1a fokozott expressziója növeli a táplálékfelvételt és a testsúlyt, miközben csökkenti a Pomc expresszióját
A Cre-Cbp/flox-ban megfigyelt hipotalamusz transzkripciós profil számos olyan mechanizmusra utal, amelyek révén a Cbp-gátlás elhízott fenotípusokat eredményezhet, többek között károsodott hormonális (pl. Leptin-jelátvitel) vagy megváltozott tápanyagjelzés révén (pl. Glikolízisről lipid-anyagcserére váltás). Számos bizonyíték arra utal, hogy a hipotalamusz ß-oxidációjának gátlása csökkenti a táplálékfelvételt [30–33]. Annak felmérésére, hogy a fokozott hipotalamusz ß-oxidáció utánozza-e a Cbp gátlásának hatásait, a hipotalamusz-karnitin-palmitoil-transzferáz 1A-t (Cpt1a), a lipid-oxidáció sebességét korlátozó [34], a ventromediális hipotalamuszra (VMH) célzott AAV-konstrukcióba infundálták. A Cpt1a fokozott expressziója (6A. Ábra) megnövelte a testtömeget szokásos chow-étrenden, és még inkább magas zsírtartalmú étrenden (6B. Ábra). Az elhízás nem társult hyperphagia-val a chow-diétán, de a megnövekedett hypothalamus Cpt1a hyperphagia-t eredményezett a magas zsírtartalmú étrenden (6.C ábra). A megnövekedett hipotalamusz Cpt1a szintén növelte a vércukorszintet a testtömeg-növekedés előtt (6D. Ábra). Végül a testtömeg-növekedés 2 hetes, magas zsírtartalmú étrend után a megnövekedett kiindulási inzulinnal, a leptinnel és a csökkent hypothalamus Pomc mRNS-sel járt (6E – 6G. Ábra).
(A) Hypothalamicus Cpt1a a kontroll és a túltermelő vírusban (n = 5–7). (B) Ad libitum testtömeg ± SEM az infúzió után 4 héttel mérve chow és magas zsírtartalmú étrendben (n = 8–10). (C) Chow és magas zsírtartalmú ételek bevitele ± SEM infúziók után mérve (n = 12–14) (D) Alapszintű vércukorszint ± SEM infúziók után és különböző étrendeken mérve (n = 12–14). (E, F) Inzulin és leptin ± SEM magas zsírtartalmú étrendben mérve (n = 12–14). (G) Hypothalamicus Pomc átírások ± SEM RT-PCR-rel mérve (n = 10–13). *, p 2B ábra). A hipotalamusz Cbp gátlása a nemtől függetlenül erőteljes, elhízott fenotípusokat okozott, bár a férfiak szignifikánsan nehezebbek voltak, mint a nők (az adatokat nem közöltük). A súlygyarapodás az élelmiszer-bevitel erőteljes megemelkedésével járt együtt legalább 3 héttel az AAV-Cre infúzió után, és az a vizsgálat során fennmaradt (legalább 5 héttel az infúzió után). A csökkent energiafelhasználás az elhízáshoz valószínûleg hozzájárult, amit a csökkent testhõmérséklet jelez, és az elhízás akkor is fennmaradt, amikor az egereket páronként etették a kontrollokhoz (3B. Ábra). Közvetett kalorimetriával végzett további vizsgálatok tisztázhatják ezeket a mechanizmusokat, bár a megfelelő normalizálás továbbra is nagy kihívást jelent az ilyen vizsgálatokban [38,39].
- A testzsír eloszlásának szerepe és az elhízás metabolikus szövődményei
- Metabolikus változások patkányok nyálmirigyében glutamát okozta elhízás esetén
- Metabolikus alkalmazkodás alacsony szénhidráttartalmú fehérjetartalmú étrendhez (’hagyományos’) az ausztráliai
- A testmozgás metabolikus hatása a gyermekkori elhízásra egy jelenlegi nézet - ScienceDirect
- Metabolikus szindróma, elhízás és belső nap