A humanizált kondroitináz ABC szenzibilizálja a glioblastoma sejteket a temozolomidra
Alena Cristina Jaime-Ramirez
1 Neurológiai Sebészeti Osztály, az Ohio Állami Egyetem Átfogó Rákközpont, a James Cancer Hospital és a Solove Research Institute, Columbus, Ohio 43210, USA
Nina Dmitrieva
1 Neurológiai Sebészeti Osztály, Ohio Állami Egyetem Átfogó Rákközpont, The James Cancer Hospital és Solove Research Institute, Columbus, Ohio 43210, USA
Ji Young Yoo
1 Neurológiai Sebészeti Osztály, Ohio Állami Egyetem Átfogó Rákközpont, The James Cancer Hospital és Solove Research Institute, Columbus, Ohio 43210, USA
Yeshavanth Banasavadi-Siddegowda
1 Neurológiai Sebészeti Osztály, Ohio Állami Egyetem Átfogó Rákközpont, The James Cancer Hospital és Solove Research Institute, Columbus, Ohio 43210, USA
Jianying Zhang
2 Biostatisztikai Központ Biomedicina Informatikai Tanszék, Ohio Állami Egyetem Átfogó Rákközpont, The James Cancer Hospital és Solove Research Institute, Columbus, Ohio 43210, USA
Theresa kapcsolat
3 Idegtudományi Doktori Program, az Ohio Állami Egyetem Átfogó Rákközpont, a James Rákkórház és a Solove Kutatóintézet, Columbus, Ohio 43210, USA
Chelsea Bolyard-Blessing
1 Neurológiai Sebészeti Osztály, az Ohio Állami Egyetem Átfogó Rákközpont, a James Cancer Hospital és a Solove Research Institute, Columbus, Ohio 43210, USA
Jeffrey Wojton
1 Neurológiai Sebészeti Osztály, Ohio Állami Egyetem Átfogó Rákközpont, The James Cancer Hospital és Solove Research Institute, Columbus, Ohio 43210, USA
Balveen Kaur
1 Neurológiai Sebészeti Osztály, Ohio Állami Egyetem Átfogó Rákközpont, The James Cancer Hospital és Solove Research Institute, Columbus, Ohio 43210, USA
Társított adatok
Kiegészítő 2. ábra: A Chase N/M beépítésének validálása a HSV vírus gerincébe. A Chase ABC PCR-amplifikációja két OV-Control (OVc1, 2), OV-ChaseN (OVChN1, 2) vagy OV-ChaseM (OVChM1, 2) izolátummal.
Absztrakt
Bevezetés
A rosszindulatú gliomák (GBM-ek) rendkívül agresszívek, a túlélésük mediánja körülbelül 15 hónap. A jelenlegi kezelési módok, amelyek magukban foglalják a műtéti reszekciót, a sugárkezelést és a kemoterápiát, nem sokat tettek a GBM-es betegek életének meghosszabbításáért. A kondroitin-szulfát proteoglikánok (CSPG) kritikus fontosságúak a sejt-sejt és a sejt-extra-sejtes mátrix (ECM) kölcsönhatásai szempontjából, és szerepet játszanak a glioma növekedésében és inváziójában. A kondroitináz (Chase) Az ABC egy bakteriális enzim, amely hasítja a kondroitin-szulfát-diszacharid-láncokat a CSPG-kből a tumor ECM-ben. A vad típusú Chase ABC stabilitása és/vagy aktivitása korlátozott az emlős sejtekben, ezért létrehoztunk egy mutáns, humanizált változatot (Chase M), amely fokozott funkcióval rendelkezik az emlős sejtekben.
Feltételezzük, hogy a sejt-sejt és sejt-ECM kölcsönhatások ChaseM és temozolomid általi megzavarása fokozza a glioma sejtek kemoterápiás elérhetőségét és érzékenységét.
Eredmények
A primer beteg eredetű neuroszférák felhasználásával azt találtuk, hogy a ChaseM csökkenti a glioma neuroszféra aggregációját in vitro. Ezenkívül egy szekretált ChaseM-et (OV-ChaseM) expresszáló onkolitikus HSV-1 vírus fokozta a vírus terjedését és a glioma sejtek elpusztulását, összehasonlítva az OV-Controllal, in vitro. Az OV-ChaseM plusz TMZ kombinatorikus kezelés a glioma sejtek elpusztulásának jelentős szinergetikus fokozódását eredményezte, az apoptotikus sejthalál növekedésével együtt. Az intracelluláris áramlás citometriás elemzése az OV-ChaseM plusz TMZ kezelést követően szignifikáns csökkenést mutatott ki a túlélést elősegítő AKT fehérje foszforilációjában. Végül a koponyán belüli GBM30 glioma xenograftokat hordozó meztelen egereknél az intratumorális OV-ChaseM és TMZ (10 mg/kg szájon át történő szoptatással) kombinációs terápia szignifikáns (p Kulcsszavak: Állatmodell, rák-agy, kemoterápia, génszállítás, HSV, onkolitikus vírusok, tumorbiológia
Bevezetés
A rosszindulatú glioma, a glioblastoma (GBM) a primer agyrák nagyon agresszív és gyakori formája felnőtteknél, akiknek medián túlélése kevesebb, mint 15 hónap (1). A kondroitin-szulfát proteoglikánok (CSPG-k), például a membránhoz társuló CSPG4/NG2, PTPRZ1 és CD44, valamint a lektikán család tagjai, a versican, az aggrecan és a brevican gyakran túlzottan expresszálódnak a gliomában, és szerepet játszanak a glioma sejtek növekedésében, vaszkularizációjában és inváziójában (2, 3). Míg számos tanulmány kimutatta a CSPG-k CS-szegmenseinek funkcionális szerepét a glioma progressziójában in vitro (4, 5), jelentőségük a kemoterápiás szerek, például a temozolomid (TMZ) behatolásának blokkolásában és/vagy a rezisztencia elősegítésében betöltött szerepük tanulmányozták.
Chase Az ABC I (Chase) egy bakteriális enzim, amely depolimerizál különféle CS-glükózaminoglikán (GAG) láncokat, amelyek kovalensen kapcsolódnak a CSPG magfehérjéhez, a magfehérje szerkezetének megváltoztatása nélkül (6). Laboratóriumunk korábbi munkája azt mutatta, hogy a glioma ECM lebontása a Chase bakteriális enzimet expresszáló onkolitikus vírussal (OV) fokozta az OV terjedését és a tumorellenes hatékonyságot in vitro és in vivo (7, 8). A Chase közelmúltbeli molekuláris jellemzése számos lehetséges glikozilációs helyet tárt fel az enzimben, amelyek korlátozhatják az enzimatikus funkciót és/vagy/szekréciót az emlős sejtjeiben (9). Itt számos potenciális glikozilációs hely helyirányú mutagenezisét felhasználva létrehoztunk egy humanizált mutáns Chase (ChaseM) enzimet, amely optimális enzimatikus expressziót és funkciót eredményez az emlős sejtekben. Emellett létrehoztunk egy OV-t, amely expresszálja a ChaseM enzimet, és TMZ-sel kombinálva meghatároztuk annak hatását a glioma sejtekre. A nem reszekálható melanóma T-Vec onkolitikus HSV közelmúltbeli FDA jóváhagyásával új remény merül fel az újszerű kezelési módok vonatkozásában a GBM-es betegek számára (10, 11).
Feltételezzük, hogy a humanizált Chondroitinase ABC (ChaseM) enzimmel történő sejt-sejt vagy sejt-ECM kölcsönhatások megszakítása fokozza a glioma sejtek kemoterápiás elérhetőségét és érzékenységét. A betegből származó neuroszférák felhasználásával azt találtuk, hogy a ChaseM in vitro csökkenti a glioma neuroszféra aggregációját, hasonlóan a CSPG-szerelés farmakológiai blokádjával megfigyelt fenotípussal. Az onkolitikus vírus szekretált ChaseM (OV-ChaseM) fokozta a vírus terjedését és a glioma sejtek elpusztítását az OV-Control-hoz képest, in vitro. Sőt, ez az enzimatikus aktivitás in vivo megmaradt. A TMZ-szel kombinálva az OV-ChaseM a glioma sejtek elpusztulásának jelentős és szinergetikus fokozását eredményezte az OV-Control plusz TMZ-hez képest, és jelentősen csökkentette a túlélést elősegítő AKT fehérje foszforilációját. In vivo az OV ‐ ChaseM plusz TMZ a túlélés szignifikáns növekedését eredményezte az önmagában TMZ-vel vagy OV-ChaseM-mel kezelt egerekhez képest. Összességében ezek az adatok azt mutatják, hogy az OV ‐ ChaseM fokozza a glioma sejt vírusérzékenységét és érzékenységét a TMZ iránt, és megalapozzák a klinikában végrehajtandó új kezelési ütemeket.
Anyagok és metódusok
Sejtvonalak és reagensek
Humán glioma sejteket (U87AEGFR, LN229, Gli36AEGFR-H2B-RFP, U251) és Vero sejteket tenyésztettünk a korábban leírtak szerint (7). Az elsődleges glioblastoma eredetű sejteket (GB9, GB9-GFP és GBM30) az Ohio Állami Egyetemen állítottuk elő, vagy a Mayo Clinic (X12) szívesen biztosította, és neuroszféra tenyészetekben tartották fenn (7, 12). A Cos-7 sejteket az ATCC-től (Manassas, VA) szereztük be, és ennek megfelelően tenyésztettük. A sejteket morfológia és növekedési változások szempontjából rutinszerűen követtük nyomon. A kondroitináz ABC-t (Chase ABC), a metil-P-D-xilopiranozidot és a temozolomidot (TMZ) a Sigma-Aldrich-től (St. Louis, MO) szereztük be. A kondroitin-szulfát A-t (CS A) a Seikagaku Biobusiness Corp-tól (Japán) szereztük be. Egér monoklonális anti-CS-4 antitestet (BE-123 klón, Millipore, Temecula, CA) alkalmaztunk a Chase funkcionalitás vizsgálatára. A tripán kék kizárást a Cell Countess (Life Technologies, Inc., Carlsbad, CA) alkalmazásával határoztuk meg a glioma sejtproliferáció meghatározásához.
ChaseM generáció és vírusok
A vad típusú Chase ABC klónozását és felépítését korábban leírták (7). A (9) pontban leírt G1, G2, G3 és G5 primereket használtuk a kondroitináz ABC I cDNS kiválasztott N-glikozilációs helyeinek mutációjához a QuickChange Lightning Multi Site-Directed Mutagenesis Kit segítségével (Agilent Technologies, La Jolla, Kalifornia. Mutant Chase ABC cDNS-t használtunk OV-ChaseM vírusok előállításához, a korábban leírtak szerint (7).
Az aktív Chase ABCI szekréciójának tesztjei in vitro és in vivo
A Chase ABC in vitro aktivitásának meghatározásához a Cos-7 sejteket pcDNA3.1 ChaseN vagy ChaseM plazmidokkal transzfektáltuk FuGENE 6 transzfekciós reagens alkalmazásával (Roche Applied Science Inc., Indianapolis, IN). 24 óra elteltével U87AEGFR koncentrált táptalajt (CSPG-k forrása) adtunk a Cos-7 transzfektált sejtekhez. Negyvennyolc óra múlva a Cos-7 sejtek táptalaját összegyűjtöttük, Western Blot analízissel koncentráltuk, majd BE-123 antitest segítségével elemeztük, amely felismeri a Chase ABC enzimmel végzett CSPG emésztés után visszamaradt CS csonkokat (7 A Chase ABC aktivitás in vivo értékeléséhez a GB9-GFP pozitív glioma sejteket 5 ug pcDNA3.1 LacZ vagy ChaseM alkalmazásával elektroporáltuk Amaxa Mouse Neural Stem Cell Nucleofector Kit (Lonza, Walkersville, MD) alkalmazásával. Ezeket a sejteket ezután az atmikus meztelen egerek striatumába injektáltuk, az előzőekben leírtak szerint (300 000 sejt/egér és 3 egér minden állapotban) (7). Az implantáció után hét nappal a daganatokat összegyűjtöttük, 4% PFA-ban rögzítettük, és megvizsgáltuk a BE-123 reaktivitást (7).
Összesítés és vizsgálatok
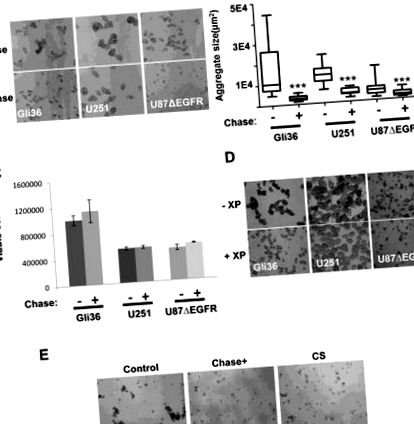
Az U87ΔEGFR, Gli36 AEGFR, U251 sejteket egysejtűekként 6 vagy 24 üreges ultra alacsony kötődésű lemezekre (Corning, NY), 2% FBS-sel vagy neuroszféra tápközeggel kiegészített DMEM tápközeggel szélesztettük. A sejteket ezután 37 ° C-os rázó inkubátorban 48 órán át inkubáltuk 0,015 U/ml Chase ABC vagy 5 uM metil-P-D-xilopiranozid jelenlétében, amelyet 24 óránként feltöltöttünk. CS A-t (0,2 μg/μl) adtunk az U87ΔEGFR sejtekhez 48 órán át, és a sejtek aggregációját Nikon Eclipse TE2000-U fluoreszcens mikroszkóppal követtük nyomon. A képeket 4-10 reprezentatív nézőtérből készítettük, és az aggregátumok/neuroszféra átmérőket Image J szoftver segítségével mértük a terület kiszámításához. A GBM30 vagy X12 glioma sejteket ChaseN, ChaseM vagy kontroll plazmiddal (5 μg) transzfektáltuk az Amaxa Mouse Neural Stem Cell Nucleofector Kit (Lonza, Walkersville, MD) alkalmazásával, OV-Control, OV-ChaseN vagy OV- A ChaseM-et 0,005 MOI-n, és három ismétlésben 96 lyukú lemezekre oltjuk, hogy értékeljük a Chase ABC neuroszféra-kultúrára gyakorolt hatását 72 órás tenyésztés után fénymikroszkóppal.
Áramlási citometriás elemzés
Az összes áramlási citometriás elemzést egy Becton Dickinson fluoreszcenciával aktivált sejtválogató (FACS) LSRII (Becton-Dickinson, San Jose, Kalifornia) segítségével végeztük, és a FlowJo szoftver (Ashland, OR) segítségével elemeztük, ahogyan azt korábban leírtuk (13). Az onkolitikus vírusos GFP-t X12 glioma sejtek alkalmazásával értékeltük, amelyeket a fertőzés különféle sokaságán (MOI) kezeltünk, és a fertőzés után öt nappal gyűjtöttük össze. A sejteket ezután 1% formalinban rögzítettük, és meghatároztuk a GFP pozitív sejtek százalékos arányát. Huszonnégy órával az OV fertőzés után a glioma sejteket TMZ-vel kezeltük, és öt nappal később összegyűjtöttük. Az elhalt sejtek százalékos arányát ezután egy Live/Dead Fixable Dead cell festékkészlettel (Invitrogen, Carlsbad, CA) számszerűsítettük a gyártó utasításainak megfelelően. A sejtek apoptózisát az Annexin V-V450 és a 7AAD (BD Biosciences Pharmingen, San Diego, CA) alkalmazásával határoztuk meg a gyártóval összhangban. Az intracelluláris pAKTSer473-BV421 festést (BD Biosciences Pharmingen, San Diego, Kalifornia) a gyártó jelzése szerint hajtottuk végre. Az átlagos fluoreszcencia intenzitást (MFI) úgy számítottuk ki, hogy a pAKT-vel festett minták görbe alatti területét kivettük, miután kivontuk a görbe alatti területet az egyes kezelési csoportok megfelelő izotípusú festett kontrolljaihoz.
Állatkísérletek
Az összes rágcsálóvizsgálatot az Ohio Állami Egyetem Állattenyésztési Kutatási Albizottságának irányelveivel összhangban tartották és kezelték, és azokat az Intézményi Felülvizsgálati Testület hagyta jóvá. Az összes koponyán belüli daganatvizsgálat során 6-8 hetes atymás nu/nu egereket (Target Validation Shared Resource, The Ohio State University) érzéstelenítettünk és sztereotaktikus készülékbe rögzítettünk. Ezután sorjázó furatot fúrtak 2 mm-re oldalirányban a bregma felé 3 mm mélységig, a korábban leírtak szerint (7). A GBM30 kísérletekhez n = 5 atmikus meztelen egeret ültettek be 100 000 tumorsejtbe, majd az implantáció után hét nappal 3 × 105 pfu OV-ChaseM-mel kezelték. Az egereket 10 mg/kg TMZ-vel kezeltük a 8-12. Napon a szájon át történő szondával tumor implantátum után. Az állatokat naponta megfigyeltük, és eutanizálták őket, amikor daganatos terhelés tüneteit mutatták, például súlycsökkenést és/vagy görnyedt testtartást. Az állatkísérleteket két példányban hajtották végre.
Statisztikai analízis
Statisztikai elemzéshez a GraphPad Prism 6-ot (GraphPad Software, Inc., La Jolla, Kalifornia), az R3.3.1-et (R Foundation for Statistics Computing, Bécs, Ausztria) és a SAS 9.3-at (SAS Institute, Cary, NC) használták. A normális eloszlást követő folyamatos méréshez, például a sejtproliferációhoz és az aggregációhoz kétmintás t tesztet alkalmaztunk két független állapot összehasonlítására. Három vagy több feltétel összehasonlítására egyirányú ANOVA modellt alkalmaztak. Kétirányú ANOVA modellt alkalmaztunk interakciós kontraszt vagy szinergikus hatásvizsgálatokhoz. A túlélési adatokhoz a túlélési funkciókat Kaplan-Meier módszerrel becsültük meg, és a csoportok között összehasonlítottuk a log-rank teszttel. A p értéket több összehasonlításhoz igazítottuk Holm eljárásával. A 0,05 vagy annál kisebb p értéket statisztikailag szignifikánsnak tekintettük.
Eredmények
A kondroitináz ABCI csökkenti a neuroszféra képződését a glioma sejtvonalakban és a beteg eredetű neuroszférákban
A jelzett glioma sejtek reprezentatív képei, amelyeket transzfektáltunk béta-galaktozidázt (kontroll), vad típusú normál Chase (Chase N) vagy humanizált mutáns Chase (Chase M) kódolásával. B. A Cos-7 emlős sejteket ChaseN (módosítatlan Chase DNS) vagy ChaseM (Mutant Chase) kódoló plazmidokkal transzfektáltuk, majd U87AEGFR glioma sejtekből származó koncentrált táptalajjal (CSPG-k forrása) 48 órán át tenyésztettük. A Cos-7 sejttenyésztő táptalajt ezután betöményítettük és CS stub Western Blot analízisnek vetettük alá BE123 antitestklón alkalmazásával. Az immunreaktivitás a Chase enzimatikus hasítási aktivitását jelzi. C. A tumort hordozó agyszelvények immunfluoreszcens képei egerekből, amelyekbe zöld fluoreszcens fehérje (GFP) pozitív GB9 tumorsejteket ültettek be (zöld színnel jelölték), átmenetileg transzfektáltak pcDNA3.1 LacZ kontroll vagy pcDNA3.1 ChaseM plazmidokkal és BE123 CS csonkfelismerő antitesttel festették (CSPG hasítási festés piros színnel). Méretarány = 100μm. Az összes in vitro és in vivo kísérletet n> 3 triplikátum alkalmazásával hajtottuk végre, legalább három független ismétlésben.
Asztal 1
A mutáns Chase ABC relatív vad típusú Chase ABC-ben létrehozott mutált aminosavak listája. A Chase enzim mutációs helyei mutáns DNS-t fejlesztettek ki a Chase enzim (ChaseM) humanizált formájának előállítására. A ChaseM szekvenciát megelőzte egy humán IgG κ-lánc vezető szekvencia a szekréció fokozása érdekében, és öt potenciális N-glikozilációs hely mutálódott (N282Q, N338Q, N345Q, S517Q és N675Q).
| Nincs Leader sorrend | IgGκ szekréciós jel |
| 282N | 282Q |
| 338N | 338Q |
| 345N | 345Q |
| 517N | 517Q |
| 675N | 675Q |
Az onkolitikus vírus (OV) egy funkcionális ChaseM enzimmel fokozza a vírus terjedését és a glioma sejtek elpusztítását
Az OV-ChaseM fokozza a temozolomid (TMZ) által kiváltott apoptotikus sejtek elpusztítását a glioma neuroszférákban
Köszönetnyilvánítás
Szeretnénk elismerni az analitikus citometriával megosztott erőforrást, a Biostatisztikai Központot és a cél-hitelesítés közös erőforrásait a James Átfogó Rákközpontban az Ohio Állami Egyetemen.
Támogatás támogatása: Ezt a munkát az R01 NS064607, a P01 CA163205, az R01 CA150153 és a P30 CA016058 (BK), F32 (F32CA186542) (ACJR) és a T32> CA009338 (CBB) támogatta. Pelotonia posztdoktori ösztöndíj (ACJR) és az ACS az IRG-67-003-50 (JYY) ösztöndíjat.
Lábjegyzetek
A lehetséges összeférhetetlenség nyilvánosságra hozatala
Potenciális összeférhetetlenséget nem hoztak nyilvánosságra.
- Anyagcsere-takarítás a sejtjeihez Cédrus-Sínai-félsziget
- Hogyan segíthet zsíros halak fogyasztása a fogyásban a zsírsejtek átalakításán keresztül - Mirror Online
- Hogyan irányítja a figyelem az idegsejtek csoportjait az agy szimfóniájának gazdagítására - ScienceDaily
- Jordan Bruttó átalakulás 305 fontról 235-re 7 hónap alatt Charlotte Observer
- Otthoni fogyókúra Fogyókúrás üléstámasz segíti a hasi edző fitnesz Equ