A hüvelyi mikrokörnyezet: A lactobacillusok fiziológiai szerepe
Absztrakt
Bevezetés
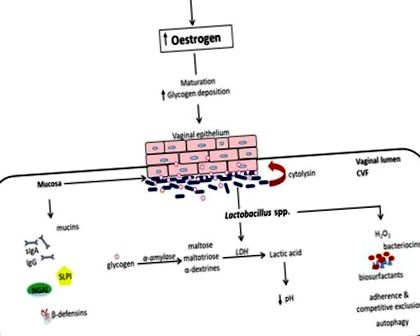
A hüvely nyálkahártya-ökoszisztémája egy rétegzett laphám nem keratinizált hámból áll, amelyet egy nyálkahártyaréteg fed le, amelyet folyamatosan cervicovaginális folyadék (CVF) ken. Ezek együttesen félelmetes fizikai és biokémiai akadályt képeznek a behatoló idegen szervezetek ellen. Amellett, hogy savas közeg, antimikrobiális molekulák széles választékát tartalmazza, beleértve az antitesteket (IgA és IgG), a mucinokat, a β-defenzineket, a szekréciós leukocita proteáz inhibitorokat (SLPI), a neutrofil zselatinázzal társított lipokalinokat (NGAL), a felületaktív fehérjéket stb., A CVF is megkönnyíti az exogén organizmusok bezárását (összefoglalva az 1. ábrán) 1) (1–3).
A hüvely számos mikroorganizmust is tartalmaz (a „mikrobiota”), amelyek (génjeikkel és termékeikkel együtt) szabályozott kölcsönös kapcsolatban állnak a gazdával (a „mikrobiom”) (4). Ezen mikroorganizmusok közül néhány, például a Lactobacillus fajok, opportunista kórokozókkal fokozzák a védelmet az invázióval és a gyarmatosítással szemben. A hüvelyi mikrobiota/mikrobioma összetétele dinamikus, és a hormonális ingadozásoknak megfelelő változásokon megy keresztül a nő reproduktív életében, azaz a pubertástól a menopauzáig és a terhesség alatt (5).
A normál fiziológiai hüvelyi mikrobiotát 1892-ben Albert Döderlein homogénnek írta le, amely csak gram-pozitív bacillusokból (Doderlein-bacillusok) (6) áll, amelyekről úgy gondolják, hogy a bélből származnak, és jelenleg ismertek a Lactobacillus nemzetség részeként (7). ). Ennek az egyedülálló hüvelyi mikrobiomnak az evolúcióját két evolúciós hipotézis támasztja alá: a „betegség kockázat hipotézise” (8, 9) és a „szülészeti védelem hipotézise” (9), amelyek arra utalnak, hogy az emberi hüvelyben szelektíven dominálnak a védő Lactobacillus fajok mert az emberek fogékonyabbak a nemi úton terjedő betegségekre; valamint a terhesség és a szüléssel összefüggő mikrobiális szövődmények nagyobb kockázata (8–10).
Számos védő Lactobacillus faj uralja az egészséges hüvelyi mikrobiotát a legtöbb reproduktív korú nőnél. A DNS-szekvenálási technikák legújabb fejleményei kimutatták, hogy a hüvelyi mikrobiotában a domináns Lactobacillus fajok közé tartozik az L. crispatus, az L. gasseri, az L. iners és az L. jensenii, míg más anaerobok, így a Gardnerella, az Atopobium, a Mobiluncus, a Prevotella, a Streptococcus, az Ureaplasma, Megasphaera stb., Amelyek képesek fertőzéseket okozni, mint például a bakteriális vaginosis (BV), a laktobacillusok védő hatása szunnyadó. Ezek a nagy felbontású technikák lehetővé tették a hüvelyi mikrobiota öt közösségi állapottípusba (CST) történő besorolását, a CSTI, II, III és V dominálják L. crispatus, L. gasseri, L. iners és L. jensenii, míg A CSTIV-ben a vegyes anaerobok dominálnak, hasonlóak a BV-ben találhatókhoz (5, 11).
Ezeknek az élőlényeknek a hüvelyi mikrobiotában való előfordulása különböző faji/etnikai csoportokban és biogeográfiai helyeken változik, a feketék és a spanyolok anaerob baktériumfajokkal (CSTIV) rendelkeznek, és magasabb hüvelyi pH-értéket mutatnak klinikai fertőzés jelenlétében vagy hiányában (11, 12) . A prevalencia különbségei összefüggenek az életmódbeli különbségekkel (11) és a gén-környezet kölcsönhatásokkal (12) is. A test belső zsigereitől, például a bélektől eltérően a hüvelyi mikrobiota megnövekedett sokfélesége a fokozott betegség iránti fogékonysághoz és a negatív reproduktív eredményekhez kapcsolódik (5, 13).
Az ösztrogén hatása a hüvely ökoszisztémájára
A prepubertális hüvelyi mikrobiomban anaerobok, E. coli, difteroidok és koaguláz-negatív Staphylococcusok és lényegesen kevesebb glikogén dominál (5). Pubertáskor az emelkedő ösztrogénszint elősegíti a glikogén érését, szaporodását és felhalmozódását a hüvelyi hámsejtekben. A glikogént az emberi α-amiláz katabolizálja maltózzá, maltotriózzá és α-dextrinekké, amelyeket aztán a Lactobacillus fajok tejsavvá metabolizálnak (1. ábra). Ez savas környezetet (pH, 3,5–4,5) hoz létre, amely elősegíti a Lactobacillusok növekedését más anaerob baktériumfajok kárára (1, 5). A laktobacillusok dominanciája csökken, mivel a menopauza után csökken az ösztrogénszint (16), és nő a hüvelyi ösztrogénpótló kezeléssel.
A hüvelyi mikrobiotában normál terhességben a Lactobacillusok dominálnak, és stabilabb, mint a nem terhes állapotban (12, 17, 18). Ez a terhesség alatti magas ösztrogénszinttel magyarázható, ami fokozott hüvelyi glikogén lerakódást eredményez, ami fokozza a Lactobacillusok által uralt hüvelyi mikrobiota szaporodását (2). Szintén tanulmányok kimutatták, hogy a menstruáció jelentősen reverzibilisen megváltoztatja a hüvely mikrobiális sokféleségét, az L. crispatus körülbelül százszoros csökkenésével és az L. iners, G. vaginalis, P. bivia és A. vaginae növekedésével (19, 20) . Lényegében a reproduktív korú nők normális savas hüvelyi pH-ját az ösztrogén, a glikogén és a Lactobacillusok hajtják (1, 21–23).
Érdekes közvetlen összefüggésről számoltak be a hüvelyi ostrogenizáció és a candidiasis között posztmenopauzás nőknél is (24). A menopauza után az ösztrogén indukálta hüvelyi epitheliális glikogén felhalmozódása a Candida albicans fokozott fertőzésével jár, amelynek fő szubsztrátja a glikogén. Ezzel ellentétben a premenopauzás nőknél a C- fertőzött nőknél csökkent az a-amiláz aktivitása, amely korrelál a D- (de nem L-) tejsavval, valamint az SLPI, NGAL, hyaluronidase-1 és a mátrix metalloproteinase (MMP) -8 termelődése. albicans (25). Az extracelluláris mátrixot lebontó enzimek - a hialuronidáz-1 és az MMP-8, a tejsav és a citolizin fokozhatja az α-amiláz aktivitást a glikogén hozzáférhetőségének fokozódása miatt, ami a glikogénben gazdag hámsejtek hüvelyi lumenbe történő lízisét eredményezi. A hüvelyi ostrogenizáció, a glikogénszint és a candidiasisnak a menopauza állapotához viszonyított hatása valószínűleg fiziológiai jelentőségű, és további vizsgálatot igényel.
Lactobacillusok, hüvelyi homeosztázis sine qua non
A hüvelyi tejsav túlnyomórészt bakteriális eredetű (26). Az ösztrogén hatására a hüvelyi hám 3,86-os pH-n termel + értéket. A tejsav protonált formájában membránáteresztő és a laktátaniontól eltérően nem igényli a protonhoz kötött monokarboxilát transzportereket vagy a laktátot kötő GPR81 receptorokat a sejtekbe való bejutáshoz (37, 38). A tejsav előnyben részesíti a Lactobacillus fajoktól eltérő baktériumok lizálását (23, 36); és baktériumsejt pusztulást okoz a citoszol megsavanyításával, az intracelluláris funkció megzavarásával (39), növelve a sejtmembrán H2O2, diacetil stb. permeabilitását, ezáltal erősítve más anyagok antimikrobiális hatását (40). A tejsav csökkent antimikrobiális aktivitása és a nem védett nemi közösüléssel és menstruációval járó fertőzések fokozott kockázata annak tulajdonítható, hogy a hüvely pH-ja megnő a szemed folyadék lerakódása és a menstruáció áramlása után, ami több laktát-anion képződéséhez vezet, amely kevesebb antimikrobiális hatású és immunmoduláló tevékenységek (33, 36).
Ezenkívül a hüvelyi ökoszisztéma számára biztosított védelem mértéke a domináns Lactobacillus fajtól függ. Például egy L. iners által dominált hüvelyi mikrobiota általában diszbiózissal társul, kevésbé stabilnak és hajlamosabbnak az átmenetre. Ezzel szemben a D- és az L-tejsavat egyaránt termelő L. crispatus a hüvelyi közösség fokozott stabilitásával (kevésbé valószínű, hogy a dysbiosisba átjut) és az egészséggel jár (19, 52, 53). Az L. iners pórusképző koleszterin-függő citolizinjén (CDC, inerolizin) keresztül patogén hajlamot mutat (54, 55). Kicsi a genomja, és nem képes D-tejsavat és H2O2-t előállítani, amelyek az eubiosis elősegítéséhez szükségesek, ellentétben a többi Lactobacillus fajtával (3, 13). Nemrégiben azt is megfigyeltük, hogy az L. jensenii (amely csak a D-tejsavat termeli és az L. crispatushoz képest kisebb védőkapacitást termel) túlsúlya (27) a laktát, a szukcinát csökkenésével és az idő előtti szállítás kockázatának növekedésével járt (56). ).
A mikrobiális aktivitás hatása a hüvely nyálkahártya gát funkciójára
Stressz és hüvelyi egészség
Aberrant hüvelyi mikrobiota (dysbiosis)
A hüvelyi mikrobiota egy változatos baktériumfajok dinamikus közössége, amely mind belső, mind külső manipulatív ingereknek van kitéve, például a nemi hormon szintjének és a menstruációs ciklus stádiumának változásai, a szexuális aktivitás, az antibiotikum terápia és az orális fogamzásgátlók használata, hüvelyi douching, menopauza, terhesség, szoptatás, diabetes mellitus és stressz. A hüvelyi mikrobiota összetételét a gén-környezet kölcsönhatások is meghatározzák. A hüvelyi baktériumközösségekről, amelyekben nincs magasabb Lactobacillus dominancia, magasabb pH-értékkel és alacsonyabb H2O2-értékkel, normálnak találtak fekete és spanyol nőknél (11, 52, 60, 61).
A reproduktív korú nőknél a leggyakoribb hüvelyfertőzés a bakteriális vaginosis (BV). Az 5–70% -os előfordulási aránnyal rendelkező BV-t (62) a laktobacillusok kimerülése jellemzi olyan potenciálisan patogén vegyes anaerobok javára, mint a Gardnerella, Atopobium, Mobiluncus, Prevotella, Streptococcus, Mycoplasma, Ureaplasma, Dialister, Bacteroides stb. (63–65). Heterogénebb hüvelyi környezetet hoz létre, csökkenő tejsavszint mellett (pH> 4,5) és az anaerobok által előállított rövid szénláncú zsírsavak (SCFA), például acetát, butirát, propionát és szukcinát nagy mennyiségében. Bár nyilvánvaló gyulladásos válasz gyakran nem nyilvánul meg, az immunmediátorok, például az IL-1β, az IL-2, az IL-6, az IL-8, az IL-10, a TNF-a, az interferon (IFN) megnövekedett szintjével társul. -γ, RANTES stb. (1, 5), és csökkent az antimikrobiális peptidek, például az NGAL koncentrációja (47). A BV egy rejtélyes szindróma, amelynek etiológiája azonosítatlan. A legtöbb BV-pozitív nő általában tünetmentes. A tünetek azonban nem viszkető, de irritáló, krémes hüvelyi váladék formájában jelennek meg, halszaggal, amely hangsúlyosabb lehet nemi aktus után és a menstruáció során.
Az Amsel-kritériumokat használják a BV diagnosztizálására a legtöbb klinikai körülmények között. A kritériumok között szerepel a hüvely savasságának értékelése, a hüvelyi váladék jelenléte, a nyomsejtek megjelenése (anaerob baktériumokkal kirakott deszkamált hüvelyi hámsejtek) és egy pozitív „whiff teszt” (jellegzetes „halszerű” szag, amelyet akkor észlelnek, amikor 10% kálium hidroxidot adunk a hüvelyváladék mikroszkópos tárgylemezéhez) (66). A legérzékenyebb kritériumok a hüvelyi pH (> 4,5), valamint a vékony, homogén, tejszerű és tapadó váladék kimutatása (97%), ha a kritériumokat egyenként értékeljük (67). A kisülés kimutatásának azonban alacsony volt a specificitása (26%) és a pozitív prediktív értéke (27%), míg a legmagasabb specificitású kritérium a nyomsejtek jelenléte volt (86%). Ha együttesen alkalmazzuk, akkor legalább három kritérium jelenléte jelentősen megnöveli a BV pontos diagnosztizálásának valószínűségét, 97, illetve 90% -os érzékenységet és specifitást eredményezve (67, 68).
A kutatási térben a BV-t általában a Nugent pontozási rendszerrel diagnosztizálják (69). Bár a diagnózis tapasztalt laboratóriumi személyzetet igényel a tárgylemezek értékeléséhez, objektívebb és megbízhatóbb, az Amsel-kritériumokhoz képest magasabb reprodukálhatósággal és érzékenységgel rendelkezik (70 A Gram-foltot alkalmazza, hogy mikroszkóposan azonosítsa a hüvelyi mikrobiota elmozdulását az egészséges laktobacillusok dominanciájáról (Gram-pozitív pálcák) a kevert Gram-negatív/változó mikrobiota (Gardnerella és Bacteroides) közepes szintjére, a laktobacillusok hiányára és a Gram-negatív/változó rudak vagy ívelt rudak (Mobiluncus) (68, 69). A 0–3 pontszám összhangban áll a lactobacillus dominanciával és a hüvely egészségi állapotával, a 4–6 pontszám egy közepes, vegyes hüvelyi baktériumközösséget, míg> 7 a BV fertőzést jelez. Jó összefüggés van a BV klinikai jellemzői és a Gram-folt pontszámok között (70).
A BV az STI, mint például az N. gonorrhoea, a C. trachomatis, a T. vaginalis, a HSV, a HPV és a HIV megszerzésének megnövekedett kockázatával jár együtt, és más fertőzésekkel, például kismedencei gyulladással, endometritiszel, chorioamnionitisszel és magzatvíz fertőzéssel. A terhesség kapcsán úgy tűnik, hogy a BV összefügg a membrán korai idő előtti repedésével (PPROM), a koraszüléssel (PTL) és a koraszüléssel (PTB, azaz a 37 teljes terhességi hét előtti szüléssel) (62, 71–81).
A hüvelyi dysbiosis aerob vaginitisként (AV) is megnyilvánulhat. A normál hüvelyi Lactobacillus által uralt mikrobiota ugyanolyan bomlasztó fertőzése, de nyilvánvaló gyulladás, leukocita és parabasalis sejtek beszivárgása és enterális aerob baktérium organizmusok, köztük Escherichia coli, Enteroccoci, Staphylococcus aureus és B csoport Streptococcus szaporodása jellemzi (21, 82 ). A BV aerob ekvivalenseként írták le a kimerült Lactobacillus dominancia miatt másodlagos tejsavkoncentráció miatt. Mivel azonban nincsenek anaerobok, a szukcinátkoncentráció alacsony. Az AV olyan STI-kkel is társult, mint a C. trachomatis, az N. gonorrhoeae és a T. vaginalis. Az AV klinikai jellemzői a következők: vörös hüvelyi nyálkahártya-gyulladás, megnövekedett IL-1β és IL-6, hüvelyi pH> 6, viszketés és égés (viszketés), dyspareunia és sárgás ragacsos váladék, amely nem tartalmaz halszagot. Az AV a nők 2–25% -ában van jelen, és súlyos negatív nőgyógyászati és szülészeti kimenetelekkel társult, beleértve a növekvő genitális fertőzést/gyulladást, a PPROM-ot, a PTL-t és a PTB-t (83, 84).
A rendellenes hüvelyi mikrobiota következményei az emberi terhességre
A hüvelyi miliő fiziológiai állapota döntő fontosságú nemcsak a gazda általános közérzete szempontjából, hanem a terhesség fogantatása és esetleges sikere szempontjából is. A Lactobacillus azon képességét, hogy megakadályozza a hüvelyi tér kórokozók általi invázióját és gyarmatosítását anélkül, hogy nyilvánvaló gyulladásos választ váltana ki, toleranciának nevezzük, és különösen hasznos a szaporodás szempontjából (3). A fogadó nemi fertőzések iránti érzékenységének és egyéb nőgyógyászati betegségeknek, beleértve a méhnyak intraepithelialis neoplasia és a méhnyakrák (85–87), fokozott érzékenysége mellett a diszbiotikus hüvelyi mikrokörnyezet is lecsökkent laktobacillusok által közvetített toleranciával és gyulladáscsökkentő mechanizmusokkal befolyásolja a terhesség lefolyását és eredményét. Lényegében a Lactobacillus spp. felbecsülhetetlen a homeosztatikus hüvelyi miliő megőrzése szempontjából.
Fogantatás és vetélés
Koraszülöttség
A fertőzés/gyulladással összefüggő koraszülés és születés patogenezise. A női genitális traktus kolonizációja a kórokozó anaerob baktériumok által a megváltozott hüvelyi mikrobiota következtében előremutató gyulladásos reakciót vált ki, amely végső soron stimulálja a koraszülés és a szülés, azaz a méh összehúzódásának, a méhnyak átalakításának és a membrán aktiválásának útját. CRH, kortikotropin-felszabadító hormon; IL, interleukin; MIAC, a magzatvíz mikrobiális inváziója; PGE2, prosztaglandin E2; PGF2a, prosztaglandin F2a; TNF, tumor nekrózis faktor.
Következtetés
Szerzői hozzájárulások
Ezt az áttekintést az EA és a DA egyaránt megtervezte, lefolytatta, megírta és felülvizsgálta. Mindkét szerző jóváhagyta a végleges kéziratot.
Összeférhetetlenségi nyilatkozat
A szerzők kijelentik, hogy a kutatást bármilyen kereskedelmi vagy pénzügyi kapcsolat hiányában végezték, amely potenciális összeférhetetlenségként értelmezhető.
- A kurkumin szinergikus szerepe a jelenlegi terápiákkal a vastagbélrák minikérdésében
- A császármetszésből született csecsemők hüvelyfolyadékkal történő törlése potenciálisan nem biztonságos és felesleges - ScienceDaily
- A magas zsírtartalmú Hep C étrend A vitaminok megerősítésének szerepe az elhízás járványában
- A magas zsírtartalmú étrend szívizomfibrózist vált ki az anyagcserében egészséges, elhízott minicsírákban - A szerep
- A méh zsugorodik egy hüvelyi születés után - Anya és Ők