A HVC1 hipolipidémiás hatása magas koleszterinszintű étrend által kiváltott hiperlipidémia patkánymodellben
Chae-Yun Kim
1 Farmakológiai Tanszék, Keleti Orvostudományi Főiskola, Sangji Egyetem, Wonju, Gangwon-do 220702
Kyung-Sook Chung
1 Farmakológiai Tanszék, Keleti Orvostudományi Főiskola, Sangji Egyetem, Wonju, Gangwon-do 220702
Se-Yun Cheon
1 Farmakológiai Tanszék, Keleti Orvostudományi Főiskola, Sangji Egyetem, Wonju, Gangwon-do 220702
Kyungjin Lee
2 Gyógyászati Tanszék, Koreai Orvostudományi Főiskola, Kyung Hee Egyetem, Szöul 130701
Inhye Ham
2 Gyógyászati Tanszék, Koreai Orvostudományi Főiskola, Kyung Hee Egyetem, Szöul 130701
Ho-Young Choi
2 Gyógyászati Tanszék, Koreai Orvostudományi Főiskola, Kyung Hee Egyetem, Szöul 130701
Yong Baik Cho
3 Gyógyszerészeti K + F Központ, Kolmar Korea Co. Ltd., Sejong 339853, Koreai Köztársaság
Byoung-Heon Cho
3 Gyógyszerészeti K + F Központ, Kolmar Korea Co. Ltd., Sejong 339853, Koreai Köztársaság
Tehát Youn Mok
3 Gyógyszerészeti K + F Központ, Kolmar Korea Co. Ltd., Sejong 339853, Koreai Köztársaság
Hyo-Jin An
1 Farmakológiai Tanszék, Keleti Orvostudományi Főiskola, Sangji Egyetem, Wonju, Gangwon-do 220702
Absztrakt
A négy gyógynövényt tartalmazó új képződményt, a HVC1-et fejlesztették ki, és hipolipidémiás hatásait magas koleszterintartalmú étrend (HCD) által kiváltott hiperlipidémiában szenvedő patkányokban vizsgálták. A patkányoknak 8 hétig HCD-t adtak. A HVC1-vel kezelt csoportoknak orálisan adták a HVC1-et 10, 50 vagy 250 mg/kg dózisban, a szimvasztatin csoportot pedig 10 mg/kg dózisban kezelték. A normál étrendet és a HCD kontrollcsoportokat fiziológiás sóoldattal adtuk be. A HVC1 (10, 50 vagy 250 mg/kg) orális beadása jelentősen csökkentette a hiperlipidémiában szenvedő patkányok testtömegét, és szabályozta a szérum összes koleszterinszintjét, alacsony sűrűségű lipoprotein koleszterin és nagy sűrűségű lipoprotein koleszterin szintjét. Ezenkívül a szöveti elemzés feltárta, hogy a májban és az aortában a lipidfelhalmozódás csökkent a HVC1 alkalmazásával. Továbbá a HVC1 jelentősen csökkentette a peroxiszóma proliferátor-aktivált receptor-y, 3-hidroxi-3-metil-glutaril-CoA reduktáz és alacsony sűrűségű lipoprotein receptor mRNS-expresszióját, valamint az 5'-adenozin-monofoszfát-aktivált protein-kináz fehérje szintjét a máj. Az eredmények egyértelműen bizonyítják, hogy a HVC1-nek erős hipolipidémiás hatása van, és azt sugallják, hogy a HVC1-t a hiperlipidémia lehetséges kezeléseként kell értékelni.
Bevezetés
A hiperlipidémia a rendellenességek csoportja, amelyet a keringő lipidek, köztük a koleszterin, a koleszterin-észterek, a foszfolipidek és a trigliceridek magas koncentrációja jellemez. Gyakran késleltetett vagy hibás clearance-ből, vagy a nagyon alacsony sűrűségű lipoprotein (VLDL) túltermeléséből származik a májban, amely ezt követően alacsony sűrűségű lipoproteinné (LDL) alakul át. A telített zsírok túlzott bevitele növeli a máj lipidtermelését a fehérje aktivátorait érintő molekuláris mechanizmus révén (1). Különösen a hiperlipidémia az érelmeszesedés és a szív- és érrendszeri betegségek, köztük a szívkoszorúér-betegség fő módosítható kockázati tényezője.
Korábbi adatok alapján a HVC1-t hiperlipidémiás betegségek kezelésére vagy megelőzésére fejlesztették ki (15), és a jelen tanulmány célja a HVC1 hipolipidémiás hatásainak vizsgálata magas koleszterinszintű étrend (HCD) által kiváltott hiperlipidémia patkánymodellben.
Anyagok és metódusok
Reagensek
A normál étrendet (ND) és a HCD-t a Research Diets-től szereztük be (New Brunswick, NJ, USA). A P-5 ′ adenozin-monofoszfát-aktivált protein-kináz (P-5 ′ AMPK; Thr 172; kat. Sz. Sc-33524), AMPK (kat. Sz. Sc-398861) és β-aktin (kat. Sz. Sc). -81178) monoklonális antitesteket a Santa Cruz Biotechnology Inc.-től (Santa Cruz, Kalifornia, USA) szereztünk be. Torma-peroxidázzal konjugált egérgátlót (kat. Sz. 315-035-003) és nyúlelleneset (kat. Sz. 111-035-003) a Jackson ImmunoResearch Laboratories, Inc.-től (West Grove, PA, USA) vásároltunk. . Az összes többi reagenst a Sigma-Aldrich-től (St. Louis, MO, USA) szereztük be.
HVC1 elkészítése
A HVC1 a P. yedoensis Matsum kéregből, a R. palmatum L. rizómából, a C. chinensis Franchból áll. rizóma és S. baicalensis Georgi radix. A gyógynövényeket a Dongwoodang Co., Ltd.-től (Yeongcheon, Korea) vásároltuk. Ho-Young Choi professzor, a Kyung Hee Egyetem azonosította a növényeket. A C. chinensis rizóma (CC001), a S. baicalensis radix (SB001), az R. palmatum rizóma (RP001) és a P. yedoensis kéreg (PY001) utalványmintáit a Kyung Hee Egyetem Koreai Orvostudományi Főiskoláján (Szöul, Korea). Mindegyik gyógynövényt 2: 2: 1: 1 (600: 600: 300: 300 g) arányban alkalmaztuk. A gyógynövényeket 30% (v/v) etanol alkalmazásával, 60 ° C hőmérsékletű vízben 8 órán át extraháltuk. Az extraktumokat 10 μm-es patronpapíron szűrjük, és az etanolt vákuum rotációs bepárlóval eltávolítjuk (EYELA; Tokió, Japán). A koncentrátumokat fagyasztva szárítottuk, és a kitermelést 13% -nak számítottuk. A kísérleti porokat desztillált vízben oldjuk, és a maradék port -20 ° C-on tároljuk.
Állatkísérletek
Szérumelemzés
A TC, az LDL-koleszterin és a HDL-koleszterin szérumkoncentrációit enzimatikus módszerekkel határoztuk meg HDL és LDL/VLDL kvantifikációs kolorimetrikus/fluorometrikus készlet segítségével (katalógusszám: K613-100; BioVision, Milpitas, CA, USA).
Szövettani elemzés
Az egyes csoportokba tartozó reprezentatív patkányok máját és aortáját 10% -os pufferolt formalinban rögzítettük, paraffinba ágyazottuk és 5 μm-es metszetekre vágtuk. Bizonyos szakaszokat hematoxilinnal és eozinnal (H&E) festettünk a zsírcseppek szövettani vizsgálatához. Az aorta mintáit olajvörös O-val festettük, amint azt korábban leírtuk (16). A képeket SZX10 mikroszkóppal (Olympus; Tokió, Japán) szereztük be.
Western blot elemzés
A májszöveteket a protein-extrakciós oldatban (PRO-PREP (Intron Biotechnology, Gyeongi-do, Korea)) homogenizáltuk, majd 25 percig jégen inkubáltuk. A mintákat 5 percig 16 000 x g (4 ° C) hőmérsékleten centrifugáltuk, és a felülúszót egy új 1,5 ml-es csőbe helyeztük. A fehérjekoncentrációt a Bio-Rad protein assay reagenssel határoztuk meg, a gyártó utasításainak megfelelően (Bio-Rad Laboratories, Hercules, CA, USA). A fehérjemintákat egy polivinilidén-difluorid (PVDF) membránra immunblotoltuk, miután 10% -os nátrium-dodecil-szulfát (SDS) -poliakrilamid gélen szétválasztottuk. A membránokat 5% sovány tejoldattal blokkoltuk 1 órán át, és egy éjszakán át inkubáltuk primer antitesttel (1: 1 000 hígítás). Az immunblotokat háromszor mostuk Tween 20/Tris-pufferolt sóoldattal (TTBS) és inkubáltuk a megfelelő szekunder antitesttel (1: 2 000 hígítás) 1 órán át szobahőmérsékleten. Miután háromszor mostuk TTBS-sel, az immunblotokat fokozott kemilumineszcencia és röntgenfilm felhasználásával fejlesztettük ki (Amersham Life Science, Buckinghamshire, Egyesült Királyság).
Fordított transzkripció-kvantitatív polimeráz láncreakció (RT-qPCR)
A májszöveteket homogenizáltuk, és a teljes RNS-t az Easy-Blue Reagent alkalmazásával izoláltuk a gyártó utasításai szerint (Intron Biotechnology). A teljes RNS mennyiségét Epoch mikrotérfogatú spektrofotométer rendszerrel (BioTek Instruments, Winooski, VT, USA) használtuk. Röviden, az össz-RNS-t nagy kapacitású cDNS reverz transzkripciós készlet (Applied Biosystems, Foster City, CA, USA) és hőcikler (Gene Amp PCR system 9700; Applied Biosystems) felhasználásával alakították át cDNS-be a következő programmal: 10 perc 25 ° C-on, majd inkubálás 50 ° C-on 90 percig és 85 ° C-on 5 percig. A qPCR elemzést egy Step One Plus valós idejű PCR rendszer (StepOne szoftver 2.3 verzió; Applied Biosystems) segítségével végeztük. A glicerinaldehid-3-foszfát-dehidrogenáz (GAPDH), a peroxiszóma-proliferátor-aktivált receptor-y (PPAR-γ), a HMG-CoA R és az alacsony sűrűségű lipoprotein-receptor (LDLR) PCR-analíziséhez SYBR Green mesterkeveréket és primereket használtunk. A PCR-ciklus paraméterei a következők voltak: 10 perc 95 ° C-on; 40 ciklus 5 másodpercig 95 ° C-on és 45 másodpercig 60 ° C-on; és a végső olvadási görbe 15 mp 95 ° C-on, 1 perc 60 ° C-on és 15 mp 95 ° C-on. Az összes primer szekvenciát az I. táblázat mutatja. A génexpressziót a Cq módszerrel számítottuk.
I. táblázat
| PPAR-y | 5′-ATCGAGTGCCGAGTCTGTGG-3 ′ | 5′-GCAAGGCACTTCTGAAACCG-3 ′ |
| HMG-CoA R | 5′-TGTTGGAGTGGCAGGACCTC-3 ′ | 5′-GGCACCTCCACCAAGACTGA-3 ′ |
| LDL-receptor | 5′-CTCACTTCCGCTGCAACTCC-3 ′ | 5′-CCACAGTGGAACTCGAGGGA-3 ′ |
| GAPDH | 5′-TGATTCTACCCACGGCAAGT-3 ′ | 5′-AGCATCACCCCATTTGATGT-3 ′ |
PPAR-y HMG-CoA R LDL-receptor PPAR-y, peroxiszóma-proliferátor-aktivált receptor-y; HMG-CoA R, 3-hidroxi-3-metil-glutaril-CoA-reduktáz; LDLR, kis sűrűségű lipoprotein receptor; AMPK, AMP-aktivált protein-kináz; p-, foszforilezett.
HVC1 nagy teljesítményű folyadékkromatográfia (HPLC) elemzése
Statisztikai analízis
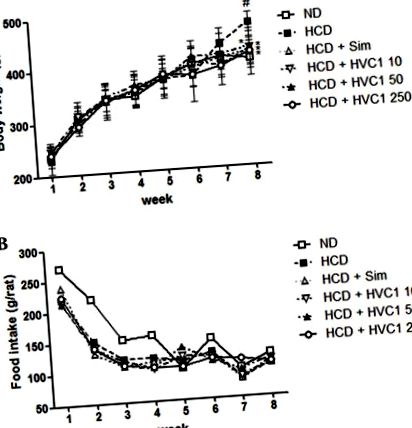
Valamennyi értéket az átlag ± az átlag standard hibájaként fejezzük ki. Az adatokat Dunnett-próbával egyirányú varianciaanalízissel elemeztük. A statisztikai elemzést a GraphPad Prism (5. verzió; Graphpad Software Inc., La Jolla, Kalifornia, USA) segítségével végeztük. P 1. ábra. A HCD csoport átlagosan 202,5 g-ot, míg a HVC1-vel kezelt csoportok (10, 50 vagy 250 mg/kg) 8 hét után csak 160,2, 176,6 vagy 172,2 g-ot kaptak (1A. Ábra). A kísérleti időszak alatt a HCD csoportban nem volt szignifikáns különbség az élelmiszer- és a vízfogyasztásban a többi kezelési csoporthoz képest (1B. Ábra).
A HVC1 hatása a testsúlyra és a táplálékfelvételre patkányokban. (A) A testsúlyt és (B) a táplálékfelvételt hetente regisztráltuk. Az értékek az átlag ± átlagos hibájaként vannak ábrázolva (n = 6). # P * P 2A. És B. Ábra). A HCD csoportban a TC szérumszintje 443,3 ± 67,7 mg/dl volt, a 10, 50 és 250 mg/kg HVC1 a TC szintet 255,0 ± 41,6, 218,0 ± 34,6 és 170,3 ± 21,0 mg/dl-re csökkentette (TC. (2A. Ábra). Az LDL-koleszterin szérumszintje a HCD csoportban 124,3 ± 23,7 mg/dl, 10, 50 és 250 mg/kg HVC1 az LDL-szintet 80,7 ± 11,6, 67,0 ± 6,9 és 49,7 ± 11,0 mg/dl-re csökkentette. 2B). Dózisfüggő válasz volt a HVC1-vel a TC és az LDL koleszterinszintre; A HVC1 nagyobb hatást mutatott, mint a szimvasztatin. Ezenkívül a HVC1 (250 mg/kg) beadása szintén jelentősen megfordította a HDCD-koleszterinszint HCD-indukálta csökkentését (1C. Ábra). A HDL-koleszterin szérumszintje a HCD-csoportban és a HVC1-csoportban (250 mg/kg) 14,7 ± 3,1 és 24,7 ± 2,9 mg/dl volt (2C. Ábra). Ezen adatok alapján a HVC1 hatékonyabban gátolta a HCD által kiváltott szérum koleszterinszint változásokat, mint a hipolipidémiás gyógyszer, a szimvasztatin.
A HVC1 hatása a szérum koleszterinszintre magas koleszterinszintű étrendben táplált patkányokban. A TC, az LDL-koleszterin és a HDL-koleszterin szérumkoncentrációit enzimatikus módszerekkel határoztuk meg. (A) A TC szérumszintje. (B) Az LDL-koleszterin szérumszintje. (C) A HDL-koleszterin szérumszintje. ND, normál étrendű csoport; HCD, magas koleszterinszintű étrendcsoport; Sim, szimvasztatin (10 mg/kg) HCD-csoporttal kezelve; HVC1, HVC1 kezelése HCD csoporttal. Az értékeket az átlag ± átlaghibájaként mutatjuk be (n = 6). # P ** P *** P 3. ábra: A májszövetekre vonatkozó H&E festési eredmények azt mutatták, hogy a HCD csoportban a lipidcseppek kis vakuolákként jelentek meg a májsejtekben. A lipidcseppek megnagyobbodása kifejezettebb volt a HCD csoport patkányainak májszövetében, mint a HVC1 csoport (250 mg/kg). Ezenkívül a lipid felhalmozódása az aortában jobban látható volt a HCD csoportban, mint a HVC1-vel kezelt csoportokban (4. ábra). Így az egyes reprezentatív szövetek eredményei egyértelműen azt mutatták, hogy a májban és az aortában a lipidfelhalmozódás nagyobb volt a HCD csoportban, mint a HVC1 csoportban (250 mg/kg).
A HVC1 hatása a máj lipidfelhalmozódására. Az egyes csoportok reprezentatív patkányainak máját rögzítettük, paraffinba ágyazottuk és hematoxilinnal és eozinnal festettük. A képek eredeti × 100-as nagyítással készülnek. Mérleg rúd, 100 mm. ND, normál étrend csoport; HCD, magas koleszterinszintű diétacsoport; Sim, Simvastatin (10 mg/kg) HCD-csoporttal kezelve; HVC1, HVC1 kezelése HCD csoporttal.
A HVC1 hatása az aorta lipidfelhalmozódására. Az egyes csoportok reprezentatív patkányának aortáját rögzítettük, paraffinba ágyazottuk és olajvörös O-val festettük. A képeket eredeti × 100-as nagyítással készítjük. ND, normál étrend csoport; HCD, magas koleszterinszintű diétacsoport; HVC1, HVC1 kezelése HCD csoporttal.
A HVC1 hatása a máj PPAR-γ, HMG-CoA R és LDLR mRNS expressziójára
A HVC1 máj PPAR-γ, HMG-CoA R és LDLR mRNS expressziójára gyakorolt hatásainak vizsgálatához RT-qPCR-t végeztünk. Amint az 5A. És B. Ábrán látható, a PPAR-γ és HMG-CoA R mRNS-expressziója a HCD-csoportban az ND-csoporthoz képest felülszabályozott volt, és a HVC1 beadása jelentősen és dózisfüggően elnyomta a PPAR-mRNS-expresszióját. γ és HMG-CoA R. Ezenkívül a HVC1 (250 mg/kg) beadása jelentősen megfordította az LDLR mRNS expressziójának HCD által indukált csökkenését (5.C ábra). Nevezetesen a HVC1 erőteljesebb hatást fejtett ki, mint a szimvasztatin.
Standard anyagelemzés
A standardizáláshoz HPLC elemzést végeztünk. A mintakeverék retenciós ideje a következő volt: 3,49 perc az A szennozid és a B szennozid esetében, 4,98 perc a genistein-7-glükóz esetében, 9,61 perc a koptisin, 13,78 perc a baicalin, 17,18 perc a prunetin-5-glükóz esetében, 21,22 perc berberin esetében 59,76 perc baicalein esetében, 72,53 perc wogonin esetében, 74,12 perc prunetin esetében (6A. és B ábra).
A HVC1 HPLC-kromatogramja. (A) HVC1 standard keverékek HPLC-kromatogramja. (B) HVC1 HPLC-kromatogramja. SA, szennozid A; SB, szennozid B; G7g, genistein-7-glükóz; P5g, prunetin-5-glükóz.
Vita
Jelen tanulmányban a HVC1 hippolipidémiás hatásait vizsgálták patkányokban a HCD által kiváltott hiperlipidémia ellen. A HVC1 jelentősen csökkentette a szérum lipidszintet és gátolta a PPAR-γ, HMG-CoA R és LDLR expresszióját.
Az LDL-koleszterin és a trigliceridek megnövekedett szérumkoncentrációja aterogén, és a szív- és érrendszeri betegségek kockázati tényezőjeként ismerték el (18). A megnövekedett HDL-szintet kardioprotektívnek tekintették. Ebben a vizsgálatban a HVC1 csökkentette a TC és az LDL értéket, és növelte a HDL értéket a HCD-vel táplált patkányok szérumában. Ugyanígy a lipid felhalmozódása az aortában kevésbé volt látható a HVC1-vel kezelt csoportokban, mint a HCD csoportban. A HVC1 R. palmatum rizómából, P. yedoensis kéregből, C. chinensis rizómából és S. baicalensis radixból áll, amelyekről ismert, hogy pozitívan befolyásolják a lipid anyagcserét. Jelen tanulmány szerint ez a négy gyógynövény vagy aktív vegyület kapcsolatba hozható a HVC1 erőteljes hatásával.
Általában a májat a lipid-anyagcsere alapvető szervének tekintik. Amint a 3. ábrán látható, a HCD lipidfelhalmozódást indukált a májszövetben, de a HVC1-gyel végzett kezelés elnyomta a májszövet lipidcsepp tartalmát. A máj lipid anyagcseréje erősen koordinált folyamat, amelyben számos utat szabályoz a transzkripció (19). A PPAR-y egy nukleáris receptor és ligandum által aktivált transzkripciós faktor, amely részt vesz a lipogén enzimek, például az acetil-CoA-karboxiláz és a zsírsav-szintetáz (20) expressziójában. A HMG-CoA R transzmembrán fehérje, amely szerepet játszik a lipidek szintézisében. Ez a sebességkorlátozó lépés a koleszterinszintézisben, és a koleszterinszint-csökkentő gyógyszerek, a sztatinok fő célpontja (21). A HMG-CoA R gátlása indukálja az LDLR expresszióját a májban (22). Az LDLR egy sejtfelszíni receptor, amely fokozza a plazma LDL katabolizmusát és csökkenti a koleszterin plazmakoncentrációját. Az LDL-koleszterin kötődik az LDLR-hez, az endocitózis néven ismert folyamatban internalizálódik, és megakadályozza az LDL diffundálódását a membrán felszíne körül (23). Az endocitózis túlnyomórészt a májban fordul elő, amely eltávolítja
Az LDL 70% -a a keringésből származik (24). Ebben a vizsgálatban a PPAR-γ, HMG-CoA R és az LDLR mRNS-expresszióját szignifikánsan és dózisfüggően helyreállította a HVC1. Ezek az eredmények azt mutatják, hogy a HVC1 a génexpresszió szabályozásával csökkentheti a szérum lipidszintet és a zsír felhalmozódását a májban és az aortában.
Az AMPK a máj lipidanyagcseréjének jól ismert szabályozója, és részt vesz a sejtenergia homeosztázisában is (19). Ismeretes, hogy az AMPK-t a foszforiláció szabályozza, és inaktiválja a HMG-CoA R-t, amely a máj koleszterinszintézisének kulcsfontosságú enzime (25). A HVC1 hipolipidémiás hatásainak lehetséges mechanizmusának vizsgálatához megvizsgáltuk az AMPK foszforilációját és teljes fehérje szintjét. A HVC1 jelentősen megfordította az AMPK foszforiláció csökkenését, valamint az összes AMPK fehérje szint csökkenését. Ezek az adatok azt jelzik, hogy a HVC1 transzkripciós vagy transzlációs szinten szabályozhatja az AMPK-t. Ezért az is lehetséges, hogy a HVC1 hipolipidémiás hatásait az AMPK szabályozása révén fejti ki.
Összefoglalva, a HVC1 hatékonyan elnyomta a szérum lipidszintjét és a zsír felhalmozódását a HCD által kiváltott hiperlipidémiás patkányok májában és aortájában. Úgy tűnik, hogy a HVC1 hipolipidémiás hatásának hátterében álló mechanizmusok magukban foglalják a PPAR-γ, HMG-CoA R és LDLR expresszió helyreállítását az AMPK indukciója révén. Az eredmények egyértelműen bizonyítják, hogy a HVC1-nek erős hipolipidémiás hatása van, és azt sugallja, hogy a HVC1-t a hiperlipidémia lehetséges kezelésének értékelése.
Köszönetnyilvánítás
Ezt a tanulmányt a Koreai Egészségügyi és Jóléti Minisztérium Koreai Egészségügyi Technológiai K + F projektjének támogatása támogatta (támogatás száma: B110081).
- A magas zsírtartalmú étrend által kiváltott, az életkorral összefüggő elhízás és csontritkulás állatmodellje - PubMed
- A ketogén étrend hosszú távú hatásai elhízott, magas koleszterinszinttel rendelkező alanyokban - PubMed
- A lupusz patogenezisét és az autoimmunitást súlyosbítja a magas zsírtartalmú étrend okozta elhízás egerekben.
- A garnélarák egészséges választás, ha magas a koleszterinszintem; HealthyDiningFinder
- Magas koleszterinszintű fiatal nők központja; s Egészség