IV. Stádiumú tüdőrák: Lehetséges a gyógyulás?
Ravi Thippeswamy
Orvosi Onkológiai Osztály, Tata Memorial Hospital, Mumbai, Maharashtra, India
Vanita Noronha
Orvosi Onkológiai Osztály, Tata Memorial Hospital, Mumbai, Maharashtra, India
Vamshi Krishna
Orvosi Onkológiai Osztály, Tata Memorial Hospital, Mumbai, Maharashtra, India
Amit Joshi
Orvosi Onkológiai Osztály, Tata Memorial Hospital, Mumbai, Maharashtra, India
Munita Meenu Bal
1 Patológiai Osztály, Tata Emlékkórház, Mumbai, Maharashtra, India
Nilendu Purandare
2 Nukleáris Orvosi Osztály, Tata Memorial Hospital, Mumbai, Maharashtra, India
V. Rangarajan
2 Nukleáris Orvosi Osztály, Tata Memorial Hospital, Mumbai, Maharashtra, India
C. S. Pramesh
3 Thoracic Services, Tata Memorial Hospital, Mumbai, Maharashtra, India
Sabita Jiwnani
3 Thoracic Services, Tata Memorial Hospital, Mumbai, Maharashtra, India
Kumar Prabhash
Orvosi Onkológiai Osztály, Tata Memorial Hospital, Mumbai, Maharashtra, India
Absztrakt
Eset bejelentése, 53 éves férfi IV stádiumú Nonsamall sejtes tüdőrákban, tekintettel a citológiailag igazolt malignus pleurális folyadékgyülemre. A IV. Stádiumú tüdőrák kezelése általában palliatív szándékú, ahol a beteg palliatív kemoterápiát kap, szükség esetén palliatív sugárkezeléssel és műtéttel együtt. Az oligometasztatikus, nem kissejtes tüdőrák gyógyító kezelésére vonatkozó adatok többsége mellékvese áttétet szenvedő betegeket és néhány agyi áttétet tartalmazó jelentést tartalmaz. A IV. Stádiumú tüdőrák műtéti kezeléséről, pleurális effúzióval, kevés a szakirodalom.
BEVEZETÉS
A tüdőrák a fogyás, a tüdőtömeg, a pleurális folyadékgyülem és a lymphadenopathia egyik gyakori differenciáldiagnózisa nálunk egy férfi dohányosban. A diagnózis magas gyanakvási indexet igényel, mivel könnyen összetéveszthető a tuberkulózissal és a krónikus bronchitisszel. A IV. Stádiumú, jó teljesítménnyel rendelkező tüdőrák kezelése a palliatív kemoterápia. Itt szeretnénk megvitatni a pleura effúzióval járó oligometasztikus IV stádiumú tüdőrák műtéti lehetőségeit.
ESETLEÍRÁS
53 éves, krónikus dohányos férfi, akinek kórelőzményében bal oldali unalmas, fájó mellkasi fájdalom volt 1 hónapig, és jelentős súlycsökkenés 5 kg volt 1 hónap alatt. A test bármely részén nem észleltek légzési nehézségeket, vérzéscsillapítást, csontos fájdalmakat vagy csomókat. Az értékelés kiterjedt a mellkas kontrasztanyaggal ellátott komputertomográfiájára (CT), amely a bal felső lebeny perifériás, 2 × 2 cm méretű tömegét mutatta ki mellkasfal, megnagyobbodott pretrachealis, prevascularis és aortopulmonalis ablakcsomópontok, valamint enyhe bal mellhártya effúzió.
Differenciáldiagnosztika és diagnosztikai értékelés ajánlott
Hazánkban a férfi dohányosoknál a fogyás és a tüdőtömeg lymphadenopathiával járó általános differenciáldiagnosztikája krónikus obstruktív tüdőbetegség, krónikus hörghurut, tuberkulózis, tüdőgyulladás és tüdőrák. A klinikai anamnézist és az alapos vizsgálatot a nyak körültekintő tapintásával kell elvégezni a lymphadenopathia és a mellkasi auscultation érdekében. A képalkotás alapja a mellkas röntgenfelvétel, amelyet kiegészít a mellkas kontrasztot fokozó CT-vizsgálata, amelynek tartalmaznia kell a májat és a mellékveséket. A szövetdiagnózis kötelező, ha a rosszindulatú daganat klinikai-radiológiai gyanúja magas, és biopsziát kell végezni bronchoszkópiával vagy CT-útmutatással. Ha beigazolódik, hogy rosszindulatú, további szakaszos munka szükséges, ha a mellkas CT-vizsgálata nem metasztatikus betegséget mutat. A metasztatikus kezelés magában foglalja a pozitron emissziós tomográfia (PET) -CT és az agy mágneses rezonancia képalkotó (MRI) vizsgálatát.
Betegünk CT-vizsgálatot mutatott be nekünk, amely egy bal felső lebenytömeget mutat, ipsilateralis mediastinalis lymphadenopathiával és egy kis pleurális effúzióval. Életerei normálisak voltak, a fizikális vizsgálat nem volt figyelemre méltó, és az ECOG teljesítményállapota 1. A száloptikai bronchoszkópia nem mutatott endobronchialis növekedést. Diagnosztikai thoracentézist végeztünk. A pleurális folyadék citológiája pozitív volt metasztatikus laphámrák esetén.
A citológia szerepe a tüdőrákban
A primer és metasztatikus tüdőrák diagnosztizálásában fontos szerepet játszottak a hagyományos citológiák, mint a köpetvizsgálat, a hörgők kiöblítése, a hörgőkefe, a finom tűvel történő aspirációs biopszia. Immunhisztokémiai foltok vihetők fel a citológiai anyagokra. Az immunhisztokémiai markerek, például a TTF-1, CK7, CK20, 4A4, 34 E12 és p63 segítenek a nem kissejtes tüdőrák (NSCLC) további altípusainak osztályozásában. Ezenkívül epidermális növekedési faktor receptor (EGFR) génmutációs vizsgálatok is elvégezhetők a citológiai anyagból előállított blokkokon, ami segít a megfelelő célzott terápia kiválasztásában. Így a citológia fontos szerepet játszik nemcsak a daganatok alosztályozásában, hanem a kezelési stratégia individualizálásában is, a könnyű hozzáférhetőség és a minimális invazivitás előnyével. [1]
Így a betegnél tüdő laphámsejtes karcinómát diagnosztizáltak, T3N2M1a, IV.
AZ IRÁNYÍTÁS MEGBESZÉLÉSE
A IV. Stádiumú tüdőrák standard kezelése palliatív kemoterápia platina alapú kombinált kemoterápiával. Vannak azonban olyan jelentések, amelyekben csak rosszindulatú pleurális folyadékgyülemben szenvedő tüdőrákban szenvedő betegekről van szó, és nincsenek más áttétes helyek, amelyek kemoterápiával és műtéttel hosszú távon gyógyulnak. [2,3] A páciens kiváló teljesítményállapota és a A metasztázisok más helyeit nem mutató PET-CT úgy döntött, hogy megpróbálható a potenciálisan gyógyító szándékú terápia, annak ellenére, hogy ez eltérne a kialakított irányelvektől. Fokozatos munkát végeztek.
A tüdőrák szakaszos értékelése
A szövetdiagnózis felállítása után egy teljes szakaszos munkát végeznek az áttétek jelenlétének azonosítására és a műtéti reszekció megvalósíthatóságára.
Részletes kórelőzmény és fizikális vizsgálat után olyan laboratóriumi vizsgálatokat végeznek, mint a teljes vérkép, a májfunkciós vizsgálatok (transzaminázok), a szérum elektrolitok, a szérum kalcium és a szérum alkalikus foszfatáz. Az értékelési rendellenességben szenvedő betegek több mint 80% -a metasztatikus betegségben szenved. Azoknál a betegeknél, akiknél étvágytalanság, fogyás és fáradtság jelentkezik, különösen rossz a prognózisuk, amely az előrehaladott stádiumú és az agresszív tumorbiológiát mutatja be. [4]
A metasztatikus tüdőrák gyanúja esetén a mellkas és a has CT és PET vizsgálatát rendszeresen elvégzik. A mellkas és a has felső részén végzett CT-vizsgálatok segítenek azonosítani a hilaris és mediastinalis adenopathiát, valamint a máj- vagy mellékvese-áttéteket. A CT mellkas 88% -os pontossággal (80% szenzitivitás és 100% specificitás) azonosítja a mediastinalis érintettségét. Az integrált CT/PET jobb érzékenységgel és specifitással rendelkezik, mint egyedül a CT vagy a PET. [5]
A bronchoszkópia transzbronchiális tű aspirációval vagy anélkül, endobronchialis ultrahang-vezérelt transzbronchialis tű aspiráció, video-asszisztált thoracoscopia vagy mediastinoscopy fontos szerepet játszott a mediastinalis gyanúja miatt szenvedő betegek értékelésében. A videó által támogatott thoracoscopia vagy mediastinoscopy előnye, hogy közvetlenül megjeleníti az elváltozást és a pontos mintavételt. További vizsgálatokat végeznek a klinikai tünetek függvényében. Csontszkennelés és agyi mágneses rezonancia képalkotás végezhető, a tünetek függvényében. [5]
RADIOLÓGIAI MEGBESZÉLÉS (A PET SZEREPE)
A PET/CT jó érzékenységgel és specifitással rendelkezik a távoli áttétek azonosításában. [6] Így a PET/CT nagyon fontos az NSCLC-s betegek döntési folyamatában, különösen oligometasztázisos betegeknél. A PET/CT által azonosított gyanús elváltozásokat hisztopatológiai értékeléssel kell megerősíteni. Különböző tanulmányok arról számoltak be, hogy az egész test PET az NSCLC betegek 6-17% -ában észleli az okkult metasztázisokat, akiknél a hagyományos stádiumos módszerekkel nem sikerült azonosítani az áttéteket. [7] A PET/CT pozitív prediktív értéke 54% a primer tüdőrák tetején található további elváltozások azonosításában. [8]
A PET-CT és az agy MRI vizsgálata metasztatikus betegség hiányát mutatta. A beteget részletesen konzultálták önmagában a palliatív kemoterápia szokásos ajánlott kezelésével, vagy a kemoterápia iránymutatáson kívüli lehetőségével, majd jó műtéti beavatkozással. A beteg az utóbbi lehetőséget választotta. A páciens három kemoterápiás ciklust kapott 1000 mg/m 2 gemcitabinnal az 1. és a 8. napon, valamint az 1. napon karboplatin AUC 5-tel (a görbe alatti terület, Calvert-képlettel számolva), 21 naponként. Jól tolerálta a kemoterápiát nagyobb mellékhatások nélkül. A kemoterápia első ciklusa után jelentős tüneti előny mutatkozott a fájdalomban.
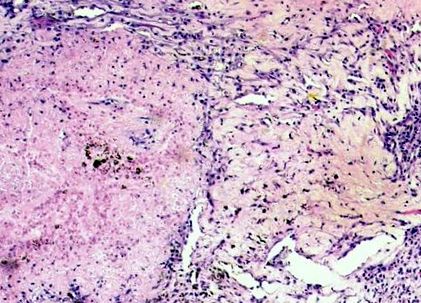
Három kemoterápiás ciklust követően a PET-CT 1,9 × 1,6 × 1,2 cm-es bal linguláris lebeny tömeget (SUV 3.5) mutatott ki, anélkül, hogy a mediastinalis csomópontokban kóros aktivitás lenne és távoli metasztázisok sem voltak. A bal felső lobectomiát szisztematikus mediastinalis lymphadenectomiával végeztük, amelyet követően a páciens eseménytelenül gyógyult meg a műtét után. Intraoperatív módon 2 × 2 cm-es bal felső lebeny tüdőtömeget tapasztaltunk a szívburokhoz tapadva, megnagyobbodott aortopulmonalis AP ablakkal és bal hilaris csomókkal. Nem voltak pleurális csomók vagy effúzió. A végső hisztopatológia nem mutatott maradék daganatot, az összes regionális csomópont negatív volt a metasztázis szempontjából (ypT0N0) [1. ábra].
A mikroszkópia a nekrózis, a limfoplazmatikus infiltrátum és a hemosiderin lerakódások nagy területeit tárta fel a fibrózis területei között. Maradék daganatot nem azonosítottak (H és E, eredeti nagyítás, × 100)
A páciens 24 hónapos követés után már életben van és betegségektől mentes.
A PATOLÓGIAI VÁLASZ MEGTEKINTÉSE
A kemoterápiára adott kóros válasz értékelése fontos szerepet játszott a fej és a nyak karcinómáiban, a nyelőcsőrákban, az oszteogén szarkómában és a kissejtes tüdőrákban. A patológiás teljes választ fibrózisként vagy fibro-gyulladásként definiálják, karcinóma és szövettanilag negatív csomók mikroszkopikus bizonyítéka nélkül. A nem pCR az életképes karcinóma bármely bizonyítéka, az elsődleges helyen vagy a reszekált regionális LN-ben. Azok a betegek, akik teljes kóros választ eredményeznek, hosszú távú túlélési előnnyel rendelkeznek. Junker és mtsai. [9] megállapította, hogy az NSCLC-s betegeknél nemcsak komplett válaszadók, hanem kiterjedt válaszadók is Rekhtman N, Ang DC, Sima CS, Travis WD, Moreira AL esetén. Immunhisztokémiai algoritmus a tüdő adenokarcinóma és a laphám karcinóma differenciálására, teljes szövetszelvények nagy sorozatán alapul, validálás kis mintákban. Mod Pathol. 2011; 24: 1348–59. [PubMed] [Google Tudós]
- A 4. szakasz nem kissejtes tüdőrák tünetei, okai és kezelése
- IV. Szakasz (4. szakasz) tüdőrák tünetei; Kezelések CTCA
- A 4. szakasz tüdőrák prognózisa Túlélési arány, tünetek és egyebek
- Kissejtes tüdőrák útmutató Az SCLC megértése
- A IV. Stádiumú vastagbélrák, amely átterjedt a májban