A kasztrálás okozta tesztoszteronhiány szövetspecifikus és étrendfüggő módon növeli a hím patkányok adipozitását
Absztrakt
Háttér
A férfiak tesztoszteronhiánya klinikailag összefügg a metabolikus szindróma kialakulásával, amely elhízásként, máj steatosisként és 2-es típusú cukorbetegségként nyilvánul meg. Megvizsgáltuk a kasztrálás által kiváltott tesztoszteronhiány hatását a test adipozitására, valamint a lipid anyagcseréhez és a glükózfelvételhez, valamint az androgén jelátvitelhez kapcsolódó gének expressziójához normál étrenddel (ND) vagy magas zsírtartalmú étrenddel (HFD) táplált hím patkányokban.
Mód
A nem kasztrált és kasztrált patkányok ND- vagy HFD-etetés közbeni élettani és molekuláris szintjén vizsgálták a lipid- és glükóz-anyagcsere, valamint az androgén jelátvitel változását.
Eredmények
A kasztrálás okozta tesztoszteronhiány hajlamosította az állatokat az ND-re a zsírmáj korai kialakulására a zsírsav szintézis aktiválásával, míg a HFD aktiválta a máj FA felvételét CD36 expressziója, ami a máj steatosisának kialakulásához vezet. ND-vel táplált patkányokban a kasztráció aktiválásával izomzsír felhalmozódást váltott ki CD36 kifejezés. Az ND-vel táplált patkányok szubkután zsírjában a kasztráció növelte az zsírszintet és az FA szintézissel kapcsolatos gének expresszióját, de csökkentette a glükóz transzporter gén expresszióját. Az ND-vel táplált patkányok hasi zsírjában a kasztrálás növelte az adipozitást az FA szintézissel kapcsolatos gének felpörgetésével, a HFD pedig az FA felvételét, a glükóz transzportert és az FA szintézissel kapcsolatos génexpressziót indukálta. ND-vel táplált patkányokban a kasztráció csökkentette a test növekedését és az izomtömegét, valamint csökkentette a gének androgén szignáljának expresszióját a longissimus dorsi izomban.
Következtetések
A tesztoszteronhiány szövetspecifikus és étrendfüggő módon növeli az adipozitást. A tesztoszteronhiány csökkenti a test és az izom súlyát, és csökkenti az androgén jelátvitelt.
Bevezetés
A tesztoszteron fontos szerepet játszik a lipid- és glükóz-anyagcserében [1]. Kelly és mtsai. [2] azt sugallta, hogy a tesztoszteron csökkenti a testzsír lerakódását azáltal, hogy szabályozza a lipid- és glükóz-anyagcserével kapcsolatos gének expresszióját. Az alacsony tesztoszteronszint vagy a tesztoszteronhiány szabályozza a lipid- és glükóz-anyagcserét, ami a májban és a perifériás szövetekben fokozott zsírszövetet eredményez [2,3,4,5]. A tesztoszteronhiány fokozott visceralis adipozitással jár [6]. Az alacsony tesztoszteronszint előre jelzi a metabolikus szindróma kialakulását, amely elhízásként, alkoholmentes zsírmájbetegségként és férfiak 2-es típusú cukorbetegségében [1, 7] és laboratóriumi állatokban [2, 5] nyilvánul meg. A tesztoszteronhiány zsírbetegségre és lipid/glükóz anyagcserére gyakorolt hatása ellentmondásos. Például a magas zsírtartalmú étrenddel (HFD) kombinált androgénhiány súlyosbította a hím egerek zsírosodását és inzulinrezisztenciáját [5]. Ezzel szemben a hím patkányok szérum glükóz- és inzulinszintjét a tesztoszteronhiány és a HFD nem befolyásolta [8]. Ezért a tesztoszteronhiány lipid- és glükóz-anyagcserére gyakorolt hatása további vizsgálatot igényel.
A testzsír lerakódását a zsírsav (FA) felvételét, szintézisét és lebomlását közvetítő lipid metabolikus utak modulálják [9,10,11]. A CD36 FA transzporter közvetíti az FA felvételét, és fontos szerepet játszik a máj steatosisában [12]. Korlátozott információ áll rendelkezésre a CD36 szerepéről a zsírlerakódásban tesztoszteronhiányos patkányokban. Kelly és mtsai. [2] a tesztoszteronnak a szubkután (sc) és a zsigeri zsírszövet működésére gyakorolt hatásában megmutatkozó különbségekről számoltak be: a here-feminizált egerek (nem funkcionális androgénreceptorral [AR] és alacsony tesztoszteronszinttel) csökkent GLUT4 expresszió sc-ben, de nem zsigeri zsírszövetben. További vizsgálatok szükségesek a tesztoszteronhiánynak a lipid- és glükózanyagcserével kapcsolatos gének expressziójára gyakorolt hatásairól a perifériás szövetekben (beleértve a májat és a vázizomzatot is) és a zsírraktárakban (sc és a hasi [ab] zsírszövetekben), hogy megértsük a mechanizmusokat, melyik zsírosság szabályozott.
A tesztoszteronhiány csökkenti a növekedést és az izomtömeget az orchidectomia és az AR-knockout egereknél [5], és csökkenti az izomtömeget a hím embereknél [13]. Ezek az eredmények arra utalnak, hogy a tesztoszteron fontos a test és az izom növekedésében. A tesztoszteron jelátvitelt az AR jelátviteli útvonal közvetíti [14, 15], ezért szükséges a tesztoszteronhiány AR jelátvitelre gyakorolt hatásának vizsgálata.
A rágcsálóknak HFD-vel történő táplálása megváltoztatja lipid- és glükóz-anyagcseréjüket [16, 17], és gyakran olyan metabolikus szindróma tanulmányozására használják, mint a zsigeri zsírbetegség, a hiperlipidémia és az inzulinrezisztencia [18]. A tesztoszteronhiány és a HFD kombinációjának hatását tehát tisztázni kell. Feltételeztük, hogy a tesztoszteron-hiány differenciálisan deregulálja a lipid metabolizmushoz és a glükózfelvételhez kapcsolódó gének expresszióját szövetspecifikus módon, hajlamosítva a metabolikus szindrómára. Feltételeztük azt is, hogy a HFD súlyosbítja a tesztoszteronhiány okozta lipid- és glükóz-anyagcsere-változásokat. E hipotézisek teszteléséhez megvizsgáltuk a kasztrálás hatását a lipid anyagcserével és a máj, az izom, valamint az sc és ab zsírraktárakkal kapcsolatos gének növekedésére, zsírosodására, vázizom tömegére, vérparamétereire és expressziós szintjére. patkányok normál étrenddel (ND) vagy HFD-vel etettek 9 hétig.
Anyagok és metódusok
Állatok, kasztrálás és étrend
Az állatokat érintő összes kísérleti eljárást a Chonnam Nemzeti Egyetem (CNU) Intézményi Állathasználati és Gondozási Bizottsága hagyta jóvá (engedélyszám CNU IACUC-YB-R-2010-13). Minden állatkezelési eljárás a CNU szabványos működési protokollját követte. A hím Sprague – Dawley patkányokat az Orient Bio-tól (Gyeonggi-Do, Koreai Köztársaság) szereztük be, és 12/12 óra alatt tartottuk hőmérsékleten (22 ± 1 ° C) és páratartalom mellett (45–65%) ellenőrzött helyiségben. világos/sötét ciklus ad libitum hozzáféréssel az élelmiszerekhez és a vízhez.
A patkányokat 6 hetes korban kasztrálták, ekkor átlagos testtömegük 213 g volt. Az összes műtéti eszközt elfogadható módszerekkel elősterilizálták, beleértve a gőzsterilizálást is. A hím patkányokat a Zoletil ™ 50 (5 mg/testtömeg-kg, Virbac, Franciaország) intramuszkuláris injekciójával érzéstelenítettük, és melegítőpárnára helyeztük. A patkányok herezacskóját leborotválták és 70% -os etanollal megtisztították. A herezacskó bőrén keresztül egy kis középvonalú (1 cm) bemetszést végeztünk, és a heréket elhelyeztük, finoman kinyomtuk és eltávolítottuk. Ezután a vas deferenseket, a zsírokat és az ereket visszaállították eredeti helyzetükbe a herezacskóban, majd a vas deferenseket és az ereket selyemvarratokkal kötötték fel (Ailee, Szöul, Korea). Az izomréteget és a bőrt varratokkal zártuk le, majd a patkányokat visszahelyeztük ketreceikbe, és ellenőriztük a gyógyulást. Az ál műtéti kontroll patkányokon azonos eljárás történt, mint a kasztrált patkányokon, kivéve a herék eltávolítását.
Az ND etetéses kasztrálást követő 1 héten át történő akklimatizálódás után a patkányokat a következő négy csoportba osztottuk (csoportonként 8): ál-műtött kontroll patkányokat, amelyek ND vagy HFD tápláltak, és kasztrált patkányokat, amelyek ND vagy HFD tápláltak. A normál AIN93-G étrendet (D10012G) és HFD-t (D12451) a Research Diets, Inc.-től (New Brunswick, NJ, USA) szereztük be; kompozícióikat az S1-S3 támogató táblázatok mutatják be. Röviden, a HFD-ben az ND-vel szemben az energia 45% -a 16% -hoz zsírból, 35% -a 64% -ban szénhidrátból származik, és 20% -a 20% -ban fehérjéből származik. A patkányok táplálékfelvételét naponta, a nap azonos időpontjában rögzítették, testtömegüket hetente mérték.
Vér- és szövetgyűjtés
A 9 hetes etetési periódus végén a (16 hetes) patkányokat 8 órán át éheztettük. A patkányokat CO2-val altattuk, és a vérmintákat szívpunkcióval vettük fel, antikoaguláns nélküli ET csőbe helyeztük és 4 ° C-on tároltuk. A vérmintákat 2000 × -en centrifugáltukg 20 percig 4 ° C-on a szérum összegyűjtésére, amelyet az elemzésig -80 ° C-on tároltunk. CO2-val történő érzéstelenítés után a patkányokat lefejezéssel eutanizálták, és a májat, a zsírszöveteket (ab és sc), valamint a vázizomszöveteket (longissimus dorsi, gastrocnemius és soleus) azonnal eltávolították és megmérték. A szöveteket folyékony nitrogénben lefagyasztottuk, és - 80 ° C-on tároltuk az összes lipid-, mRNS- és fehérjeszint későbbi meghatározásához.
Szérum- és szövetanalízisek
A szérumparamétereket a korábban közölt módon elemeztük [19, 20]. Röviden, a szérum glükózszintjét hexokináz reagensekkel elemeztük (Green Cross Reference Laboratory, Szöul, Korea). A trigliceridek szérumszintjét enzimatikus spektrofotometriás vizsgálattal (Green Cross Reference Laboratory) elemeztük. A tesztoszteron és az inzulin szérumszintjét enzimhez kapcsolt immunszorbens vizsgálattal elemeztük. A szabad FA-k szérumszintjét acil-koenzim A (CoA) szintáz – acil-CoA oxidáz módszerrel elemeztük. Az összes koleszterin, a nagy sűrűségű lipoprotein (HDL) és az alacsony sűrűségű lipoprotein (LDL) szérumszintjét enzimatikus kolorimetriás vizsgálatokkal elemezték.
Az izomszöveteket feldaraboltuk és folyékony nitrogénbe helyeztük. A teljes lipideket körülbelül 50 mg izomszövetből extraháltuk Folch-módszerrel [21].
Szövettan
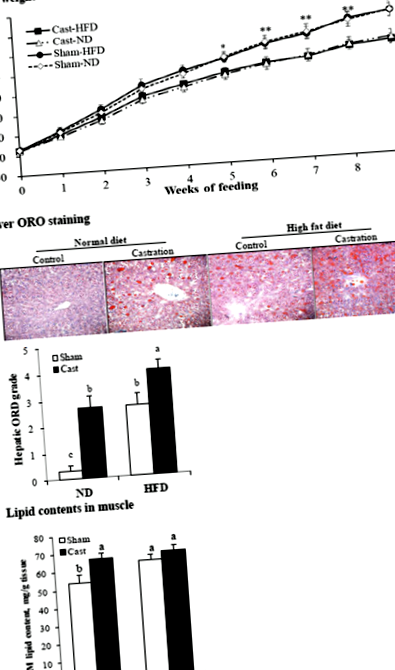
Szövettani elemzés céljából a májat feldarabolták és megszabadították a látható zsírtól és vértől. A szövetek szövettani elemzését és olajvörös O (ORO) festését a korábban leírt módon hajtottuk végre [20]. Röviden, a májmintákat 10% formalinban rögzítettük, 20% szacharózban egyensúlyoztattuk, optimális vágási hőmérsékletű vegyületbe ágyazottuk, és kriptáttal -20 ° C-on 7 μm vastag szakaszokra vágtuk. A zsírlerakódás értékeléséhez a fagyasztott metszeteket 10% -os formalinban rögzítettük, 0,5% ORO-val festettük és mikroszkóp alatt vizsgáltuk. Meghatároztuk a máj ORO festés mértékét és 0-tól 5-ig osztályoztuk (a legalacsonyabbtól a legmagasabbig).
Valós idejű polimeráz láncreakció
A teljes RNS-t TRIzol reagens (Molecular Research Center, Cincinnati, OH, USA) segítségével izoláltuk a gyártó utasításainak megfelelően. A teljes RNS mennyiségét az abszorbancia 260 nm-en történő mérésével számszerűsítettük, integritását agaróz gélelektroforézissel és a 28S és 18S RNS sávok etídium-bromid festésével értékeltük. A cDNS szintézist és a valós idejű polimeráz láncreakció elemzéseket a korábban leírtak szerint végeztük [19]. Az alapozókat az Integrated DNA Technology (Coralville, IA, USA) és a Primer 3 szoftver felhasználásával terveztük a GenBank szekvenciáin alapulva, és a Bioneer (Daejeon, Korea) szintetizálta. A primerekre vonatkozó információkat az S4 alátámasztó táblázat mutatja. A 2 −ΔΔCT módszert alkalmazták a megfelelő háztartási génre normalizált gén expressziós szintek relatív többszörös változásainak meghatározására (glicerinaldehid-3-foszfát-dehidrogenáz máj esetén, β-aktin az izmok számára és savas riboszomális foszfoprotein P0 zsírszövet esetén).
Western blottolás
statisztikai elemzések
Az adatokat átlag ± standard hiba (SE) formájában mutatjuk be. Az adatokat az általános lineáris modelleljárással elemeztük az SAS-ban (SAS Institute Inc., Cary, NC, USA). A modell magában foglalta a kasztrálás, az étrend (ND vagy HFD) és a kasztrálás × diéta interakció hatásait. Amikor az interakciók szignifikánsak voltak, az SSM-ben az LSMEANS PDIFF opcióját alkalmazták az átlagok egyedi összehasonlítására. A különbségeket akkor tekintették jelentősnek, amikor a P értéke kisebb volt, mint 0,05.
Eredmények
A kasztrálás csökkentette a test és az izom súlyát, de megnövelte a test adipozitását
Az ND és HFD csoport kasztrált patkányainak alacsonyabb volt (P 1. ábra
Megnövekedett a kasztrálás (P 2. táblázat: Ál-operált (kontroll) és kasztrált hím patkányok szérumparaméterei, normál étrenddel vagy magas zsírtartalmú étrenddel etetve, 8 órás éhgyomorra
A kasztrálás és a HFD modulálja a lipid metabolizmushoz és a glükózfelvételhez kapcsolódó gének expresszióját
A kasztrálás szövetspecifikus módon modulálta a lipid anyagcserével kapcsolatos gének expresszióját. A kasztrálás felülszabályozott (P 2. ábra
A kasztrálás nem befolyásolta GLUT2 kifejezés a májban vagy GLUT4 expresszió az izomban mindkét étrendcsoportban (2c. ábra). Ezzel szemben a kasztrálás szabályozatlan (P
Vita
A tesztoszteronhiány növeli a test zsírosságát és deregulálja a lipid anyagcseréhez és a glükózfelvételhez kapcsolódó gének expresszióját szövetspecifikus és étrendfüggő módon
Ebben a tanulmányban azt tapasztaltuk, hogy a kasztrálás által kiváltott tesztoszteronhiány növelte a máj, az izom, valamint az sc és az ab zsírtartalmát az ND-vel táplált patkányokban, és növelte a máj és az sc és az ab zsír zsírtartalmát is, de az izomban nem. patkányok tápláltak HFD-t. Eredményeinknek megfelelően az alacsony tesztoszteronszint vagy a tesztoszteronhiány állítólag növeli a máj és számos perifériás szövet zsírbetegségét [2, 3, 5], a HFD pedig növeli a szövetek adipozitását [4, 5, 18].
Megvizsgáltuk az FA felvételében és szintézisében szerepet játszó gének expressziós szintjét, hogy értékeljük a tesztoszteronhiány és az étrend típusának az adipozitásra gyakorolt hatásának molekuláris mechanizmusait. A kasztrálás növelte a CD36 a májban, valamint az sc és az ab zsírban a HFD csoportban, de az ND csoportban nem, és az ND csoport izomzatában, de a HFD csoportban nem. A CD36 aktiválása részt vesz az étrend által kiváltott máj steatosisban [23, 24], és emberben alkoholmentes zsírmáj betegséghez kapcsolódik [25]. Azonban a CD36 expresszió a zsír zsírsejtekben nem világos. Eredményeink azt mutatják, hogy a HFD által indukált upreguláció CD36 az expresszió a máj steatosis mellett megnövekedett sc és ab adipozitással jár. A kasztrálás növelte a ACC és FASN a májban az ND csoportban, de az izmokban a HFD csoportban. Sc és ab zsírban a kasztrálás növelte a ACC és/vagy FASN mindkét étrendcsoportban; a megnövekedett FASN expresszió a sc zsírban összhangban van egy korábbi egerekkel végzett vizsgálattal [5].
A kasztrálás a glükózfelvételhez kapcsolódó gének expresszióját is modulálta. A sc zsírban a kasztrálás jelentősen csökkentette a GLUT4 az ND és HFD csoportokban. Ezzel szemben a kasztrálás nem befolyásolta a máj vagy az izom glükózfelvételével kapcsolatos gének expresszióját az ND vagy HFD csoportban. Ab zsírban a kasztrálás növelte a GLUT4 a HFD-ben, de az ND csoportban nem. Hasonlóképpen Kelley és mtsai. [2] arról számolt be GLUT4 expresszió csökkent a sc zsírban, de az ab zsírban nem csökkent a here-feminizált nőkben a normál egerekhez képest. Ebben a vizsgálatban a keringő glükózkoncentráció nőtt az ND-vel táplált kasztrált patkányokban, de a HFD-vel tápláltakban nem. A megnövekedett glükózkoncentráció oka lehet a scut zsírokban a csökkent GLUT4 génexpresszió és a kasztrált állatokban megfigyelt csökkenő izomtömeg együttes hatása.
Eredményeink azt is sugallják, hogy az alacsony tesztoszteronszint a 2-es típusú cukorbetegség megnövekedett kockázatával jár, mivel a kasztrált patkányok csökkent gén expressziót mutattak a sc-zsír glükózfelvételével, valamint a keringő glükóz koncentrációjának emelkedésével. A kasztrálást követően megnövekedett vér koleszterinszintet találtunk, amelyet a máj és az izomzat koleszterinfelvételének csökkenése okozhat, mivel a LDLr a májban és az izomban csökkent a patkányok kasztrálása.
A tesztoszteronhiány csökkenti a test és az izom súlyát, és csökkenti az androgén jelátvitelt
Megállapítottuk, hogy a kasztrálás csökkentette a patkányok testét, longissimus dorsi és gastrocnemius súlyát. A kasztrálás is csökkent STAT5a és AR expresszió a longissimus dorsi izomban, és AR expresszióját tovább csökkentette a HFD. Így a kasztráció által kiváltott tesztoszteronhiány deregulálja az AR jelátvitelt, és az AR jelzéséhez normális tesztoszteronszint szükséges. Továbbá a HFD fokozta a kasztrálás okozta izomtömeg csökkenést és AR kifejezés. Ezért a megfelelő táplálkozás fontos az izomtömeg fenntartásához alacsony tesztoszteronszint jelenlétében, mivel az alacsony tesztoszteronszint súlyosbíthatja a HFD által kiváltott izomtömeg csökkenést. Az izomtömeg csökkenése csökkentheti az izmok glükózfelhasználását, ami hiperglikémiához és a glükóz homeosztázis deregulációjához vezethet. Ez részben magyarázhatja a tesztoszteronhiány alatti fokozott ab adipozitást az ND és HFD csoportokban.
Zirkin és Tenover [27] beszámolt arról, hogy a keringő tesztoszteron szint általában az életkor előrehaladtával csökken. Valójában az idősebb férfiak növekedési hormonral és tesztoszteronnal történő kezelése javította sovány testtömegüket [28]. A tesztoszteronhiány, amelyet hipogonadizmus, központi elhízás vagy androgén-nélkülözés okozhat prosztatarákos betegeknél, metabolikus szindrómákkal függ össze, beleértve az inzulinrezisztenciát és a 2-es típusú cukorbetegséget [29]. Állatokban a HFD az életkor előrehaladtával különböző módon befolyásolja a test anyagcseréjét és az anyagcsere betegségeket. A HFD-táplálás nagyobb testtömeg- és szérum-koleszterin- és glükózszint-növekedést eredményezett az idősebb egerekben, mint a fiatalabbaké [30]. Vizsgálatunk azt sugallja, hogy a HFD fogyasztása idős férfiaknál, akiknek általában alacsony a tesztoszteronszintje, elősegítheti a metabolikus szindróma kialakulását.
Ebben a vizsgálatban a patkányokat 6 hetes korban kasztrálták, éretlen állapotban. Következésképpen a kasztrálás befolyásolhatja az állatok általános fejlődését, és hozzájárulhat a nem kasztrált állatokhoz viszonyított fiziológiai különbségekhez. A férfiaknál a tesztoszteronszint általában idős korban csökken. Ezért korlátozódhat a megállapítások közvetlen következménye a férfiakra, mivel a patkányokat éretlen korban kasztrálták.
A kasztrált patkányok tesztoszteron-kiegészítő vizsgálata kasztrálással igazolta a tesztoszteron-hiány modelljét, bár a kísérletet nem mi végeztük.
Következtetések
- Mik a tűk és tűk Az állapotot az étrend hiánya okozhatja
- Az 5-alfa reduktáz hatása a férfiak tesztoszteronjára - teljes szöveges nézet
- Az alul diagnosztizált férfi étkezési rendellenességek egyre inkább azonosulnak az NPR-vel
- A bebörtönzés hatása a felnőtt férfi BMI-pályákra, Egyesült Államok, 1981–2006
- A férfi menopauza tünetei kibontva - ScienceDaily