A ketogén étrend hatása a májfunkcióra gyógyíthatatlan epilepsziában szenvedő gyermekeknél és serdülőknél
Shahabeddin Rezaei 1, 2, Mona Kavoosi 1, Reza Shervin Badv 3, Mahmoud Mohammadi 3, Gholam Reza Zamani 3, Mahmoud Reza Ashrafi 3, Mir Saeed Yekaninejad 4, Maryam Mahmoudi 1, 5, 6, *
1 Celluláris Molekuláris Táplálkozás Tanszék, Táplálkozástudományi és Dietetikai Iskola, Teheráni Orvostudományi Egyetem, Teherán, Irán
2 Hallgatói Tudományos Kutatóközpont, Teheráni Orvostudományi Egyetem, Teherán, Irán
3 Gyermekgyógyászati Kiválósági Központ, Gyermekneurológiai Osztály, Gyermekorvosi Központ, Teheráni Orvostudományi Egyetem, Teherán, Irán
4 Járványügyi és Biostatisztikai Tanszék, Közegészségügyi Iskola, Teheráni Orvostudományi Egyetem (TUMS), Teherán, Irán
5 Gyermek Gastroenterológiai és Hepatológiai Kutatóközpont, Gyermekorvosi Központ, Teheráni Orvostudományi Egyetem, Teherán, Irán
6 Dietetikai és táplálkozási szakértői csoport (DiNET), Egyetemes Tudományos Oktatási és Kutatási Hálózat (USERN), Teherán, Irán
Hogyan lehet idézni: Rezaei S, Kavoosi M, Shervin Badv R, Mohammadi M, Zamani G R és mtsai. A ketogén diéta hatása a máj működésére gyógyíthatatlan epilepsziában szenvedő gyermekeknél és serdülőknél, J Compr Ped. 2017; 8 (3): e12609. doi: 10.5812/tartalmaz.12609.
Absztrakt
Háttér: A ketogén étrend (KD) magas zsírtartalma és szénhidrát-korlátozása növeli egyes szervek, különösen a máj terhelését. Sőt, az antiepileptikumok (AED) nagy része a májban metabolizálódik; ezért a máj működését befolyásolni lehetett a KD kezelés alatt. Ezt a tanulmányt a ketogén étrend májfunkcióra gyakorolt hatásának vizsgálatára végezték.
Mód: Prospektív, nyílt vizsgálat készült. Összesen 28 kezelhetetlen epilepsziás beteg kezdte meg a diétát. Minden beteg gyermek és serdülő volt, akik nem reagáltak legalább 2 AED-re. A májfunkciós vizsgálatokat, köztük az alanin-aminotranszferázt (ALT), az aszpartát-aminotranszferázt (AST) és az alkalikus foszfatázt (ALP) elemezték 3 hónap előtt és után a KD-n.
Eredmények: Tizennégy, 4,12 (2,31–9,70) éves medián életkorú beteg fejezte be a vizsgálatot. Az ALP és az AST szérumszintje nem különbözött szignifikánsan az étrend 3 hónapja előtt és után (P érték> 0,05). Jelentős különbség volt az ALT szérumszintjében 3 hónapos kezelés előtt és után (13 vrs 20, P = 0,014).
Következtetések: Bár úgy tűnik, hogy a KD nem befolyásolta az AST és az ALP szérumszintjét; azonban jelentős hatással volt az ALT szérumszintjére. Több vizsgálat szükséges nagyobb mintamérettel és hosszabb utánkövetési időtartammal a fent említett eredmények jóváhagyásához.
1.Háttér
A ketogén étrend (KD) alacsony szénhidráttartalmú, magas zsírtartalmú, megfelelő fehérjetartalmú étrend. Elsősorban a KD-t vezették be a kezelhetetlen epilepszia kezelésére 1921-ben (1), azonban az utóbbi években a KD alkalmazása kiterjedt más betegségekre is, ideértve az eredendő anyagcsere-betegségeket (2), az autizmust (3) és a glioblastomát (4). Az eredetileg alkalmazott étrend a klasszikus KD volt, amely hosszú láncú trigliceridek az étrend elsődleges energiaforrása (90%) (5). Az étrend kiszámítása a zsír: szénhidrát plusz fehérje arány (ketogén arány) alapján történik. A klasszikus ketogén étrend aránya 4: 1 vagy 3: 1, 4 g (vagy 3 gramm) zsír és 1 g kombinált fehérje és szénhidrát aránya (5).
A KD kezelés alatt a test utánozza az éhgyomri anyagcsere-állapotokat (6). A zsír a KD-kezelés során domináns energiaforrássá válik glükóz helyett (6). A májban a hosszú láncú zsírsavak keton testekké alakulnak, beleértve a β-hidroxi-butirátot, az acetoacetátot és az acetont a β-oxidációs útvonalon keresztül (6).
Általában a kezelhetetlen epilepsziában szenvedő betegeknek hosszú távú epilepsziaellenes gyógyszerekre (AED) van szükségük (7). Az AED-ek zömét elsősorban a máj metabolizálja, beleértve a valproátot (VPA), karbamazepint, lamotrigint, fenobarbitált, oxkarbazepint, fenitoint, felbamátot, etosuximidet és benzodiazepineket (8). Ezenkívül néhány olyan AED, amely részben a májban metabolizálódik, beleértve a levetiracetámot, topiramátot és a zonisamidot (8).
Úgy tűnik, hogy a KD és az AED kombinációja befolyásolhatja a máj működését. Számos tanulmány számolt be a KD rövid és hosszú távú káros hatásairól (9, 10). Mégis, a KD hatása a máj működésére kétértelmű. Ezért ezt a vizsgálatot a klasszikus KD hatásának vizsgálatára végezték epilepsziás gyermekek és serdülők májenzimek szérumszintjére.
2. Módszerek
2.1. Tanulmány a népességről
Prospektív, nyílt címû tanulmánytervet alkalmaztak. A jelen vizsgálatot a Teheráni Orvostudományi Egyetem (TUMS) gyermekorvosi központjában végezték el 2015. szeptember és 2016. október között. A vizsgálatba bevonták a kezelhetetlen epilepsziában szenvedő betegeket, akik a következő kritériumokkal rendelkeztek; 1. 2 és 18 év közötti és 2. nem reagál legalább 2 epilepszia elleni gyógyszerre. A kizárási kritériumok a következőket tartalmazták: 1. korábbi KD kezelés; 2. olyan metabolikus betegségek története, amelyek ellenjavallt a ketogén étrend alkalmazásával, beleértve a piruvát-karboxiláz-hiányt és a közepes láncú acil-CoA-dehidrogenázt; 3. korábbi májbetegségek; 4. a dyslipidaemia kórtörténete; 5. a pajzsmirigy betegségeinek története; 6. vesebetegségek története; és 7. nyelési nehézség.
2.2. Ketogén diéta protokoll
Klasszikus KD-t indítottak a betegek számára. A betegek 4: 1, 4 gramm zsír és 1 gramm szénhidrát plusz fehérje ketogén arányát alkalmazták. Böjtöt, kalóriát vagy folyadékot nem korlátoztak. A diéta megkezdése előtt a betegeket olyan anyagcsere-betegségek után vizsgálták, amelyeknek ellenjavallata van a KD-re. Mivel a KD táplálkozási szempontból hiányos, a multivitamin és az ásványi anyag, valamint a további kalcium és D-vitamin kiegészítők minden betegnek beadásra kerültek. Az összes beteget telefonon követték nyomon a kezelés és az ambuláns látogatás során 1 és 3 hónap után a diétán.
2.3. Antropometriai értékelések
A betegek súlyát és magasságát a kiinduláskor és az étrend megkezdése után 3 hónappal mértük. A mérés előtt a résztvevőket arra kérték, vegyék le cipőjüket és nehéz ruháikat. A súly (kg) mérésére standardizált mérleg-nyaláb skálát alkalmaztunk. A magasságot (cm) stadiométerrel mértük. A testtömeg-indexet (BMI) a mért testtömeg kilogrammban elosztva osztjuk a mért magasság négyzetével (kg/m 2).
2.4. Májfunkció paraméterek
Vérmintát vettek reggel egy éjszakai böjt után. A májfunkciós paramétereket, nevezetesen az alanin-aminotranszferázt (ALT), az aszpartát-aminotranszferázt (AST) és az alkalikus foszfatázt (ALP) elemezték az étrend megkezdése előtt és a 3. hónapban.
2.5. Etikai szempontok
A tanulmány a Teheráni Orvostudományi Egyetem kutatási helyettese (etikai kódex, IR.TUMS.REC.1394.181512.11.94) etikai bizottságának jóváhagyása után indult. A diéta megkezdése előtt a betegek összes szülőjétől tájékozott beleegyezést kaptak. A betegek önként vettek részt a vizsgálatban, és a páciens szüleit biztosították abban, hogy a vizsgálat bármely szakaszában kiléphetnek a vizsgálatból. A betegek családjának semmilyen további költsége nem merült fel.
2.6. Statisztikai elemzések
Wilcoxon által aláírt rangvizsgálatot alkalmaztunk a májfunkciós tesztek átlagos szérumszintjének összehasonlítására a KD megkezdése előtt és után. Az eredményeket medián és interkvartilis tartományban (25. - 75. percentilis) mutatjuk be. Az összes teszt statisztikai szignifikancia szintje P volt
3. Eredmények
Összesen 28 kezelhetetlen epilepsziában szenvedő beteg kezdte meg a diétát, közülük 14 beteg fejezte be a vizsgálatot, köztük 11 fiú. Tizennégy beteg abbahagyta az étrendet az étrend intoleranciája, a család hajlandósága, kisebb acidózis és tüdőgyulladás miatt. A diéta kezdetén a medián életkor 4,12 év volt (interkvartilis tartomány: 2,31–9,70). Az 1. táblázat bemutatta a betegek általános jellemzőit.
1. táblázat: A vizsgálati populáció általános jellemzői
| Férfi nem | 11 (78,6%) |
| Női nem | 3 (21,4%) |
| Medián (interkvartilis tartomány) | |
| Kor (y) | 4,12 (2,31 - 9,70) |
| Magasság (cm) | 102,85 (90,00 - 137,92) |
| Súly (kg) | 15.00 (11.65 - 31.25) |
| BMI (kg/m 2 ) | 14,75 (13,80 - 16,35) |
Rövidítés: BMI, testtömegindex.
Az AST, az ALT és az ALP medián (interkvartilis tartományú) szérumszintje a kiinduláskor 21 (18 - 26) U/L, 13 (8 - 21) U/L, illetve 448 (288 - 708) U/L volt. . 3 hónap elteltével az AST szérumszintje 29 (17 - 38) U/L, az ALT szérumszintje 20 (14 - 44) U/L, az ALP szérumszintje pedig 453 (298 - 569) U volt./L.
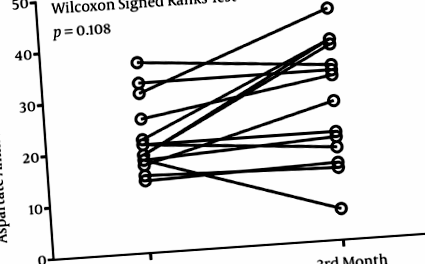
A kiindulási és a 3. hónapban nem volt különbség az ALP szintjében (P = 0,249) (1. ábra). A 0,108 P-érték elárulta, hogy az AST szérumszintje nem különbözött szignifikánsan 3 hónapos kezelés előtt és után (2. ábra). Jelentős különbség volt az ALT szérumszintjében 3 hónapos kezelés előtt és után (P = 0,014) (3. ábra).
4. Megbeszélés
Jelen tanulmányunkban prospektív módon megvizsgáltuk kezelhetetlen epilepsziában szenvedő betegek májfunkciós biomarkereit. A jelenlegi vizsgálat eredményei azt ábrázolták, hogy a klasszikus KD nem gyakorolt káros hatást az AST és az ALP szérumszintjére; azonban hatással van az ALT szérumszintjére.
A KD-nek vannak rövid és hosszú távú káros hatásai a betegekre (9). Hipoglikémia, acidózis, hányinger, székrekedés és hányás néhány példa a rövid távú mellékhatásokra (9). A hosszú távú káros hatások közül néhány a dyslipidaemia, a vesekő, az osteopenia és a karnitinhiány (11). Korábbi tanulmányok több esetről számoltak be, amikor a KD alkalmazását követően a májenzimek szérumszintje megváltozott (9, 12). Az Arslan és munkatársai által végzett vizsgálatban retrospektíven értékelték a KD hosszú távú hatását a betegeknél (12). 3 hónap elteltével 2 betegnél magas volt a szérum ALT és AST szint. Az egyik beteg VPA-t, valamint levetiracetámot használt, a másik pedig fenobarbitált és levetiracetamot szedett az étrend megkezdése előtt (12). Ezenkívül egy Kang és munkatársai által végzett tanulmányban a vizsgálatba bevont 129 beteg közül 10-en tapasztalták az ALT és az AST emelkedését (9).
Korábbi tanulmányok kimutatták, hogy az AED és a KD kombinációja, különösen a VPA, befolyásolhatja a máj működését. Stevens és mtsai. 18 hónapos kislányról számoltak be, aki májműködési zavart tapasztalt a KD megkezdése után. A beteg a VD-vel egyidejűleg vette a VPA-t. A páciens ALT- és AST-szintje drámai módon emelkedett 1 nap után KD-n, 13 NE/L-ről 750 NE/L-re, illetve 28 NE/L-ről 785 NE/L-re. A VPA megszüntetése után az ALT és az AST szérumszintje normálissá vált (13).
Egyik betegünknél jelentősen megemelkedett az ALS és az AST szérumszintje. Az eset 13 éves volt. Nitrazepamot és VPA-t szedett. Az AST és az ALT kiindulási szérumszintje 19 U/L, illetve 12 U/L volt. Három hónapos kezelés után az AST és az ALT szérumszintje 38, illetve 79 U/l-re emelkedett.
A Lyczkowski és munkatársai által végzett vizsgálatban 2, KD-t és VPA-t egyidejűleg szedő beteg emelte a májfunkciós enzimek szintjét a szérumban (14). 3 beteg után 1 betegnél az ALT és az AST szérumszintje 201 U/L-re, illetve 161 U/L-re emelkedett. A 2. páciens 2 hét diéta után megemelkedett a májfunkciós tesztekben (ALAT, 229 U/L; AST, 238 U/L). Bár a KD és VPA kombinációját kapó betegek és a kizárólag KD-t szedő betegek káros hatásainak összehasonlítása után arra a következtetésre jutottak, hogy a KD és a VPA egyidejű bevezetése nem növeli a hepatotoxicitás esélyét (14). Emellett Ballaban-Gil és mtsai. 2 olyan esetről számolt be, amelyeknél a májfunkciós biomarkerek jelentősen megemelkedtek a diéta megkezdése alatt és 13 hónappal a KD megkezdése után (15).
A májenzimek rendellenességeinek egyik mechanizmusa lehet az étrend és az AED karnitin tárolására gyakorolt hatása. A karnitin egy aminosav-származék, amely felelős a hosszú láncú zsírsavak mitokondriumba történő szállításáért (16). Korábbi tanulmányok azt mutatták be, hogy mindkét AED, különösen a VPA és a KD, kimeríti a karnitin tárolását (16). A VPA-t elsősorban a máj metabolizálja glükuronidáció és oxidáció útján (8, 16). A VPA 2 oxidációs útvonalon megy keresztül, nevezetesen a béta- és az omega-oxidáció útján. Hagyományosan a béta-oxidáció dominál az omega-oxidációval szemben (17). A béta-oxidációs folyamatban a VPA karnitinnel kombinálva jut el a mitokondriumba, ezért a karnitin tartalma fokozatosan csökkent (17). Sőt, a hosszú láncú triglicerid nagy mennyisége csökkenti a karnitin szintjét. Valójában a KD hozzáadása néhány AED-hez, különösen a VPA-hoz, szinergikusan befolyásolja a karnitin tárolásának kimerülését (16).
A karnitin mennyiségének csökkentése hepatotoxicitáshoz vezet (16). A pontos mechanizmus nem világos, azonban korábbi tanulmányok szerint a karnitin redukciója egyensúlyhiányhoz vezet a gamma- és a béta-oxidáció között. A gamma-oxidációs úton néhány toxikus metabolit képződik, beleértve a 4-en-VPA-t is. Karnitin hiányában a VPA gamma-oxidáción megy keresztül a béta-út helyett, ezért a toxikus metabolitok felhalmozódása hepatotoxicitáshoz vezet (16, 18).
Ennek a tanulmánynak voltak bizonyos korlátai. Jelen vizsgálat egyik korlátja a minta méretének száma volt. A jelenlegi vizsgálat másik korlátja a kontrollcsoport hiánya volt. Összegzésképpen úgy tűnik, hogy a KD nem befolyásolta az AST és az ALP szérumszintjét; azonban hatással volt az ALT szérumszintjére.
Köszönetnyilvánítás
Ezt a tanulmányt a Teheráni Orvostudományi Egyetem támogatta; számú támogatás 94-03-161-30342.
Hivatkozások
Wilder R. A ketonémia hatása az epilepszia lefolyására. Mayo Clin Proc. 1921;
Scholl-Burgi S, Holler A, Pichler K, Michel M, Haberlandt E, Karall D. Ketogén diéták örökletes anyagcserezavarokban szenvedő betegeknél. J Örökli a Metab Dis. 2015; 38(4): 765 -73 [DOI] [PubMed]
Castro. K., Faccioli LS, Baronio D, Gottfried C, Perry IS, dos Santos Riesgo R. A ketogén étrend hatása az autizmus spektrum zavaraira: Szisztematikus áttekintés. Res Autism Spectr Disord. 2015; 20: 31 -8
Winter SF, Loebel F, Dietrich J. A ketogén metabolikus terápia szerepe malignus gliomában: szisztematikus felülvizsgálat. Crit Rev Oncol Hematol. 2017; 112: 41 -58 [DOI] [PubMed]
Winesett SP, Bessone SK, Kossoff EH. A ketogén étrend gyógyszeres rezisztens gyermekkori epilepsziában. Neurother Rev Rev. 2015; 15(6): 621 -8 [DOI] [PubMed]
Masino SA, Rho JM. A ketogén diéta működésének mechanizmusai. Jasper az epilepsziák alapvető mechanizmusai. 2012; [PubMed]
McCorry D, Chadwick D, Marson A. Az epilepszia jelenlegi gyógyszeres kezelése felnőtteknél. Lancet Neurol. 2004; 3(12): 729-35 [DOI] [PubMed]
Ahmed SN, Siddiqi ZA. Epilepszia elleni gyógyszerek és májbetegségek. Lefoglalás. 2006; 15(3): 156 -64 [DOI] [PubMed]
Kang HC, Chung DE, Kim DW, Kim HD. A ketogén diéta korai és késői szövődményei kezelhetetlen epilepszia esetén. Epilepszia. 2004; 45(9): 1116 -23 [DOI] [PubMed]
Lin A, Turner Z, Doerrer SC, Stanfield A, Kossoff EH. Komplikációk a ketogén diéta kezdetén: elterjedtség, kezelés és a rohamok kimenetelére gyakorolt hatás. Pediatr Neurol. 2017; 68: 35 -9 [DOI] [PubMed]
Cervenka MC, Henry BJ, Kossoff EH, Zahava Turner R. A ketogén és módosított atkins étrend: epilepszia és más rendellenességek kezelése. 2016;: 376
Arslan N, Guzel O, Kose E, Yilmaz U, Kuyum P, Aksoy B és mtsai. A ketogén diétás kezelés hepatotoxikus-e a nehezen kezelhető epilepsziában szenvedő gyermekek számára? Lefoglalás. 2016; 43: 32 -8 [DOI] [PubMed]
Stevens CE, Turner Z, Kossoff EH. Májműködési zavar, mint a kombinált valproát és ketogén étrend szövődménye. Pediatr Neurol. 2016; 54.: 82 -4 [DOI] [PubMed]
Lyczkowski DA, Pfeifer HH, Ghosh S, Thiele EA. A ketogén étrend biztonságossága és tolerálhatósága gyermek epilepsziában: a valproát kombinációs terápia hatásai. Epilepszia. 2005; 46(9): 1533 -8 [DOI] [PubMed]
Ballaban-Gil K, Callahan C, O'Dell C, Pappo M, Moshe S, Shinnar S. A ketogén étrend szövődményei. Epilepszia. 1998; 39(7): 744 -8 [PubMed]
Lheureux PE, Hantson P. karnitin a valproinsav által kiváltott toxicitás kezelésében. Clin Toxicol (Phila). 2009; 47(2): 101 -11 [DOI] [PubMed]
Singh G. Az epilepsziához kapcsolódó orvosi komorbiditás kezelése. Az epilepszia kezelése. 2009;: 259 -72
Bjornsson E. Az epilepszia elleni gyógyszerekkel összefüggő hepatotoxicitás. Acta Neurol Scand. 2008; 118(5): 281 -90 [DOI] [PubMed]
- A ketogén étrend egy prospektív módon beiratkozott 150 gyermek 3-6 éves követése - PubMed
- A ketogén étrend és más diétás kezelések a gyermekek refrakter epilepsziájához
- Anyád; az étrend befolyásolhatja máját; s egészsége
- A ketogén diéta és az epilepszia; Gyermekek; s Egészség
- A gyermekek és serdülők számára készült élelmiszer-útmutató rendszer „optimalizált vegyes étrend” értékelése -