A komorbid étkezési rendellenességgel járó bipoláris rendellenesség genomszerte végzett vizsgálata replikálja a SOX2-OT régiót
Xiaohua Liu
1 Pszichiátriai Osztály, Sanghaj Mentálhigiénés Központ, Sanghaj Jiao Tong Egyetem Orvostudományi Kar, Sanghaj, PR Kína
John R. Kelsoe
2 Pszichiátriai Tanszék, Kalifornia Egyetem, San Diego, La Jolla, Kalifornia, USA
3 San Diego Veterans Affairs Healthcare System, San Diego, Kalifornia
4 Genomi Orvostudományi Intézet, Kaliforniai Egyetem, San Diego, La Jolla, Kalifornia
Tiffany A. Greenwood
2 Pszichiátriai Tanszék, Kalifornia Egyetem, San Diego, La Jolla, Kalifornia, USA
Társított adatok
Absztrakt
Háttér
A bipoláris rendellenesség egy heterogén hangulati rendellenesség, amely számos fontos klinikai társbetegséggel, például étkezési rendellenességekkel társul. Ez a klinikai heterogenitás megnehezíti a genetikai variánsok azonosítását, amelyek hozzájárulnak a bipoláris érzékenységhez. Itt megvizsgáljuk az étkezési rendellenességek komorbiditását, mint a bipoláris rendellenesség szubfenotípusát, hogy azonosítsuk a genetikai variációkat, amelyek mindkét rendellenességre jellemzőek és egyediak.
Mód
Genom-szintű asszociációs elemzést végeztünk, amely 184 bipoláris étkezési rendellenesség komorbiditását állította szembe egymással, mind a 1.370 kontroll, mind a 2.006 bipoláris zavarban szenvedő alany ellen, csak a Bipolar Genome Study (BiGS) vizsgálatával.
Eredmények
A legjelentősebb, az egész genomra kiterjedő megállapítást komorbid étkezési rendellenességgel bipolárisan, a SOX2-OT-n belüli kontrollokkal szemben figyelték meg (p = 8,9 × 10-8 az rs4854912 esetében), a másodlagos csúccsal a szomszédos FXR1 génben (p = 1,2 × 10-6 az rs1805576) a 3q kromoszómán26.33. Ez a régió volt a legkiemelkedőbb megállapítás a csak esetek elemzésében (p = 3,5 × 10 −7, illetve 4,3 × 10 −6). Számos érdeklődésre számot tartó régiót azonosítottak a neurodevelopment és a neuroprotection folyamatokban részt vevő génekkel is.
Korlátozások
Míg elsődleges megállapításunk nem egészen érte el a genom egészére kiterjedő jelentőséget, valószínűleg a viszonylag korlátozott minta miatt, ezek az eredmények egy étkezési rendellenességek nemrégiben végzett tanulmányának ismétléseként tekinthetők nagy kohorszban.
Következtetések
Ezek a megállapítások megismétlik az SOX2-OT előzetes társulását az étkezési rendellenességekkel, és széles körben támogatják a neurodevelopmentális/neuroprotektív mechanizmusok bevonását mindkét rendellenesség patofiziológiájában. Továbbá azt sugallják, hogy a bipoláris rendellenesség különböző klinikai megnyilvánulásai tükrözhetik a különböző genetikai hozzájárulást, és a klinikai szubfenotípusok hasznosságával érvelnek a betegséghez vezető további molekuláris utak azonosításában.
BEVEZETÉS
A bipoláris rendellenesség súlyos hangulati rendellenesség, becsült örökölhetősége 60–93% (Kieseppa és mtsai, 2004; Lichtenstein és mtsai, 2009; McGuffin és mtsai, 2003; Taylor és mtsai, 2002). A nagy minták genomszintű társulásának (GWA) vizsgálata a közelmúltban számos erős jelöltet azonosított a fogékonyság génjeire, köztük az ADCY2, ANK3, CACNA1C, NCAN, ODZ4 és TRANK1 (Cichon et al., 2011; Ferreira et al., 2008; Green et al., 2013; Chen et al., 2013; Muhleisen et al., 2014; Psychiatric GWAS Consortium Bipolar Disorder Working Group, 2011), bár azok az utak, amelyek révén a genetikai variánsok befolyásolják a kockázatot, összetettek és nagyrészt ismeretlenek. A bipoláris rendellenesség komplex, nagyon változó klinikai megnyilvánulásokkal is jár, beleértve számos fontos társbetegséget, amelyek a rendellenességek altípusainak széles skáláját alkotják (MacQueen és mtsai, 2005). Ez a fenotípusos heterogenitás akadályozza a fogékonyságot elősegítő genetikai változatok tisztázását, mivel a bipoláris betegek adott mintavétele valószínűleg több különböző altípusból áll, amelyek mindegyike egyedi genetikai felépítésű (Alda, 2004; Alda et al., 2009). A rendellenességgel közismert klinikai tényezőkből származó szubfenotípusok alkalmazása homogénebb alcsoportokat hozhat létre a betegek mögött, akiknek genetikai kockázati tényezői megkülönböztethetőek (Saunders et al., 2008). Míg a bipoláris rendellenesség számos potenciálisan fontos szubfenotípusát azonosították a jellegzetes tünetek vagy komorbiditás részeként (MacQueen és mtsai., 2005; Saunders és mtsai., 2008), kevés GWA-elemzés használta a bipoláris rendellenesség klinikai szubfenotípusait (Greenwood és Kelsoe, 2013; Swaminathan és mtsai, 2015; Winham és mtsai, 2014).
A bizonyítékok erős kapcsolatra utalnak a bipoláris rendellenesség és az étkezési rendellenességek etiológiája között. A bipoláris rendellenességben szenvedő betegeknél magasabb az étkezési rendellenességek aránya (McElroy és mtsai, 2013; McElroy és mtsai, 2006; McElroy és mtsai, 2005), az étkezési rendellenességek társbetegségét gyakrabban figyelik meg a női, mint a férfi bipoláris betegeknél (Kawa et al. al., 2005; McElroy és mtsai, 2011), összhangban az általános populáció megfigyeléseivel (Hudson és mtsai, 2007). Míg a mértéktelen étkezési magatartás aránya 13 és 38% között mozog bipoláris rendellenességben (Kruger és mtsai., 1996; Ramacciotti és mtsai., 2005), úgy tűnik, hogy az étkezési rendellenességek komorbiditása nem korlátozódik az aberrált étkezés viselkedési jellemzőire (pl. mértéktelen evés, megtisztítás, étrendi korlátozás), és jelezheti a megnövekedett tünetterhelést és betegségterhet (Wildes et al., 2007). Végül az epidemiológiai vizsgálatok összefüggést sugallnak az étkezési rendellenességek és a küszöb alatti bipoláris tünetek között, beleértve az affektív temperamentumokat, valamint a hipomania és a mértéktelen étkezési magatartások között, és a két rendellenesség jelentős átfedést mutat a fenomenológia, a lefolyás, a társbetegség, a családtörténet és a farmakológiai szempontból. kezelési válasz (Lunde és mtsai, 2009; McElroy és mtsai, 2005).
Ez a szoros kapcsolat a bipoláris rendellenesség és az étkezési rendellenességek között részben átfedő patogenezisre utalhat (McElroy és mtsai., 2005), vagy arra utalhat, hogy az étkezési rendellenesség komorbiditása a bipoláris rendellenesség sajátos alfenotípusát alkotja, egyedülálló genetikai felépítéssel. GWA-elemzéssel igyekeztünk felfedezni a táplálkozási rendellenességek fokozott kockázatával járó genetikai variánsokat a bipoláris rendellenességben szenvedő egyénekben.
MÓD
Tárgyak
A vizsgálatban részt vevő betegeket a Bipolar Genome Study (BiGS) vizsgálatból származtatták. A BiGS részeként végzett genotipizáláshoz az Európai Ősök bipoláris I. alanyait választották ki azok közül, amelyeket az Országos Mentális Egészségügyi Intézet (NIMH) genetikai kezdeményezése bipoláris rendellenességgel gyűjtött öt hullámban 11 helyszínen az Egyesült Államokban, részletesen máshol (Dick és mtsai, 2003; Smith és mtsai, 2009). Valamennyi alanyot a diagnosztikai interjú a genetikai vizsgálatokhoz (DIGS) segítségével értékeltük, amelyet a családinformátorok adataival és az orvosi nyilvántartásokkal kombináltunk, hogy a DSM-III-R vagy DSM-IV kritériumok alapján a legjobb becsléssel diagnosztizálhassuk (Nurnberger et al., 1994). A kontroll alanyokat azok közül választottuk ki, akiket Dr. Pablo Gejman és a Knowledge Networks, Inc. (NIMH által támogatott szerződéses mechanizmus révén állapítottak meg) (Sanders et al., 2010). A kiválasztott kontrollokat a nem és az etnikai hovatartozás (azaz az európai ősök) alapján egyeztettük a bipoláris páciensekkel, és minden olyan kontrollalanyot kizártunk ebből a vizsgálatból, aki előzőleg jóváhagyta a bipoláris rendellenességet, pszichózist vagy súlyos depressziót az orvosi kérdőívben.
Genotipizálás és tisztítás
A kezdeti mintát a Broad Institute-ban, a Genetikai Társadalmi Információs Hálózat (GAIN) részeként, az Affymetrix 6.0 (1 M SNP) tömb felhasználásával genotipizáltuk. Összesen 1001 bipoláris eset, 1033 kontroll és 724 067 SNP állt rendelkezésre elemzésre egy átfogó minőség-ellenőrzési (QC) folyamatot követően, amelynek során kiküszöbölték az olyan alanyokat, akiknek ≥5% -a hiányzott, és azokat az SNP-ket, akiknek ≥5% -a hiányzott, kisebb allélfrekvenciák (MAF) −6 (Smith és mtsai, 2009). 1198 bipoláris esetből és 403 kontrollból álló második mintát hasonlóan genotipizáltak a Translational Genomics Institute-ban (TGEN), és egy hasonló QC-folyamaton ment keresztül, amelynek eredményeként 728 187 SNP-t eredményeztek elemzésre (Smith és mtsai, 2011). Az összevont GAIN és TGEN mintákon végzett további minőségellenőrzési kör 703 012 áthaladó SNP-t eredményezett. Az államonkénti azonosítást (IBS) használták a rejtélyes rokonságban lévő egyének azonosítására és eltávolítására. A minta genetikai homogenitását többdimenziós méretezéssel (MDS) biztosítottuk. Az összes egyénről azt állították, hogy európai származású, és nem fedeztek fel népességi eltéréseket. A végső bipoláris kohort (N = 2190) 58,7% nő, átlagos életkora 42,6 ± 12,7, a kontroll kohorsz (N = 1370) 46,4% nő, átlagos életkora 52,2 ± 17,1.
Fenotípusok
A gyermekkori életesemények skáláját (CLES) az interjú idején a kohorsz egy részén kezelték, hogy dokumentálják a különböző traumatikus eseményeket, amelyek 3-12 éves kor között fordulhatnak elő, 12 esemény skálán 9 eseményen. Ezt az eszközt kumulatív összesített pontszámként értékeltük, és a bevált módszerek alapján tovább értékeltük a ≥2 eseményt tapasztaló alanyokat (Anand et al., 2015). A traumát külön-külön is három kategóriában értékeltük: 1) egy szülő vagy testvér halála, váratlan elhagyása és más súlyos életet megváltoztató események; 2) krónikus betegség kezdete, hosszabb kórházi kezelés (≥1 hónap) és maradandó sérülés vagy rokkantság; és 3) fizikai bántalmazás és erőszakos életveszélyes tapasztalatok. Megjegyezzük, hogy a második kategória egyes válaszait megzavarja a hangulati tünetek megjelenése ebben a kohorszban. Az érvényes teljes adatokkal rendelkező 1396 bipoláris beteg, köztük 131 evészavaros komorbiditású beteg átlagos CLES-pontszáma 1,4 ± 1,6 (0–10 tartomány).
Statisztikai elemzések
Első analízist végeztek a komorbid étkezési rendellenességekkel (BD + ED, N = 184) az egészséges kontrollokkal (CTL, N = 1370) összehasonlítva, hogy azonosítsák az ezen altípusra jellemző genetikai tényezőket. Csak egy kiegészítő esetanalízis során a komorbid csoportot összehasonlítottuk a nem komorbid csak bipoláris csoporttal (BDO, N = 2006), hogy azonosítsuk azokat a genetikai tényezőket, amelyek módosíthatják az étkezési rendellenességek expresszióját a bipoláris rendellenesség összefüggésében. Ezeket az eredményeket szembeállítottuk a nem komorbid csoportot a kontrollokkal összehasonlító elemzés eredményeivel, hogy értékeljük az eredő asszociációk étkezési rendellenességek komorbiditására vonatkozó specifitását. A 3q36.33 régió női nem-specifikus elemzései 158 BD + ED, 1127 BDO és 636 CTL alanyokat tartalmaztak. Valamennyi asszociációs elemzést logisztikai regresszióval hajtottuk végre a PLINK-ben (Purcell et al., 2007). Mivel az elemzések genomi inflációs tényezői 1,00 és 1,016 között mozogtak, nem tartották szükségesnek a populáció rétegződésének korrekcióját. Az eredmények empirikus jelentőségének és stabilitásának felmérése érdekében címkekapcsoló permutációkat hajtottunk végre.
EREDMÉNYEK
Először minden bipoláris beteget megvizsgáltak a különféle klinikai jellemzők tekintetében, amelyek összefüggenek az elhízás és a kiürülés viselkedésével, valamint a diéta, a testmozgás és a fogyás szokásaival. A 2190 teljes bipoláris páciens közül 272 (12,4%) szándékosan sokat fogyott, 320-nál (14,6%) pedig legalább három hónapig hetente kétszer gyakran evett. Mindazonáltal csak 184 (8,4%) teljesítette az étkezési rendellenességek teljes diagnosztikai kritériumait, amelyek közül 66 (3%) anorexia nervosa, 109 (5%) bulimia nervosa, és 9 (0,4%) másként nem meghatározott étkezési rendellenesség volt. A komorbid étkezési rendellenességekben szenvedők közül 15,8% korlátozta a típusú anorexiát, 20,1% a mértéktelen étkezést/öblítést végző típusú anorexiát, 39,7% a tisztító típusú bulimia és 19,6% nem tisztító típusú bulimia volt. Mivel az adatok azt sugallják, hogy az anorexia és a bulimia nervosa genetikai kockázati tényezőket oszt meg és a felelősség folytonosságán léteznek (Kaye, 2008), ezeket a diagnózisokat és altípusaikat kombináltuk az étkezési rendellenesség komorbiditásának értékelésére bipoláris rendellenességben.
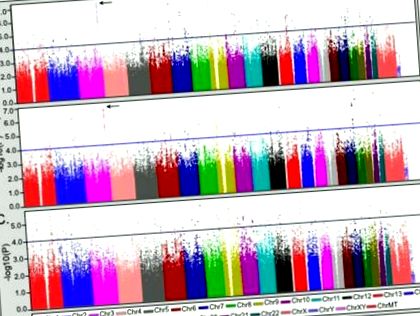
A klinikai összehasonlítás eredményei arra utalnak, hogy az étkezési rendellenességek komorbiditása a bipoláris rendellenesség sajátos alfenotípusát képezheti. Annak érdekében, hogy meg lehessen különböztetni a komorbid étkezési rendellenességek altípusára jellemző genetikai tényezőket azoktól, amelyek módosítják az étkezési rendellenességek kifejeződését a bipoláris rendellenességben, a komorbid csoportot (BD + ED) összehasonlítottuk az egészséges kontrollokkal (CTL) és csak a bipoláris csoport (BDO), ill. Ezeket az eredményeket ezután szembeállítottuk a BDO és a CTL elemzésével, hogy értékeljük az étkezési rendellenességek komorbiditásának specifitását. A genomszintű elemzések eredményeit az 1. ábra mutatja. Az érdeklődésre számot tartó genomi régiókat úgy határoztuk meg, hogy legalább két SN-p-vel rendelkezzenek, p-4-gyel, további asszociációs támogatással (azaz p-3), amelyet a környező SNP-k biztosítanak 100 kb-on belül. Az ezen kritériumoknak megfelelő régiók átfogó listáját az S1 kiegészítő táblázat tartalmazza az összes elemzés statisztikájának összehasonlításával.
A komorbid étkezési rendellenességgel (BD + ED) összehasonlítva az egészséges kontrollokkal (CTL) és a nem komorbid csak bipoláris csoporttal (BDO) végzett genom-szintű asszociációs elemzés eredményei. (A) A BD + ED (N = 184) és a CTL (N = 1370) elemzése. (B) Csak a BD + ED és a BDO elemzése (N = 2006). (C) Az összehasonlítás céljából a BDO és a CTL elemzését adjuk meg. Minden panelen egy kék vonal jelzi a p-4-et, egy nyíl pedig a 3q26.33 régiót.
A 3q26 régió részletei a LocusZoom-tól (Pruim et al., 2010), bemutatva a kromoszóma kontextust, a kötés egyensúlyhiányának szerkezetét és a rekombinációs mintákat, amelyek körülveszik az SNP csúcsot (rs4854912), amelyet lila gyémántként mutatnak be. Valamennyi hely a hg 18 összeállításon alapul, és a kapcsolódási egyensúlyhiány mintázatát a régióban a CEPH referenciapopuláció szerint mutatjuk be a HapMap 22. kiadásából, piros színnel jelezve a teljes egyensúlyhiányt (D '= 1). A bemutatott asszociációs eredmények megfelelnek a BD + ED vs. CTL elemzésnek (lásd az 1A. Ábrát), az ps csúcsértéke 8,9 × 10-8 volt megfigyelhető az rs4854912 esetében. A közeli SOX2-OT és FXR1 géneket is bemutatjuk. A BD + ED és a BDO elemzés nagyon hasonló regionális asszociációs diagramot hozott létre, és az elemzés SNP csúcsát, az rs10386738 értéket is feltüntették.
Ezen elemzések során számos más érdeklődésre számot tartó genomi régiót is kimutattak (lásd az S1 táblázatot és az S1 ábrát). A 13q33.1 kromoszómán a NALCN-hez való asszociációt figyeltük meg leginkább a BD + ED és a CTL összehasonlításakor (p = 6,0 × 10-6, OR = 1,7 az rs9554752 esetében), és a szignifikancia régió kiterjedt a szomszédos NALCN-AS1-re. gén, amely a NALCN antiszensz RNS-ét kódolja, p értéke −4. A BD + ED és a CTL elemzésében a legérdekesebb egyéb gének közül az NRF1 a 7q32.2, az NRG3 a 10q23.1 és az ADNP a 20q13.13. A 21q22.3 kromoszómán lévő ABCG1 gén a BD + ED vs. BDO elemzésben volt a legszembetűnőbb (csúcs p = 4,3 × 10 −7). A BD + ED és a BDO és a CTL elemzésében érdekes gének magukban foglalták a CADM3-ot az 1q23.2 kromoszómán, az ATP2B4-et az 1q32.1-en és az RYR2-t 1q43-on.
VITA
A bipoláris rendellenesség jelentős klinikai fenotípusos heterogenitást mutat, ami tükrözheti az alapul szolgáló genetikai architektúra különbségeit. A klinikai jellemzők felhasználása a diagnózis finomítására és a fenotípusos heterogenitás csökkentésére további erőt adhat a genetikai kockázati variánsok kimutatásához (Manchia et al., 2013). A részben átfedő patogenezisre utaló korábbi bizonyítékok alapján a bipoláris rendellenességet étkezési rendellenesség komorbiditással vizsgáltuk GWA-elemzéseken keresztül azoknak a variánsoknak az azonosítása felé, amelyek egyedülállóan hozzájárulnak ehhez a szubfenotípushoz, vagy mind a bipoláris, mind az étkezési rendellenességek kockázatához (McElroy et al., 2005).
A SOX2-OT a 2-es gént (SOX2) tartalmazó átfedő transzkriptet kódoló SRY-boxot kódolja, és splicezett, hosszú, nem fehérjét kódoló RNS-ként (lncRNS) azonosítottuk, amelynek intronja átfedte a SOX2 gént ugyanabban a transzkripciós orientációban. A SOX2-OT szabályozhatja az SOX2 expresszióját, amelynek terméke kulcsfontosságú szerepet játszik mind az embrionális, mind a felnőttkori neurogenezisben (Amaral et al., 2009). Úgy tűnik, hogy a SOX2-OT biomarkert jelent a neurodegeneráció korai és késői szakaszában is (Arisi és mtsai., 2011), és az asszociációs csúcsunk régiójában található disztális, erősen konzervált elemből átírt SOX2-OT izoform kizárólag az agyban fejeződik ki a felnőttkori neurogenezis régióinak dúsításával (Amaral et al., 2009). Az FXR1 a Fragile X mentális retardációval kapcsolatos fehérje 1 (FMR1) autoszomális homológja, amely felelős az emberek Fragile-X szindrómáért (Ashley et al., 1993; Siomi et al., 1993; Siomi et al., 1995 ). Az embrionális fejlődés során az FXR1 expressziója a proliferáció és a differenciálódás korai szakaszára korlátozódik a központi idegrendszer régióiban, ami arra utal, hogy az FXR1 fontos szerepet játszhat az idegsejtek proliferációjában és a korai agyfejlődésben (Coy et al., 1995).
Csak az esetek elemzése, amelynek célja az evészavar komorbiditásának expresszióját módosító gének azonosítása bipoláris rendellenességben, az ABCG1-et vonta be a 21q22 kromoszómába. Ezt a régiót korábban bevonták a bipoláris rendellenesség genetikai összekapcsolódásának vizsgálatába (Aita és mtsai, 1999; Kaneva és mtsai, 2004; Straub és mtsai, 1994), és az ABCG1-t egyaránt helyzeti és funkcionális jelölt génként javasolták. bipoláris rendellenesség (Kirov és mtsai, 2001) . Az ABCG1 kódolja az ATP-kötő kazetta G alcsaládját, egy transzporter fehérjét, amely részt vesz a hangulat patofiziológiájában részt vevő triptofán, a szerotonin előfutára sejtfelvételében. rendellenességek. A szerotonin az étkezési viselkedés kulcsfontosságú szabályozója is, és a szerotonerg diszfunkcióhoz hozzájáruló genetikai variánsok hatással vannak az étkezési rendellenességekre (Kaye, 2008; Lucki, 1998).
A jelen tanulmányban érdekelt régiók nem tartalmazták a bipoláris rendellenesség korábbi GWA-tanulmányai által azonosított géneket, például ADCY2, ANK3, CACNA1C, NCAN, ODZ4 és TRANK1 (Cichon et al., 2011; Ferreira et al., 2008; Green et al., 2013; Chen és mtsai, 2013; Muhleisen és mtsai, 2014; Psychiatric GWAS Consortium Bipolar Disorder Working Group, 2011). Ezek a régiók nem tartalmaztak olyan géneket sem, amelyekről beszámoltak arról, hogy anorexia nervosa-val társulnak, például CTNNA2, CNTNAP2, EPHX2, GABRG1, HTR1D, OPRD1 és PPP3CA (Bloss et al., 2011; Boraska et al., 2014; Scott -Van Zeeland és mtsai, 2014; Wang és mtsai, 2011). Ez, kombinálva a BD + ED analízisben nem szereplő gének azonosításával, amelyek nem voltak szignifikánsak a BDO vs. CTL elemzésben, arra utal, hogy az étkezési rendellenességekkel együtt járó bipoláris rendellenesség egyedülálló klinikai fenotípust jelenthet, amely különbözik mind a bipoláris rendellenességtől, mind az evéstől rendellenességek. Elemzéseink úgy tűnik, hogy széles körben alátámasztják a neurodevelopmenthez és a neuroprotektív mechanizmusokhoz kapcsolódó érintettségi géneket a bipoláris rendellenesség patofiziológiájában és e klinikai altípus expressziójának módosítását (Harwood, 2003; Rowe és Chuang, 2004; Sanches és mtsai, 2008; Soeiro -de-Souza és mtsai, 2012).
Összefoglalva, megerősítettük a nemrégiben azonosított anorexia nervosa jelölt gén társulását étkezési rendellenességek komorbiditású bipoláris betegeknél. Meghatároztunk több olyan érdeklődésre számot tartó genomi régiót is, amelyek a neurodevelopment és a neuroprotekciós folyamatokban részt vevő géneket tartalmaznak, amelyek relevánsak lehetnek az étkezési rendellenességek specifikus patofiziológiájában a bipoláris rendellenességek komorbiditása szempontjából, vagy a bipoláris rendellenesség és az étkezési rendellenességek mögött meghúzódó közös patofiziológia részét képezhetik. Bár ezek az eredmények megerősítést igényelnek nagyobb adatállományokban, támogatják azt az elképzelést, hogy a bipoláris rendellenesség különböző klinikai megnyilvánulásai tükrözhetik a mögöttes genetikai architektúra különbségeit.
KIEMELTEK
Értékelték az étkezési rendellenességek genomszintű összefüggését a bipoláris rendellenességen belül.
Ezek az eredmények megismétlik a SOX2-OT előzetes társulását az étkezési rendellenességekkel.
- 10 jel arra utalhat, hogy étkezési rendellenességei vannak
- 10 finom jel, hogy valaki, akit szeret, önnek étkezési zavara lehet
- Anorexia, bulimia, a túlzott étkezési rendellenességek tényei - Thriveworks
- Egy anorexiás hallgató maga mögé utasította a halálos étkezési rendellenességet, hogy megkoronázza a bikini bajnokot -
- Az étkezési rendellenesség 5 finom jele a legtöbb szülő figyelmen kívül hagyja