A krónikus, magas zsírtartalmú étrend csökkentette a detrusor mitokondriális légzést és fokozta az ideg által közvetített összehúzódásokat
Shelby A. Powers
1 Élettani Tanszék, Brody Orvostudományi Kar, Kelet-Karolina Egyetem, Greenville, NC, USA
Terence E. Ryan
1 Élettani Tanszék, Brody Orvostudományi Kar, Kelet-Karolina Egyetem, Greenville, NC, USA
2 East Carolina Diabetes és Obesity Institute, East Carolina University, Greenville, NC, USA
Alkalmazott Élettani és Kineziológiai Tanszék, Floridai Egyetem, Gainesville, FL, USA
Elena S. Pak
1 Élettani Tanszék, Brody Orvostudományi Kar, Kelet-Karolina Egyetem, Greenville, NC, USA
Matthew O. Fraser
4 Sebészeti Osztály, Duke University Medical Center, Durham, NC, USA
5 Kutatási és Fejlesztési Tanszék, Durham Veterans Affairs Medical Center, Durham, NC, USA
Joseph M. McClung
1 Élettani Tanszék, Brody Orvostudományi Kar, Kelet-Karolina Egyetem, Greenville, NC, USA
2 East Carolina Diabetes és Obesity Institute, East Carolina University, Greenville, NC, USA
Johanna L. Hannan
1 Élettani Tanszék, Brody Orvostudományi Kar, Kelet-Karolina Egyetem, Greenville, NC, USA
2 East Carolina Diabetes és Obesity Institute, East Carolina University, Greenville, NC, USA
Absztrakt
A krónikus, magas zsírtartalmú étrend (HFD) hatásának értékelése a hím egerek viselkedési ürülési mintázataira, a detrusor kontraktilitására és a simaizom mitokondriális működésére.
Mód:
A hím C57BL/6J egereket (6 hét) kontroll vagy HFD-vel etettük 20 hétig. A hólyag működését üres foltvizsgálatokkal értékeltük. A hólyagokat összegyűjtöttük, és detrusor kontraktilitást kaptunk a karbachollal szemben (10-9-10-10 M), és mértük az elektromos mező stimulációt (EFS, 0,5-32 Hz) atropin jelenlétében és távollétében. A homogenizált detrusor mintákat oxigrafákba helyeztük, hogy felmérjük a mitokondrium oxigénfogyasztásának mértékét a detrusorban különböző szubsztrátok jelenlétében. A mitokondriális hidrogén-peroxid (H2O2) emissziót fluorometriásan mértük. A Detrusor-citrát-szintáz aktivitást enzimaktivitás-készlettel mértük, és Western-blotokkal értékeltük az elektrontranszportlánc (ETC) fehérjetartalmát.
Eredmények:
A HFD jelentősen megnövelte a testtömeget, az adipozitást és a vércukorszintet. A HFD egerek megnövekedett ürítési gyakoriságot és fokozott EFS-indukált detrusor kontraktilitást mutattak. A detrusor relaxációjában és a kolinerg gyógyszeres kontrakcióban nem történt változás. A mitokondriális légzés HFD-vel csökkent és a H2O2-kibocsátás növekedett. A detrusorban lévő mitokondriumok relatív mennyisége hasonló volt a csoportok között. Az ETC V és III komplexek azonban megnövekedtek a HFD után.
Következtetések:
A krónikus HFD fokozta az adipozitást, gyakoribb ürítéshez és fokozott EFS által közvetített detrusor összehúzódásokhoz vezetett. A mitokondriális légzés csökkent és a H2O2 emisszió nőtt a HFD után. További kutatásokra van szükség annak megállapításához, hogy a mitokondriális funkció megváltozása szerepet játszhat-e a HFD által kiváltott hólyag-diszfunkció kialakulásában.
1. Bemutatkozás
Az Egyesült Államokban a felnőttek több mint 40% -a elhízott. 1 A magas telített zsírtartalmú gyors és gyors étkezés, valamint a mozgásszegény életmód ösztönzi ezt a járványt. Az elhízás a szív- és érrendszeri betegségek, a rák, a zsíros májbetegségek és a 2-es típusú diabetes mellitus (T2DM) kialakulásának kockázati tényezője. A túlsúly vagy az elhízás a vizeletinkontinencia független kockázati tényezője. 2 A testtömeg-index (BMI) minden 5 egységnyi növekedése a vizeletinkontinencia 20–70% -kal megnövekedett kockázatával jár. 2 A nyálkahártya réteg (lamina propria, urothelium) vagy a detrusor simaizomréteg fiziológiájának megváltoztatása, valamint az innerváció változásai hozzájárulhatnak a hólyag diszfunkciójához. Az elhízás okozta hólyag-diszfunkció tünetei a túlaktív hólyagtól kezdve a stresszig és/vagy az inkontinencia sürgetéséig terjednek. 3 Bár feltételezik, hogy az elhízás növeli a hasi nyomást és hozzájárul az inkontinencia kialakulásához, a hólyag diszfunkciójához vezető patológiás változások hátterében álló mechanizmusok továbbra sem ismertek.
Az elhízás gyakori modellje, amelyet a hólyag diszfunkciójának tanulmányozására használnak, az egerek, amelyek magas zsírtartalmú étrendet (HFD) táplálnak. Ez az egérmodell értékes az elhízás okozta hólyag-diszfunkció kialakulásának megértésében. Korábbi tanulmányok megállapították, hogy a hím egereknek, akiket HFD-vel tápláltak 10–12 hétig, megnövekedett testtömeg, hiperlipidémia és inzulinrezisztencia alakult ki. 4,5 Ezenkívül az altatott cisztometria megnövekedett ürítési gyakoriságot, nem üreges összehúzódásokat és ex vivo húgyhólyag-összehúzódást jelez, miközben a húgyhólyag relaxációja károsodott. 4,5 E tanulmányok többsége a hólyag teljes fiziológiáját írja le a HFD által kiváltott elhízás modelljeivel; azonban kevesen határozták meg, hogy milyen mögöttes mechanizmusok vezetnek a hólyag diszfunkciójához.
Az elhízás és a HFD gyakran fokozott oxidatív stresszhez és gyulladáshoz vezet; szisztémásan és a hólyagban egyaránt. A HFD által kiváltott gyulladás forrása a mitokondriumok által termelt szabad gyökös reaktív oxigénfajok (ROS), amelyek mind a lipideket, mind a fehérjéket képesek oxidálni. 7 A mitokondriumok ATP-t termelnek, amely szükséges a hólyag energiafogyasztásához, kritikus fontosságú a sejtes homeosztázis fenntartása szempontjából, és a húgyhólyag összehúzódásában részt vevő jelzési modell. Patkányokban, amelyek energiadús, magas fruktóz-étrendet kaptak, nyilvánvaló volt a húgyhólyag összehúzódásának csökkenése in vitro, és a hólyag simaizomsejtjeiben duzzadt, degenerálódó mitokondriumokat találtak. A hólyag mitokondriális diszfunkciójának markereit a részleges hólyagkimeneti obstrukció nyúlmodelljeiben és patkány HFD modelljében mutatták be; azonban a mitokondriális funkciót és a mitokondriális eredetű ROS-termelést nem mérték az egereknél, akiknek HFD-indukálta hólyag-diszfunkció volt. 9,10
20 hetes HFD után a mostani vizsgálat az egerek viselkedési ürülését és a húgyhólyag simaizmok kontraktilitását vizsgálta in vitro. Különösen a hólyag detrusor simaizom működésének változásai érdekelnek minket; ezért a nyálkahártyaréteget minden kísérletnél eltávolították. Megmérjük a különböző szubsztrátokhoz vezető detokróm mitokondriális légzést és a hidrogén-peroxid (H2O2) emissziót, és meghatározzuk a mitokondriális komplexek fehérje-bőségét az elektrontranszportláncban. A detrusor mitokondriális tartalmának meghatározásához citrát szintáz aktivitást alkalmaznak. A tanulmány célja annak tisztázása, hogy a HFD megváltoztatja-e a detrusor mitokondriális légzést különböző szubsztrátok jelenlétében, annak érdekében, hogy jobban megértsük a HFD-hez kapcsolódó hólyag-diszfunkció kialakulásához vezető patológiás mechanizmusokat.
2. Anyagok és módszerek
2.1. Állatok
Valamennyi kísérletet a Brody School of Medicine Intézményi Állattenyésztési és Felhasználási Bizottság állatgondozási és -használati irányelveinek megfelelően hajtották végre. A hathetes C57BL/6J egereket (n = 32, Jackson Laboratory) 12 órás világos/sötét ciklusban helyeztük el, szabad hozzáféréssel az élelemhez és a vízhez. Az egereknek vagy normál étrendet biztosítottak (RMH3000: 14% zsír, 60% szénhidrát, 26% fehérje; Lab Diet, St Louis, MO, USA) vagy HFD-vel (D12451: 45% zsír, 35% szénhidrát, 20% fehérje); Research Diets, New Brunswick, NJ, USA) 20 hétig.
2.2. In vivo vizeletfunkció - void spot assay (VSA)
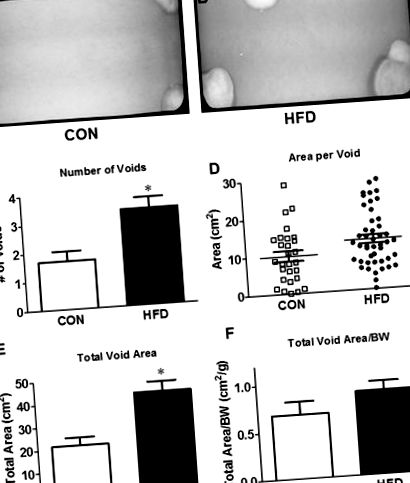
Egy héttel az elpusztítás előtt mindegyik egeret egy szabványos ketrecbe helyezték, dróthálós aljjal, háromrétegű szűrőpapír felett (Fisher Scientific, Pittsburgh, PA, USA). 11 egeret 4 órán át (8: 00-12: 00) hagytak zavartalanul, hogy normálisan kiürüljenek, és a szűrőpapírokat összegyűjtötték. Az üreges foltokat ultraibolya fény alatt vizualizálták és lefényképezték (UVP ChemiDoc-ITS3, Upland, CA, USA). Az egyes üreges foltokat megszámoltuk és területüket ImageJ (NIH, Bethesda, MD, USA) alkalmazásával mértük. A 0,06 cm 2 -nél kisebb fényes foltokat megszüntettük, hogy figyelembe vegyük a rács „permetét” és a vizelet nélküli részecskéket. 12 A mért VSA paraméterek a következők voltak: az üregek száma, a teljes üregterület, az üregenkénti átlagos terület és az elsődleges (legnagyobb) üreg területe.
2.3. A fizikai és anyagcsere paraméterek mérése
20 hetes HFD után az egereket egy éjszakán át éheztettük, és a vércukorszintet a farokvénából glükométerrel mértük (Free Style Lite, Abbott Diabetes Care, Alameda, CA, USA). Az egereket ketamin/xilazin injekcióval és thoracotomiával eutanizálták. A hólyagokat gondosan eltávolítottuk, a vizeletet lecsöpögtettük, és nedves súlyukat mértük. Ezenkívül a zsigeri (retroperitoneális, mesentericus és inguinalis) zsírraktárakat összegyűjtöttük és lemértük.
2.4. Az izolált detrusor funkcionális vizsgálata
2.5. Hólyag mitokondriális légzés
2 órás szöveti homogenizálás. Az oxigénfogyasztást a mitokondriális tartalom szempontjából korrigáltuk a kereskedelemben kapható citrát-szintáz aktivitás vizsgálati készlet (Sigma CS0720) segítségével a gyártó utasításainak megfelelően. A mitokondriális légzés sebességét (JO2) pikomolokban fejeztük ki citrátszintáz aktivitásonként.
2.6. Húgyhólyag mitokondriális H2O2 emisszió
A hólyag mitokondriális H2O2 emisszióját fluorometriásan mértük 37 ° C-on az Amplex Ultra Red (10 μmol/l)/torma peroxidáz detektáló rendszerrel. A fluoreszcenciát fluoreszcens lemezolvasóval (BioTek Synergy, Winooski, VT, USA) követtük nyomon. A mitokondriális H2O2 emissziót 4. állapotban értékeltük 10 mM szukcinát hozzáadásával. Minden kísérletnél a resorufin fluoreszcenciát H2O2 pikomollá alakítottuk át H2O2 standard görbe segítségével, azonos szubsztrát körülmények között létrehozva, és a citrát szintáz aktivitásra normalizálva.
2.7. Western blot elemzés
A nyálkahártya-rétegektől elvonult detrusor izom teljes fehérjét (n = 8/csoport) RIPA pufferrel extraháltuk (150 mM NaCl, 1% Triton, 0,5% nátrium-deoxikolát, 0,1% SDS és 50 mM Tris; pH 7,65). és fehérjét (20 μg) 4-12% Bis-Tris SDS-poliakrilamid gélre (Thermo Fisher, Waltham, MA, USA) töltöttünk. A fehérje elektroforézist 160 V-on (60 perc) futtattuk, a fehérjéket nitrocellulóz membránra vittük, és az összes OXPHOS primer antitest koktéllal (1: 250; ab110413, Abcam) inkubáltuk mind az 5 ETC komplex mérésére. A sávokat kemilumineszcenciával (Pierce ECL, Thermo Fisher) detektáltuk, és Bio-Rad ChemiDoc Touch-tal (Bio-Rad Laboratories, Hercules, CA, USA) készítettük felvételeket. A membránokat lecsupaszítottuk, és ß-aktin (1: 500; PA1–183, Thermo Fisher) expressziót alkalmaztunk az egyes komplexek fehérje expressziójának normalizálására. A sávok denzitometriáját ImageJ szoftver (NIH) segítségével elemeztük.
2.8. Statisztikai analízis
Az adatokat átlagként ± az átlag standard hibájaként fejeztük ki. A csoportokat kétfarkú Student t-teszttel hasonlítottuk össze. Nem paraméteres Mann-Whitney tesztet alkalmaztunk a csoportok közötti üregek száma közötti különbségek meghatározására. Valamennyi teszt esetében a 0,05-nél kisebb P értékeket tekintettük statisztikai szignifikánsnak (Prism 5.0, GraphPad, La Jolla, CA, USA).
3. Eredmények
3.1. A krónikus HFD növelte a zsigeri zsírosságot és az üregek gyakoriságát
A 20% -ig 45% kcal HFD-vel táplált egereknek testtömegük és zsigeri zsírosságuk szignifikánsan nagyobb volt, mint a kontroll étrendet fogyasztó egereknél (1. táblázat). Az éhomi vércukorszint emelkedett
40% HFD egerekben. A társszerzők egy korábbi tanulmánya glükóz- és inzulin-tolerancia teszteket végzett egy másik egércsoportban 16. héten, és az egész test glükóz-intoleranciáját és csökkent inzulinérzékenységét mutatta. A hólyag súlya nem különbözött a két csoport között, de szignifikánsan alacsonyabb volt a testtömeghez képest HFD-vel. Az üregfolt elemzés azt mutatta, hogy a HFD egerekben megduplázódott az üregek száma, és növekedett a teljes üregterület (1C. Ábra, E). E). Érdekes módon nem volt különbség az üregenkénti átlagos területen vagy a testtömegre normalizált teljes üregterületen (1D. Ábra, F F).
Az adatok átlag ± SEM.
40% -os gátlás a HFD detrusorban (2F ábra).
A krónikus, magas zsírtartalmú étrend (HFD) nem befolyásolta a magas kálium-karbachol által kiváltott kontraktilis válaszokat (A) vagy a norepinefrinre (NE) való relaxációt a detrusor csíkokban (B). Az elektromos mező által stimulált (EFS) kontraktilis válaszok növekedtek a HFD detrusorban (C). A muszkarinreceptorok atropinnal történő gátlása nagyobb gátlást eredményezett a kontroll detrusorban (D), mint a HFD (E). A 32 Hz-es gátlás százalékát az F. panel foglalja össze. Az adatok átlag ± SEM. n = 8/csoport; * p 3A. ábra). Ezzel szemben a 4. állapotban (azaz alacsony energiaigény) a HFD detrusorokban nem volt különbség a komplex I- vagy a komplex II által támogatott légzésben. A TMPD által a detrusorban lévő IV-es komplex által támogatott légzés szintén csökkent HFD-vel. A detrusor mitokondriális sűrűsége a kontroll és a HFD egerekben konzisztens volt, amint azt a citrát-szintáz aktivitás vizsgálata jelzi (3B. Ábra). A krónikus HFD szignifikánsan megemelte a detrusor szubmaximális mitokondriális H2O2 emissziót 4. állapotban (3C. Ábra). Érdekes módon, míg a citrát-szintáz aktivitást a HFD nem változtatta meg, a III és V komplexek fehérje expressziója a detrusorban jelentősen megemelkedett a krónikusan HFD-vel táplált egereknél (4. ábra).
Az energiatermelés mellett a mitokondriumok szerepet játszanak a sejtes homeosztázis fenntartásában is. Átalakítják az üzemanyagot és az elektrokémiai potenciált azáltal, hogy elektronokat juttatnak szénforrásokból a mitokondriális elektrontranszport rendszerbe (ETS), és ezt követően felhasználják az elektrokémiai potenciális energiát ATP előállítására az ATP szintázon. Azonban jól megalapozott, hogy az ETS olyan elektronokat is szivároghat, amelyek ROS-t hoznak létre, és ez a gyulladás kialakulását vezérelheti. A gyulladást széles körben tanulmányozták a húgyhólyag diszfunkciójának különféle állapotaiban. A gyulladásgátló citokinek, például a TNF-alfa és az interleukin-1β megemelkedtek a HFD által kiváltott hólyag-diszfunkcióban. 15 Bemutatjuk, hogy a krónikus HFD a detrusor mitokondriális H2O2 kibocsátás növekedéséhez vezet.
5. Következtetések
A krónikus HFD fokozott zsírosodást, nagyobb vizelési gyakoriságot és valószínűleg purinerg eredetű megnövekedett ideg által közvetített detrusor összehúzódást eredményez. Ezenkívül a detrusor mitokondriális légzés csökken és a mitokondriális eredetű H2O2 kibocsátás magas HFD mellett. Ezek az adatok arra utalnak, hogy a mitokondriális bioenergetikában bekövetkező változások szerepet játszhatnak a HFD által kiváltott hólyag-diszfunkció kialakulásában. Jövőbeli vizsgálatokra van szükség a mitokondriális diszfunkció ok-okozati összefüggéseinek megerősítéséhez, amely a húgyhólyag fiziológiájának károsodásához vezet.
Köszönetnyilvánítás
Ezt a munkát az (NIH)/Nemzeti Szív-, Tüdő- és Vérintézet (NHLBI) R01-HL-125695 (JMM) és F32-HL-129632 (TER) támogatásai támogatták. További támogatást biztosítottak a Brody School of Medicine Startup Funds (JLH).
- Diéta hasnyálmirigy-gyulladás és kolecisztitisz esetén Menük és receptek krónikus kolecisztitisz és
- Diéta krónikus vesebetegséghez az 1-3. Szakaszban - Landmark Health
- Diéta krónikus epididymitisben szenvedő betegek számára
- Diéta krónikus gyomorhurutban - krónikus gyomorhurut
- Étrendem megváltoztatása javította krónikus fáradtságomat, Candida-t és pajzsmirigy alulműködésemet