A Lignosus rhinocerus (tigristej gomba) Sclerotia antiproliferatív aktivitása
M. L. Lee
1 CENAR és Molekuláris Orvostudományi Tanszék, Orvostudományi Kar, Malayai Egyetem, 50603 Kuala Lumpur, Malajzia
N. H. Tan
1 CENAR és Molekuláris Orvostudományi Tanszék, Orvostudományi Kar, Malayai Egyetem, 50603 Kuala Lumpur, Malajzia
S. Y. Fung
1 CENAR és Molekuláris Orvostudományi Tanszék, Orvostudományi Kar, Malayai Egyetem, 50603 Kuala Lumpur, Malajzia
C. S. Tan
2 Biotechnológiai Kutatóközpont, MARDI, P.O. Box 12301, 50744 Kuala Lumpur, Malajzia
S. T. Ng
3 Ligno Biotech Sdn Bhd, Taman Perindustrian Balakong Jaya 2, Selangor, 43300 Balakong Jaya, Malajzia
Absztrakt
1. Bemutatkozás
A gombát ízlésének, magas tápértékének és farmakológiai tulajdonságainak köszönhetően a világ számos társadalma fogyasztotta [1, 2]. Megalapozott, hogy a gombakivonatok sokféle vegyületet tartalmaznak, például poliszacharidokat, fehérjét, rostot, lektint és polifenolokat, amelyek mindegyikének megvannak a maga farmakológiai hatásai [3]. Számos gomba vagy ezek kivonata alkalmazható terápiás szerként, és általában gyógygomba néven ismertek.
A Lignosus rhinocerus, a tigris tejgomba a Polyporaceae családba tartozik, és az egyik legfontosabb gyógygomba, amelyet Délkelet-Ázsia és Dél-Kína őslakosai használnak. Malajziában a gomba helyben „cendawan susu rimau” néven is ismert - literáris „tigristej gomba”. Malajzia félszigetének őslakos közösségei széles körben használják számos betegség kezelésére, beleértve az emlőrákot, a lázat, a köhögést, az asztmát, az ételmérgezéseket és általános tonikként. A gomba valóban a legnépszerűbb gyógygomba, amelyet a malajziai őslakos populációk használnak [4]. Kínában a L. rhinocerus sclerotium egy drága népi gyógyszer, amelyet a hagyományos kínai orvosok májrák, krónikus hepatitis és gyomorfekély kezelésére használnak [5]. Az L. rhinocerus sclerotiuma az a része, amelynek gyógyászati értéke van. A gomba farmakológiai aktivitásaival kapcsolatban azonban nagyon kevés tanulmány van, elsősorban annak korlátozott mennyisége miatt. A gomba termesztése nagyon nehéznek bizonyult, és egészen a közelmúltig csak a dzsungelből gyűjtötték össze. Nemrégiben Tan [6] arról számolt be, hogy a gomba agar, szilárd és ívott táptalajban sikeresen termesztett, jó termésmennyiséggel, ezáltal nagy mennyiséget lehetett elérni vizsgálati és terápiás célokra.
Lai és mtsai. [7] elsőként vizsgálta a gomba szklerotialis poliszacharidjainak antiproliferatív hatásait. Az általuk a vizsgálatra használt gomba Polyporus rhinocerus Cooke (Aphyllophoromycetideae) nevet kapta, ami valójában a Lignosus rhinocerus szinonimája. Megállapították, hogy a szkleróciumok forró vizes kivonata jelentősen csökkentette a leukémiás sejtvonalak és a Sarcoma S-180 szaporodását, de meglepő módon nem fedezték fel az emlőrák sejtvonalának hatását [8]. Megjegyezzük, hogy Lai és mtsai. [7] mintáikat egy kínai mikológiai intézetből szerezték be, és jelentésükben nem említik a gomba azonosságának megerősítésére használt módszert. Megfigyeléseink azt mutatták, hogy a tigris tejgomba morfológiai azonosítása téves lehet, mivel ugyanazon családból számos gombafaj morfológiailag hasonló (publikálatlan megfigyelés). Ebben a cikkben beszámolunk a genetikai marker által pozitívan azonosított L. rhinocerus fajta antiproliferatív aktivitásának vizsgálatáról az emberi emlő- és tüdőrák sejtvonalakon, valamint citotoxicitásáról normál emlő és tüdő sejtvonalakon.
2. Anyagok és módszerek
2.1. Anyagok
Az L. rhinocerus fajtából származó szkleróciákat (TM02, szállító: Ligno Biotech, Selangor, Malajzia), amelyeket a riboszomális RNS belső transzkriptált távtartó (ITS) régióival pozitívan azonosítottak [9], fagyasztva szárítottuk és porba őröltük 0,2 mm szitán világosbarna, száraz, tejszerű ízű, bolyhos port kapunk. Ebben a vizsgálatban négy sejtvonalat használtak: MCF-7, az emberi mell karcinóma sejtvonal; A549, az emberi tüdőrák sejtvonal; 184B5, a normális emberi mell sejtvonal; NL 20, a normális humán tüdősejtvonal. Mind a négy sejtvonalat az American Type Culture Collection (ATCC) cégtől vásároltuk, és különböző táptalajokkal tenyésztettük: RPMI-1640 (Lonza, USA) az MCF-7 és A549 sejtvonalakhoz, MEGM emlősejt hámsejt növekedési közeg (MEGM Bullet kit) ( Lonza, USA) az 184B5 sejtvonalhoz, és Ham's F12 táptalaj (Lonza, USA) az NL 20 sejtvonalhoz. A növekedési táptalajt 10% fetalis szarvasmarha-szérummal (FBS) (Sigma-Aldrich, USA) dúsítottuk, és L-glutaminnal egészítettük ki. A sejteket nedvesített levegőben, 5% CO2-tartalommal 37 ° C-on tenyésztettük. Az összes többi vegyszer analitikai minőségű volt.
2.2. L. rhinocerus szklerotiális por hideg vizes kivonatának elkészítése
10 g L. rhinocerus sclerotialis port feloldunk 100 ml milli-Q vízben, folyamatos keverés közben 24 órán át 4 ° C-on. Az elegyet ezután 2500xg sebességgel centrifugáljuk, a felülúszót összegyűjtjük és fagyasztva szárítjuk.
2.3. Az összes szénhidrát- és fehérjetartalom meghatározása
Az összes szénhidráttartalmat fenol-kénsav módszerrel határoztuk meg Dubois és mtsai. [10] standardként D-glükózt használva. A fehérjekoncentrációt Bradford módszerrel [11] határoztuk meg, szarvasmarha szérum albumin (BSA) alkalmazásával.
2.4. Citotoxicitási vizsgálat
Az L. rhinocerus hidegvíz-kivonat citotoxikus aktivitását MTT (3, (4,5-dimetitiazol-2-il) -2,3-difenil-tetrazólium-bromid) módszerrel határoztuk meg. Ezt a vizsgálatot Ahn és munkatársai által leírt módszer szerint hajtjuk végre. [12] enyhe módosításokkal. Az optimális sejtsűrűségű sejteket 96 lyukú lemezre oltottuk és egy éjszakán át inkubáltuk a rögzítéshez. Ezután az extraktumok különböző koncentrációit adtuk hozzá. 72 órás inkubálás után MTT-oldatot adunk hozzá, és 4 órán át inkubáljuk. Ezután az összes oldatot leszívtuk, és izopropanolt adtunk az formazán-kristály szolubilizálásához. Az abszorbanciát ezután egy mikrolemez-olvasóval (Bio-Rad, USA) határoztuk meg 595 nm-en. Mindegyik mérést három példányban hajtottuk végre. A félig maximális gátló koncentráció (IC50) értékét a sejt életképességének és az extraktumgörbe végső koncentrációjának százalékos arányából határoztuk meg.
2.5. DNS-fragmentációs vizsgálatok
DNS-fragmentációt használtunk az L. rhinocerus hidegvíz-kivonat által kiváltott sejthalál módjának vizsgálatára. Azokat a sejteket, amelyeket 72 órán át kezeltük IC50 dózisú L. rhinocerus kivonattal, összegyűjtöttük és 1 M Tris-HCl-t, 0,5 M EDTA-t, Triton-X-et és desztillált vizet tartalmazó lízispufferben lizáltuk. A DNS-t fenol: kloroform: izoamil (25: 24: 1) keverékkel extraháltuk, és azonos térfogatú jéghideg izopropanollal kicsaptuk. A DNS-pelletet ezután megfelelő térfogatú RNáz-oldatban (10 mg/ml RNáz I) oldjuk, és 30 percig 37 ° C-on inkubáljuk. A DNS-t GelRedet tartalmazó 1,2% -os agarózgélen elektroforizáltuk. Végül az apoptotikus DNS-fragmenseket UV-transzilluminátorral vizualizálták és lefényképezték [13].
2.6. Az L. rhinocerus kivonat frakcionálása
Az L. rhinocerus sclerotia hideg vizes kivonatát Sephadex G-50 gélszűrő oszlopon (2,6x40 cm) frakcionáltuk, amelyet 0,05 M ammónium-acetát pufferral előegyensúlyoztunk. Az eluálást 2 ml/perc áramlási sebességgel hajtottuk végre, 0,05 M ammónium-acetát puffer alkalmazásával. Meghatároztuk az egyes frakciók szénhidrát- és fehérjetartalmát. A nagy molekulatömegű és kis molekulatömegű frakciók citotoxicitását (MCF-7 és A549 sejtvonalakkal szemben) MTT módszerrel vizsgáltuk.
3. Eredmények
3.1. Szénhidrát és fehérje tartalom
Az L. rhinocerus sclerotia hideg vizes kivonatát (LR-CW néven) fagyasztva szárítottuk, így barnás port kaptunk, a szklerotia por száraz tömegének körülbelül 10% -os hozama mellett. A szénhidrát- és fehérjetartalmat a LR-CW száraz tömegének 75% -ának, illetve 1,2% -ának határozták meg.
3.2. A L. rhinocerus hideg vizes kivonatának citotoxikus aktivitása
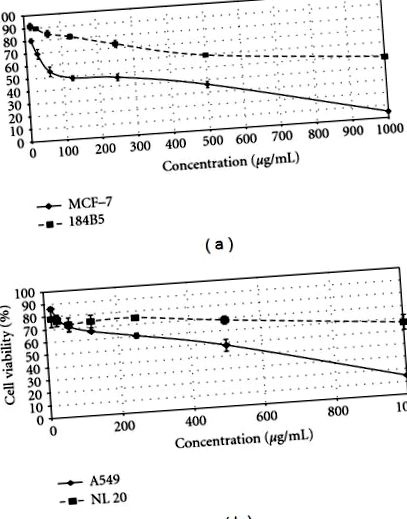
Az 1. ábra az LR-CW különböző koncentrációinak hatását mutatja mind az emberi emlő- és tüdőráksejtek, mind az emberi normális emlő- és tüdősejtek életképességére. Az L. rhinocerus sclerotia hideg vizes kivonata antiproliferatív aktivitást mutatott mind az MCF-7, mind az A549 sejtek ellen, IC50 értéke 96,7 μg/ml, illetve 466,7 μg/ml volt. Összehasonlításképpen, az LR-CW nem mutatott szignifikáns citotoxikus hatást az emberi normális emlő- és tüdősorokra, az IC50-értékek> 900 μg/ml voltak (1. táblázat).
A Lignosus rhinocerus sclerotia (LR-CW) hidegvíz-kivonatjának antiproliferatív aktivitása. Az emberi rákos sejteket (MCF-7 és A549) és az emberi normális sejteket (184B5 és NL 20) különböző LR-CW koncentrációkkal kezeltük, 15,6 μg/ml és 1000 μg/ml között, 72 órán át, az IC50 értéket a ív. a) Az LR-CW citotoxikus aktivitása az MCF-7 (folytonos vonal) és az 184B5 (szakadt vonal) ellen. (b) Az LR-CW citotoxikus aktivitása az A549 (folytonos vonal) és az NL20 (törött vonal) ellen. Az adatokat átlag ± SD-ként fejeztük ki (n = 3).
Asztal 1
A Lignosus rhinoceros szkleróciájának hideg vizes kivonatának és az extraktum részleges tisztított frakcióinak citotoxikus aktivitása (IC50).
| LR-CW | 96,7 ± 14,5 | 466,7 ± 43,7 | 906,7 ± 26,7 | > 1000 |
| Nagy molekulatömegű frakció | 70,0 ± 5,8 | 76,7 ± 3,3 | ND | ND |
| Kis molekulatömegű frakció | > 1000 | > 1000 | ND | ND |
A sejteket az L. rhinocerus sclerotia (LR-CW) hideg vizes kivonatával, valamint az LR-CW-től izolált két frakcióval kezeltük. Az MCF-7 és az A549 humán emlő- és tüdőrákos sejtek, míg a 184B5 és az NL20 normál emberi emlő- és tüdőrák. A kezelés ideje 72 óra volt. Az eredmények átlag ± SEM-ben kifejezve (n = 3). ND: nincs meghatározva.
3.3. DNS-fragmentációs vizsgálatok
DNS-fragmentációs vizsgálatokat használtunk annak vizsgálatára, hogy az LR-CW indukálta-e az apoptózist. A 2. ábra a DNS-létra fragmensek jelenlétét mutatja az LR-CW-vel kezelt MCF-7 és A549 sejteken, jelezve, hogy a sejtpusztulást apoptózis közvetítette [14]. A kezeletlen (kontroll) sejteken egyetlen sávot figyeltünk meg, és DNS-létra nem képződött.
DNS-fragmentáció a Lignosus rhinocerus sclerotia (LR-CW) hideg vizes kivonatával kezelt sejtekben. 1. sáv: 1 kb DNS-létra. 2. sáv: LR-CW-vel kezelt MCF-7 sejtek; 3. sáv: LR-CW-vel kezelt A549 sejtek. 4. sáv: kezeletlen MCF-7 sejtek. 5. sáv: kezeletlen A549 sejtek.
3.4. Az L. rhinoceros (LR-CW) hideg vizes kivonatának frakcionálása
Az LR-CW frakcionálása Sephadex G-50 gélszűrési kromatográfiával két fő csúcsot eredményezett (3. ábra). A nagy molekulatömegű csúcs fehérjét (3,6%) és szénhidrátot (68,7%) egyaránt tartalmazott, míg a kis molekulatömegű csúcs szénhidrátot (31,8%) és nagyon kis mennyiségű fehérjét (0,15%) és más azonosítatlan anyagokat tartalmazott. E két frakció citotoxicitását az MCF-7 és A549 humán rákos sejtvonalakkal vizsgáltuk. A 4. ábra azt mutatja, hogy a nagy molekulatömegű frakció erős antiproliferatív aktivitást mutatott mind az MCF-7, mind az A549 sejtvonalakkal szemben, IC50 értéke 70,0 μg/ml, illetve 76,7 μg/ml volt. Az alacsony molekulatömegű frakció nem mutatott jelentős citotoxicitást, IC50> 1000 μg/ml.
Az L. rhinocerus hideg vizes kivonatot (50 mg 5 ml-ben) Sephadex G-50 gélszűrő kromatográfiával frakcionáltuk. Az oszlopot (2,6x40 cm) 0,05 M ammónium-acetát pufferral előzetesen kiegyensúlyozzuk. Az eluálást 2 ml/perc áramlási sebességgel hajtjuk végre, és 3,5 ml-es frakciókat gyűjtünk össze. A fehérjetartalmat (- ♦ - ♦ -) Bradford protein assay-vel (abszorbancia 595 nm-nél), a szénhidráttartalmat (- ○ - - ○ - -) fenol-kénes módszerrel (abszorbancia 490 nm-nél) határoztuk meg.
Lignosus rhinocerus sclerotia (LR-CW) hideg vizes kivonatából származó nagy és kis molekulatömegű frakciók antiproliferatív aktivitásai. A sejteket a frakciók különböző koncentrációival kezeltük, 7,8 μg/ml és 1000 μg/ml között. (a) Felső: nagy és kis molekulatömegű frakciók (folytonos vonal és törött vonal, ill.) antiproliferatív aktivitás az A549 sejtvonallal szemben. (b) Alsó rész: magas és kis molekulatömegű frakciók (folytonos vonal és törött vonal, ill.) antiproliferatív aktivitás az MCF-7 sejtvonallal szemben. Az adatokat átlag ± SD-ként fejeztük ki (n = 3).
4. Megbeszélés
Az L. rhinocerus fajta hideg vizes kivonata főleg szénhidrátot és meglehetősen kis mennyiségű fehérjét tartalmaz. Ez hasonló a szklerócia hideg lúgos kivonatának (82,3% szénhidrát és 1,3% fehérje) összetételéhez, de nagyon eltér a melegvíz-kivonat összetételétől, amely majdnem azonos mennyiségű szénhidrátot és fehérjét tartalmaz (37,4% és 41,3%), ill.) [7]. Nyilvánvalóan a melegvíz-kivonatban alkalmazott magasabb hőmérséklet nagy mennyiségű sejtszerkezeti/tároló fehérje oldódását eredményezte. Az LR-CW frakcionálása Sephadex G-50 gélszűréssel két frakciót eredményezett, a nagy molekulatömegű frakciót, amely az üreg térfogatánál jelent meg (Mol Wt> 30.000), és az alacsony molekulatömegű frakciót, amely az ágy térfogatánál jelent meg., amely kis molekulák keverékét képviseli. A nagy és az alacsony molekulatömegű frakciók egyaránt tartalmaznak szénhidrátot, de fehérje csak a nagy molekulatömegű frakcióban található meg. A nagy molekulatömegű frakció tartalmazhat poliszacharid-fehérje komplexet, amint Lai et al. [7].
Eredményeink azt mutatták, hogy az LR-CW jelentős antiproliferatív aktivitást mutatott az MCF-7 emlőrákos sejt és az A549 tüdőrákos sejtek ellen. Az MCF-7 sejtekkel szembeni antiproliferatív hatás megalapozott tudományos alapot szolgáltat az L. rhinocerus sclerotia malajziai őslakosok mellrák kezelésében való hagyományos alkalmazásához. Korábban Lai és mtsai. [7] beszámolt arról, hogy a P. rhinocerus forró vizes kivonata (az L. rhinocerus szinonimája) antiproliferatív aktivitást mutat a különféle leukémiás sejtek ellen (IC50 értéke 100 μg/ml és 400 μg/ml között van), de az MCF-7 nem [8]. Wong és mtsai. [15] arról is beszámolt, hogy a gomba szkleróciák hideg lúgos kivonata stimulálhatja az emberi veleszületett immunsejteket. Tehát úgy tűnik, hogy az L. rhinocerus sclerotia különféle antiproliferatív szereket tartalmaz, eltérő hatással és sejt-specifitással. Míg a hideg lúgos kivonatban az immunválaszt potencírozó anyag valószínűleg a β-glükán [15], a hideg és meleg víz kivonatban az antiproliferáns természetét még ki kell deríteni.
Eredményeink azt is megmutatták, hogy az LR-CW lényegében nem volt citotoxikus a normális emlő- és tüdõsejtekkel (184B5 és NL 20, ill.) Szemben. Ez az első jelentés, amely bizonyítja, hogy az L. rhinocerus kivonat nem mérgező a normális sejtekre. Az LR-CW szelektív antiproliferatív hatásának alapja, amely úgy tűnik, hogy kifejezetten a rákos sejteket célozza meg, még nem tisztázott.
Az antiproliferatív szer természetének további feltárása érdekében az extraktumot Sephadex G-50 gélszűrő oszlopon két frakcióra frakcionáltuk: nagy és kis molekulatömegű frakciókra. Csak a nagy molekulatömegű frakció mutatott meglehetősen erős antiproliferatív aktivitást a két vizsgált ráksejt ellen. A kis molekulatömegű frakció mentes az antiproliferatív aktivitástól. Mivel a nagy molekulatömegű frakció mind szénhidrátot, mind fehérjét tartalmaz, az antiproliferatív szer lehet egyfajta fehérje-szénhidrát komplex, és olyan fehérjék, amelyek az anyagcsere folyamatokat vagy a ráksejtekben történő transzdukciót célozzák. Ismeretes, hogy az olyan fehérjék, mint a proteázok, a riboszómát inaktiváló fehérjék és a lektinek közvetlen citotoxikus hatást fejthetnek ki a rákos sejtekre [2]. További munka folyik a citotoxikus szer természetének azonosítására a nagy molekulatömegű frakcióban.
Úgy gondolják, hogy számos rákellenes szer citotoxikus hatását az apoptózis közvetíti [16]. Korábban Lai és mtsai. [7] kimutatta, hogy a P. rhinocerus forró vizes kivonatának a HL-60 sejtekkel szembeni antiproliferatív hatását sejtciklusok leállítása közvetítette a G1 fázisban, ami apoptózishoz vezetett. DNS-fragmentációs vizsgálataink egyértelműen azt sugallták, hogy az LR-CW apoptózis kiváltásával is elpusztítja az MCF-7 és A549 sejteket. Az LR-CW apoptózisát kiváltó szer azonban nem feltétlenül azonos a P. rhinocerus forró vizes kivonatában találhatóval, mivel a kivonatok a citotoxikus hatás szelektivitásában különböznek (lásd fent).
5. Következtetés
A tenyésztett L. rhinocerus szkleróciáinak hideg vizes kivonata citotoxicitással rendelkezik az emlő és a tüdőrák sejtjeivel szemben, de nem toxikus a megfelelő normális sejtekre. Citotoxicitása a hidegvíz-kivonatból izolált nagy molekulatömegű frakciónak köszönhető, és hogy a citotoxikus hatás apoptózis útján történik.
Elismerés
Ezt a munkát anyagilag támogatta a malajziai Kuala Lumpur-i Malayai Egyetem HIRGA (J-20014-73807).
- Miért nem biztos, hogy a kókusztej olyan jó az Ön számára Health24
- Miért olyan veszélyes a tehéntej - növényi étrend - receptek; Fogyás kiegészítők Halleluja diéta
- Tejfajták
- A kitozán Penicillium Vermoesenii elleni aktivitásának szokatlan harangszerű függősége
- A Whistling Vízforraló Chaga gomba tea elmagyarázta