A lipoprotein profilozása korai sclerosis multiplexben szenvedő betegeknél: krónikus gyulladás hatása?
Absztrakt
Háttér
A gyulladásos citokinek hozzájárulnak a lipid-anyagcsere proaterogén változásaihoz a HDL-koleszterin (HDL-C) szintjének csökkentésével, gyulladáscsökkentő és antioxidáns funkcióinak károsodásával. Ezért a HDL-C védőhatása korlátozható krónikus gyulladásos betegségek esetén, mint például a sclerosis multiplex (MS). A tanulmány célja a lipoprotein szubfrakciók és a gyulladásos állapot közötti összefüggés értékelése volt a sclerosis multiplex korai szakaszában.
Mód
Eredmények
A mért citokinek és lipoprotein alosztályok koncentrációi összehasonlíthatók voltak SM betegek és kontrollok között. A férfi, de nem női SM betegeknél szignifikánsan magasabb volt a teljes HDL-C és a kicsi HDL-C szubfrakció, mint az egészséges kontrolloknál. A nagy HDL-C negatívan korrelált az összes mért citokinnal, kivéve az IL-17-et MS-ben, de a kontrollokban nem. A köztes HDL-C szubfrakciók pozitívan korreláltak az összes mért citokinnal, kivéve a G-CSF-et MS nőknél, de MS hímeknél és kontrolloknál nem.
Következtetés
A magasabb HDL-C és főleg annak kicsi HDL-C szubfrakciójának eredményeink arra utalnak, hogy a férfi SM betegeknél nagyobb az ateroszklerózis kockázata, és a finom diszlipidémia a betegség korai szakaszában van jelen. A specifikus HDL-C szubfrakciók és a gyulladásos citokinek közötti összefüggések kölcsönös összefüggéseket mutatnak a szisztémás gyulladás és a lipid metabolizmus között MS-ben.
Próba regisztráció
ClinicalTrials.gov, Azonosító: NCT 03052595. 2017. február 14-én regisztrálták.
Bevezetés
A sclerosis multiplex (MS) a központi idegrendszer (CNS) krónikus neuroinflammatorikus betegsége, amely demyelinizációhoz és neurodegenerációhoz vezet. A leggyakoribb tünetek a motoros károsodás, a látászavarok, az érzékszervi problémák, a fájdalom, a fáradtság és a kognitív zavarok, amelyek súlyos testi fogyatékossághoz vezetnek fiatal felnőtteknél [1].
Az SM-betegeknél megnő a kardiovaszkuláris kockázat még olyan hagyományos kockázati tényezők hiányában is, mint az elhízás, a magas vérnyomás, a 2-es típusú cukorbetegség vagy a diszlipidémia, ami arra utal, hogy a betegséghez kapcsolódó tényezők hozzájárulnak az érelmeszesedés kialakulásához SM-ben [2,3,4,5].
A diszlipidémia, nevezetesen az emelkedett összkoleszterinszint, az alacsony sűrűségű lipoprotein-koleszterin (LDL-C) és a csökkent nagy sűrűségű lipoprotein-koleszterin (HDL-C) szint kapcsolata az aterogenezissel és a szív- és érrendszeri betegségekkel jól elfogadott ([6]; NCEP és ATP III, 2002). Az LDL-C és a HDL-C a részecskék heterogén csoportját képviseli, amelyek különböznek sűrűségükben, vándorlási jellemzőikben, apoproteintartalmukban és a betegséghez való viszonyukban, és ezek az alfrakciók kockázati profiljuk szerint változnak. Különösen a kis sűrű LDL-C részecskék társulnak megnövekedett kardiovaszkuláris rizikóval, metabolikus szindrómával és 2-es típusú cukorbetegséggel, míg a nagy LDL-C szubfrakciók nem találtak összefüggést kardiovaszkuláris rizikóval [7, 8]. Bár a HDL-C szubfrakciók szerepe a kardioprotektív, gyulladáscsökkentő és antioxidáns mechanizmusokban kevésbé egyértelmű, a vizsgálatok többsége a nagy HDL-C szubfrakciókat védőbbnek tartja, mint a kis HDL-C [6, 8,9,10, 11,12,13].
A gyulladásos citokinek hozzájárulhatnak a lipid-anyagcsere proaterogén változásaihoz a HDL-C-hez kapcsolódó enzimek és apolipoproteinek megváltoztatásával. Ez a HDL-C szint csökkenéséhez és a gyulladáscsökkentő, antioxidáns és reverz koleszterin transzport funkciók károsodásához vezet [14, 15]. Így a krónikus gyulladás fontos tényező lehet a dyslipidaemia, az érelmeszesedés, a szív- és érrendszeri betegségek, a metabolikus szindróma és az elhízás kialakulásában SM-ben [16,17,18,19,20].
Ezenkívül számos tanulmány összefüggést mutatott a szérum koleszterinprofiljai és a betegség kimenetele között MS-ben [17, 19, 21, 22]. A közelmúltban csökkent inzulinérzékenységet és fokozott inzulinszekréciót mutattunk az orális glükózterhelésre reagálva, a gyulladásos és fizikai aktivitás státuszától függetlenül a korai SM betegeknél [23]. Ezenkívül beszámoltunk az IDL-B lipoprotein szubfrakció negatív összefüggéséről az inzulinrezisztencia és a hiperinsulinémia paramétereivel, ami arra utal, hogy kezdeti diszlipidémia alakul ki, amelyet inzulinrezisztencia kialakulása előz meg ezekben az SM betegekben [24].
Továbbra sem világos, hogy a diszlipidémia milyen mértékben jár együtt a gyulladással a betegség korai szakaszában. Vizsgálatunk célja a diszlipidémia (1) értékelése és (2) a specifikus lipoprotein szubfrakciók és a gyulladásos állapot közötti kapcsolat feltárása volt korai SM-ben szenvedő betegeknél.
Tantárgyak és módszerek
A résztvevők és a vizsgálati protokoll
Egy éjszakán át tartó gyors böjt után a perifériás vénás vérmintákat polietilén csövekbe gyűjtöttük; kb. 60 percig szobahőmérsékleten alvadt, a vért 4 ° C-on centrifugáltuk, és a szérumadagokat a vizsgálatig -70 ° C-on tároltuk.
A fizikai aktivitás szintjének felmérése érdekében az alanyok kitöltötték a Lagerros Energy Expenditure Questionnaire (EEQ) szlovák változatát [25], hogy számszerűsítsék az összes fizikai tevékenységhez kapcsolódó teljes energiatermelést egy átlagos hétnap alatt. A fizikai aktivitást intenzitása szerint kilenc lépésbe osztályozták, ami a metabolikus energiaforgalom (MET) többszörösét jelenti. Egy MET 1 kcal/testtömeg-kilogramm/óra energiafelhasználást jelent [25]. A résztvevők beszámoltak egy-egy tipikus nappal és éjszaka alatt az egyes intenzitási szinteken eltöltött időről, a teljes fizikai aktivitás pontszámát és az energiafelhasználást az egyéni szintű tevékenységek összegeként számolták ki (MET1 * t1 + MET2 * t2 +. + MET9 * t9, ahol a METi jelentése a jelenlegi érték MET értéke, és ez a tevékenység végrehajtására fordított időt jelöli) [25].
Vizsgálatok
Az éhomi szérum összes koleszterin (TC), LDL-C, HDL-C és triglicerid (TG) szintjét autoanalizátorral (Siemens Healthcare Diagnostics Inc., Tarrytown, NY, USA) szokásos eljárásokkal határoztuk meg enzimatikus készletekkel (Roche Diagnostics, Lewes, Egyesült Királyság). A lipoprotein szubfrakciós elemzést nagy felbontású poliakrilamid gélelektroforézis technikával - Lipoprint rendszer (Quantimetrix Corporation, Redondo Beach, CA, USA) végeztük a gyártó kézikönyve szerint, amely lehetővé teszi a következő lipoprotein szubfrakciós profil elemzését: a nagyon kis sűrűségű lipoprotein (VLDL) ) frakció, a közepes sűrűségű lipoprotein (IDL) C, B és A, az alacsony sűrűségű lipoprotein (LDL) az 1. és 2. alfrakcióval (nagy LDL) és a 3–7. alfrakcióval (kicsi sűrű LDL - sdLDL) és a magas sűrűségű lipoprotein (HDL) szubfrakciók nagy (1–3. részfrakciók), köztes (4–7. részfrakciók) és kicsi HDL (8–10. részfrakciók) kategóriákba sorolva.
A szérum citokinek szintjét multiplex gyöngyvizsgálattal (Bio-Plex Human Cytokine panel; Bio-Rad, Hercules, CA, USA) mértük. A felülúszókat egyidejűleg elemeztük a következő 15 kiválasztott citokinre: IL-1β, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-12 (p70), IL-13, IL-17, granulocita kolóniastimuláló faktor (G-CSF), granulocita-makrofág kolóniastimuláló faktor (GM-CSF), interferon-y (IFN-γ) és TNF-α. A szérum hsCRP-t immunoturbidimetriás vizsgálattal mértük automatizált biokémiai analizátoron (Hitachi 917, Roche Diagnostics, Basel, Svájc).
Statisztikai értékelés
A kapott adatok statisztikai elemzését az IBM SPSS Statistics 19. verziójával (SPSS Inc., Chicago, IL, USA) végeztük. A folyamatos változók normalitását Kolmogorov-Smirnov teszttel értékeltük. A normálisan elosztott adatokat átlag ± SD-ként, míg a normálisan nem elosztott adatokat mediánban (interkvartilis tartomány [IQR]) fejeztük ki. A csoportok közötti folyamatos változók összehasonlítását a Student t-teszttel vagy adott esetben Mann-Whitney U teszttel értékeltük. Két megközelítést alkalmaztunk a lipoprotein szubfrakciók és a gyulladásos állapot összefüggésének vizsgálatára. Először a különféle lipoprotein szubfrakciók és a mért citokinek közötti összefüggéseket vizsgálták MS betegek és kontrollcsoportokban Pearson vagy Spearman korrelációs együtthatójával, az adatok normalitásától függően. Ezután a korrelációkat elvégeztük az életkor, a nem és a BMI kontrollálásakor is. Másodszor, az életkor és a BMI kontrollálásakor a korrelációkat és az összefüggéseket a betegek és a kontroll nemek szerinti alcsoportjaiban is elvégeztük. A különbségeket a p
Eredmények
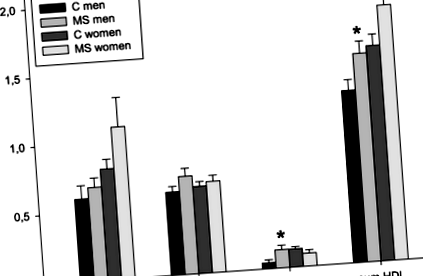
Az antropometriai paraméterek és a fizikai aktivitás szintje összehasonlítható volt mind az SM betegek, mind az egészséges kontroll csoportban (1. táblázat), még a férfi és a női alcsoport külön-külön történő összehasonlítása után is. Nem voltak szignifikáns különbségek a vizsgálati csoportok között a TG éhomi éhomi szérumkoncentrációjában, és az összes, LDL-C, HDL-C, valamint azok megfelelő alfrakcióiban (2. táblázat). Nemek szerint elemezve nem volt szignifikáns különbség a lipid paraméterekben a női betegek és a női kontrollok között. A férfi betegeknél szignifikánsan magasabb volt a HDL-C koncentráció (MS-M: 1,28 ± 0,23 mmol/l vs. C-M: 1,04 ± 0,23 mmol/l; o = 0,037). Hasonló tendencia figyelhető meg a kis HDL-C szubfrakcióban (MS-M: 4,0 (2,5–7,0) mg/dl vs. C-M: 1,0 (0,0–2,0) mg/dl; o = 0,015) (1. ábra). A fizikai aktivitás (a kalkulált energiafelhasználás kcal/24 órában kifejezve) összehasonlítható volt SM-ben szenvedő férfiaknál és kontrollokban (MS-M: 3055 ± 784 kcal/24 óra vs. C-M: 3383 ± 620 kcal/24 óra; o = 0,366). 15 mért citokin koncentrációja nem különbözött szignifikánsan a betegek és a kontrollok között (3. táblázat), még a nemek közötti összehasonlítás után sem.
Az IL-7 negatívan korrelált az egészséges kontrollokban a köztes HDL-C-vel és az összes HDL-C-vel. A GM-CSF negatívan korrelált a VLDL-C-vel, az IDL-C-vel, a nagy HDL-C-vel és az összes HDL-C-vel egészséges kontrollokban, az életkor, a BMI és a nem kontrollálásakor a legerőteljesebbek a GM-CSF és a nagy HDL-C korrelációi voltak. szubfrakció és az összes HDL-C egészséges kontrollokban (4. táblázat). A nemek szerinti adatelemzés után a férfi kontrollok az LDL1, az LDL2 és az LDL-C 1–2 szubfrakciók robusztus pozitív korrelációját mutatták szinte az összes citokinnal (r =, 700–0,992; o = 0,040–0,000). Mivel azonban az összes LDL-C szubfrakció paramétere a férfi kontrollokban pozitívan korrelált a BMI-vel (r = 0,717–0,889; o = 0,03–0,000), az életkor és a BMI kontrollja után kapott adatok hasonló mintát követtek, mint az egész kontroll csoportban (5. táblázat). A GM-CSF erős negatív korrelációja csak a női kontrollokban volt jelen.
Vita
E vizsgálat célja a dyslipidaemia vizsgálata volt korai SM-ben a gyulladásos állapot összefüggésében. Az alacsony gyulladásos aktivitás és az alacsony fogyatékossági pontszám ellenére az MS-betegek eredményeink magasabb teljes HDL-C-t és magasabb kis HDL-C-szubfrakciót mutatnak a férfi SM-alanyokban az egészséges férfi egyénekhez képest. Ezek a megállapítások a diszlipidémia finom jeleinek jelenlétére utalnak a betegség korai szakaszában és egyéb kockázati tényezők, például alacsony fizikai aktivitás vagy elhízás hiányában. Ezenkívül a HDL-C szubfrakciók és a gyulladásos citokinek közötti korreláció különféle mintázata igazolja a lipid metabolizmus és a gyulladás közötti kölcsönös kapcsolat fennállását.
Az LDL-C és a HDL-C a részecskék heterogén csoportja; szubfrakcióik méretben, sűrűségben, lipid és apolipoprotein összetételben különböznek egymástól. Számos módszer létezik a lipoprotein szubfrakciók mérésére, az ebben a vizsgálatban alkalmazott Lipoprint módszer mellett, például a nukleáris mágneses rezonancia spektroszkópia, a gradiens gélelektroforézis, az ultracentrifugálás, a függőleges automatikus profil és az egyik legújabb - anioncserélő nagy teljesítményű folyadékkromatográfia stb. [11, 26, 27]. Ezeknek a különböző alfrakcióknak különböző hatása van a szív- és érrendszeri betegségek kockázatára; míg többé-kevésbé megállapítást nyert, hogy a kis sűrű LDL-nek aterogén potenciálja van [8, 10, 28], a specifikus HDL-C szubfrakciók szerepe továbbra is egyértelmű. Felvetődött, hogy a nagy HDL-C részecskék jobban védekezhetnek, mint a kis HDL-C részecskék [10, 13]. A megfelelő alfrakciók ezen eltérő kockázati potenciálja nem nyilvánvaló a klinikai körülmények között [2]. Ezért ezeknek a szubfrakcióknak az elmozdulása megmagyarázhatja a kardiovaszkuláris kockázat növekedését a normál rutin lipidprofillal rendelkező alanyokban, ami alapot jelent olyan személyre szabott életmód-módosításokhoz, mint a dohányzásról való leszokás, a testmozgás, a csökkent alkoholfogyasztás és/vagy táplálkozási beavatkozások.
A HDL és az LDL koleszterinhez képest csak korlátozott információ áll rendelkezésre az IDL-C-ről és annak kardiovaszkuláris rizikóval való kapcsolatáról, az IDL-C szubfrakciókra és azok MS-vel vagy általában a gyulladással való összefüggésére vonatkozó adatok még ritkábbak. Az IDL-C proaterogén tulajdonságokkal rendelkezik, amelyek a nem HDL-C-nek tulajdonított kardiovaszkuláris kockázat jelentős részét képviselik [31, 32].
A HDL-C ateroprotektív funkciókkal és gyulladáscsökkentő tulajdonságokkal rendelkezik, de a szisztémás gyulladás megjelenésével gyulladásgátlóvá válhat [33]. A diszfunkcionális HDL-C részecskék azok, amelyek elvesztették atheroprotektív tulajdonságait, és még a pro-aterogéneket is képesek megmutatni [38]. Ennek a jelenségnek az okai az amiloidózissal és az apolipoprotein A-1 (apoA-1) egyéb transzlációs és poszttranszlációs módosításával magyarázhatók [34]. Az apolipoprotein A-1 a HDL-C részecskék fő fehérjekomponense a plazmában. Az apoA-1 szérum amiloid A fehérjével történő helyettesítése mellett [6, 34, 35] az apoA-1 módosulása mieloperoxidázzal (klórozás, oxidáció, nitrálás, karbamiláció) és reaktív karbonilokkal (oxidáció, glikáció) szisztémás gyulladás során a diszfunkcionális HDL-C termelődése és ennek az eredetileg gyulladásgátló molekulának a gyulladásgátlóvá történő átalakítása [34]. Ezen túlmenően autoimmun apoA-1 és HDL-C antitestekről beszámoltak olyan autoimmun betegségben szenvedő betegeknél, mint a szisztémás lupus erythematosus, a reumás ízületi gyulladás és az antifoszfolipid szindróma, amelyeknél magasabb a kardiovaszkuláris kockázat, és ezért egy másik mechanizmust jelenthetnek, amely potenciálisan az apoA- 1/HDL-C [34].
A HDL-C anyagcsere jelenleg elfogadott koncepciója apró HDL-C részecskék kiválasztását írja le a májban és a belekben, amelyet érés, átalakítás és a keringés méretének növekedése követ a sejt koleszterin felvételével és észterezésével [39,40,41]. A legújabb tanulmányok azonban kétségbe vonják az anyagcsere ezen HDL-C méretterjeszkedési modelljét, amely arra utal, hogy a HDL-C metabolizmus elsősorban a szekretált méretén belül történik, nem pedig a növekvő részecskék progresszív érése [39, 40].
Az MS-ben szenvedő betegek léziós és neurodegeneratív változásainak HDL-C és MRI mérésére vonatkozó adatok egyértelműek voltak [17, 19, 21, 22], ami azzal magyarázható, hogy ezek a vizsgálatok nem tettek különbséget a HDL-C szubfrakciók között [42 ].
Mind a teljes HDL-C, mind a nagy HDL-C szubfrakció következetes negatív korrelációja a citokinekkel azzal magyarázható, hogy a HDL-C plazma rutin klinikai mérése elsősorban a nagy, koleszterinben gazdag HDL-C részecskék szintjét tükrözi. gyakori érzéketlenséggel a kicsi, koleszterinben szegény HDL-C szubfrakció kimutatására [6]. Vizsgálatunkban a kis HDL-C szubfrakció megnövekedett koncentrációja férfi SM-es betegeknél, valamint a nagy és közepes HDL-C szubfrakciók ellentétes összefüggése női SM-betegekben kölcsönhatásra utalnak a HDL-C és a gyulladás között, még remisszió és alacsony gyulladásos aktivitás esetén is.
Az eredetileg hematopoietikus növekedési faktorként azonosított granulocita-makrofág kolóniát szimuláló faktort (GM-CSF) a közelmúltban a gyulladásban és az autonóm közösségben kiemelkedő szerepet játszó tényezőként azonosították [44, 45]. Ez a citokin látszólag fontos szerepet játszik az SM patogenezisében, különösen a mieloid sejtek működésének modulálásában és a szövetek pusztulásának ezen sejtek általi potenciális közvetlen kiváltásában [46]. Vizsgálatunkban a GM-CSF mutatta a legerősebb összefüggéseket a lipoprotein szubfrakciókkal, megerősítve annak feltételezett szerepét az SM patogenezisében.
Következtetések
Összefoglalva, eredményeink magasabb HDL-C-t és kis HDL-C-szubfrakciót mutatnak a korai SM-ben szenvedő férfiaknál, ami arra utal, hogy a férfi SM-es betegeknél nagyobb lehet az érelmeszesedés kialakulásának kockázata. Eredményeink egyértelműen igazolják a finom diszlipidémia jelenlétét a betegség korai szakaszában. A HDL-C szubfrakciók és számos citokin közötti megfigyelt korrelációs mintázat kölcsönös összefüggéseket tükröz a szisztémás gyulladás és a lipid metabolizmus között korai SM-ben, alacsony gyulladásos aktivitással.
- A súly kezelése Multiple Sclerosis Society UK
- A krónikus gyulladás megakadályozza a fogyást Sault Fitness
- Ha a korai életszakaszban kezdődik, a metformin-kezelés növeli az élettartamot és elhalasztja a daganatok nőstényekben
- Liraglutid, GLP-1 receptor agonista, krónikus fogyáshoz. Az Endokrinológia szakértői áttekintése és
- Folyadékkromatográfia nagy felbontású tömegspektrometria zsírsavprofilozáshoz - Bromke - 2015 -