A magas kálium előnyös hatásai
A milwaukee-i Wisconsini Orvosi Főiskola élettani tanszékéről.
Ön a cikk legfrissebb verzióját nézi. Előző verziók:
A hipertónia előfordulása az Egyesült Államokban a becslések szerint elérte a 85,7 millió felnőttet 1 anélkül, hogy figyelembe vennék az American College of Cardiology/American Heart Association új iránymutatását a magas vérnyomás megelőzésére, kimutatására, értékelésére és kezelésére2, ami bizonyos hogy növelje ezt a becslést. A magas vérnyomás a stroke, a koszorúér-betegség és a veseelégtelenség egyik fő kockázati tényezője. Ezenkívül a magas vérnyomás (BP) növeli a szív- és érrendszeri mortalitást és számos más krónikus betegség progresszióját. A só és a víz vese általi kezelése közvetlenül befolyásolja a BP-t, míg a vese ioncsatornái és transzporterei fenntartják az elektrolit homeosztázist. 3,4
Epidemiológiai és antropológiai vizsgálatok szerint az izolált társadalmakban, amelyek elsősorban gyümölcsökből, zöldségekből és diófélékből álló étrendet tartalmaznak, a magas vérnyomás csak a lakosság 1% -át érinti. Ezzel szemben azokban az országokban, amelyek modern nyugati étrendet fogyasztanak magasan feldolgozott élelmiszerekben és étrendi nátriumban, a magas vérnyomás előfordulása eléri a 30% -ot. A nyugati étrendnek ez a hatása nemcsak a magas nátriumtartalomnak tudható be, hanem az étrend drámai módon csökkent kálium/nátrium arányának. Az iparosodott országokban a napi kálium- és nátriumfogyasztás ~ 30-50, illetve 80-250 mmol naponta. Ez éles ellentétben áll az elszigetelt vagy primitív társadalmakkal, amelyek napi káliumszintje 150–290 mmol, nátrium esetében pedig napi 20–40 mmol. 5 Ezért a becsült kálium/nátrium beviteli arány 0,12 és 0,63 között mozog az iparosodott társadalmakban, és 3,8 és 14,5 között az izolált társadalmak esetében. A Nemzeti Egészségügyi és Táplálkozási Vizsgálatok alapján az amerikai felnőtteknek csak körülbelül egytizedének van kálium/nátrium beviteli aránya, amely összhangban áll az Egészségügyi Világszervezet irányelveivel a halálozás kockázatának csökkentése érdekében. 6.
A kálium a leggyakoribb intracelluláris ion, és szerepe a BP szabályozásában megalapozott. Az étrend-kiegészítés káliummal csökkentheti a BP-t normál és hipertóniás betegeknél. A káliumcsatornák a Na + -K + -ATPázzal (más néven Na + -K + szivattyúval) együtt központi szerepet játszanak a nyugalmi membránpotenciál és a sejtek térfogatának meghatározásában. Mivel a kálium koncentrációja sokkal magasabb az intracelluláris, mint az extracelluláris közegben, az aktiválás és a káliumcsatornák egymást követő megnyílása a plazmamembrán hiperpolarizációját eredményezi, ezáltal megváltoztatva a disztális nefronban a Na + visszaszívódásának elektrogén hajtóerejét. A befelé igazító kálium (Kir) csatornák kritikus szerepe a nátrium- és kálium homeosztázisban, valamint a vese bazolaterális Kir csatornák és a BP szabályozásának összefüggése áll ennek a rövid áttekintésnek a középpontjában.
A kálium szerepe a magas vérnyomás megelőzésében és kezelésében
Jól ismert, hogy a magasabb nátriumbevitel összefügg a megemelkedett BP-vel. 7 Több mint egy évszázaddal ezelőtt azt jósolták, hogy a nátrium BP-re gyakorolt hatása az étrend összetételétől, különösen a káliumtartalomtól függ. 8,9 Herbert Langford, aki az elsők között javasolta, hogy a káliumfogyasztás különbségei a magas BP előfordulási gyakoriságának eltéréseit okozzák az etnikai csoportok között, 10 „A nátrium és a kálium kölcsönhatására összpontosítottak von Bunge németországi tanulmányai. az 1870-es évek közepe, és továbbra is érdekes téma. Von Bunge aggódott amiatt, hogy a kálium által termelt natriuresis súlyos betegséghez vezet. ” 11 A 20. században végzett tanulmányok további bizonyítékokat szolgáltattak a kálium-kiegészítés kritikus szerepéről a BP-n. Addison értékelte a kálium és a nátrium-klorid emberben kifejtett hatásait, beleértve magát a vizsgálatba. 1928-ban arról számolt be, hogy a káliumadagolás csökkentheti az emelkedett BP-t, és azt javasolta, hogy a magas vérnyomás az alacsony káliumtartalmú étrend és a túlzott nátrium-klorid-fogyasztás miatt következzen be. 12.
asztal. Példák a gyakori káliumban gazdag ételekre
Az USDA jelzi az Egyesült Államok Mezőgazdasági Minisztériumát.
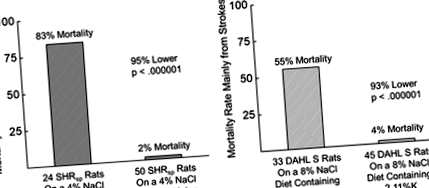
Állatkísérletek bevett hipertóniás modellek alkalmazásával további kritikus bizonyítékokkal szolgálnak a káliumról a BP szabályozásában. Az 1950-es években Meneely és munkatársai (18, 19) azt találták, hogy a kálium adagolása modulálta a BP-t, és jelentősen növelte a magas NaCl-tartalmú táplálékkal etetett patkányok túlélését. Egy másik klasszikus munkában Dahl és mtsai 20 azt találták, hogy a patkányok várható élettartama, noha a nátrium nagy dózisa megrövidítette, a káliummal történő egyidejű kiegészítéssel vissza nem nőtt a kezeletlen értékek felé. Miután megállapította, hogy az étrendi Na/K arány kulcsfontosságú a hosszú távú túlélés szempontjából, Dahl és munkatársai a különböző táplálkozási Na/K arányok hatását tesztelték a magas vérnyomásra hajlamos patkányokban. Valamennyi vizsgált étrend magas NaCl-tartalommal rendelkezett (4,50%), de különbözött a KC1 koncentrációjától. Arra a következtetésre jutottak, hogy az étrendi Na/K mólarány fontos meghatározó lehet a só által kiváltott magas vérnyomás súlyosságának, vagy akár kialakulásának. 20
További bizonyítékokkal alátámasztva az étrendi kálium jelentőségét vesebetegségben és magas vérnyomásban, beszámoltak arról, hogy a kálium kimerülés és a hipokalémia vesekárosodást, sóérzékenységet és magas vérnyomást idéz elő patkányokban. 25,26 Például a Sprague Dawley patkányok jelentős növekedési retardációval, megnövekedett renin – angiotenzin rendszer aktivitással, tubulointerstitialis sérüléssel, makrofág infiltrációval és korai fibrózissal rendelkeznek, ha káliumhiányos (+) étrendet táplálnak. Ezenkívül ezeknek a patkányoknak megemelkedett a BP és fokozott a sóérzékenységük. 25
Összefoglalva, a kálium étrend-kiegészítése csökkentheti a BP-t emberi és állati modellekben, különösen, ha hajlamosak a sóérzékenységre. E vizsgálatok klinikai jelentősége és transzlációs nagysága ellenére azonban a magas káliumtartalmú étrend jótékony hatásainak alapját képező specifikus molekuláris mechanizmusok még mindig nem teljesen ismertek.
A BP káliummal történő szabályozásának mechanizmusai
Számos mechanizmus létezik, amelyek révén a kálium szabályozhatja a BP-t. Itt a vese tubuláris K + csatornák által közvetített mechanizmusokra fogunk összpontosítani a disztális tubulusokban. Figyelembe kell azonban venni, hogy más tubulus szegmensek is hozzájárulnak a kálium kiválasztásához. Például Wang és mtsai 27 legújabb tanulmányai azt mutatták, hogy az NKCC2 (Na + -K + -Cl - kotranszporter) és a Kir1.1 (más néven ROMK [vesekülső medulláris K + csatorna] aktivitása) megemelkedett egereken alacsony Na +, magas K + étrend. 28.
Ezenkívül a vese vaszkuláris káliumcsatornái részt vehetnek a BP szabályozásában. 29 Például a szérum káliumban bekövetkező kismértékű változások endothelium-függő értágulatokat okozhatnak az endotheliális és vaszkuláris simaizomsejtek hiperpolarizálásával. A magas K + diéta a magas vérnyomás következtében fokozott feszültség esetén is javíthatja az érrendszer integritását. A Dahl SS patkányok veséjének normál és magas K + étrenddel végzett vizsgálatai során a K + kiegészítés megakadályozta a magas vérnyomású patkányokban a vesék arterioláris falainak szokásos megvastagodását. Hasonlóképpen, még a súlyos magas vérnyomás kialakulása során is a magas K + diéta elősegítette a fal megvastagodásának jelentős csökkenését az SHR patkányok nagyon nagy vagy kicsi artériáiban. 30
Kálium homeosztázis a vesében és szállítása a disztális tubulusokban
A vesében a diszkrecionális Na + visszaszívódás és a disztális nefron és a gyűjtőcsatorna K + szekréciója a nyomás-natriuresis kapcsolat kritikus meghatározója, amely alapvető fontosságú az artériás nyomás hosszú távú szabályozásában. A disztális tekercselt tubulust (DCT), az összekötő tubulust és a kérgi gyűjtőcsatornát (CCD) több hormon fő célpontjaként határozták meg, reagálva a szimpatikus idegstimulációra és az ionkoncentrációk változására is. 31–33. A 2. ábra a víz és az elektrolit transzportjának egyszerűsített ábráját mutatja a korai (DCT1) és a késői (DCT2) DCT szegmensekben, valamint a CCD-ben. Bár az NCC (Na + -Cl - transzporter) hozzájárul a nátrium újrafelszívódásához mind a DCT1-ben, mind a DCT2-ben, a DCT2 abban különbözik, hogy az ENaC (hám Na + -csatornája) szintén részt vesz a nátrium felszívódásában. Ezenkívül az ENaC az elsődleges csatorna, amely felelős a nátriumtranszportért a CCD-ben.
2. ábra. Az elektrolittranszport modellje a korai és késői disztális tekercselt tubulusokban (DCT1, ill. DCT2; A) és a kérgi gyűjtőcsatorna fő sejtjei (CCD; B). BK kalciummal aktivált K + -ot jelöl; ENaC, epiteliális Na + csatorna; és a ROMK, a vese külső medulláris K + csatornája.
Javasolták a BK csatornák szerepét a vese K + kiválasztásában és a BP szabályozásában is. A 40–42 BK csatorna elengedhetetlen a hurok diuretikumok és a magas K + diéta által kiváltott áramlás okozta K + szekrécióhoz. 43 BKα-hiányos egér áramlástól függő vizelet K + szekréciót és hiperaldoszteronizmust mutatott, és felvetették, hogy a ROMK uregulálása kompenzálhatja a funkcionális BK csatornák hiányát. 40 Hasonlóképpen, a kiegészítő BKβ1 és BKβ4 alegységek deléciói szintén hiányos vese K + kiválasztást, hiperkalémiát, primer hiperaldoszteronizmust és magas vérnyomást eredményeznek. 42,44 További vizsgálatok azt mutatták, hogy a disztális nephronban megnövekedett tubuláris áramlás aktiválja a mechanoszenzitív Ca 2+ -áteresztő TRPV4 (tranziens receptor potenciális vanilloid típusú 4) csatornát a [Ca 2+] i szint növelése és a BK csatornák aktiválása érdekében. A TRPV4 deléció hiperkalémiát eredményez az étrendi K + terhelésre reagálva a vese K + retenciója miatt. 45 A közelmúltban számos kiváló értékelés részletesen bemutatta a ROMK és BK csatornák szerepét a vese kálium homeosztázisában. 28,46,47
Basolaterális káliumcsatornák a disztális tubulusokban
Embereknél a funkcióvesztés mutációi a Kcnj10 génről kimutatták, hogy SeSAME (görcsrohamok, szenzineurális süketség, ataxia, mentális retardáció és elektrolit egyensúlyhiány)/EAST (epilepszia, ataxia, szenzoros süketség és tubulopathia) szindrómát okoz. 58–60 Ezeknek a mutációknak a vesefenotípusa magában foglalja a sópazarlást, a hypomagnesemiát, a metabolikus alkalózist és a hypokalemiát. Úgy gondolják, hogy ezek a mutációk Kcnj10 károsíthatják a heteromer Kir4.1/Kir5.1 csatornák működését. A. Célzott megzavarása Kcnj16 az egerek génje hipokalémiás és hiperklorémiás metabolikus acidózist eredményezett hypercalciuriával. 61 mutációk a Kcnj16 gén nem hűséges szívhalálhoz kapcsolódó nem családos Brugada-szindrómát is okozhat. 62 Ezenkívül a Kir5.1 HNF1β (hepatocita nukleáris faktor 1 homeobox β) transzkripciós aktivációjának elvesztése autoszomális domináns tubulointerstitialis vesebetegséget eredményez, amelyet vese-ciszták és a diabetes mellitus számos örökletes formája jellemez. 63 Sőt, nemrégiben beszámoltak arról, hogy a Kcnj10 az NCC csökkent expresszióját eredményezte a DCT 64-ben és az ENaC aktiválódását. 65
A Kir csatornákat befelé egyenirányító csatornáknak nevezik, mert nagyobb befelé (negatív potenciálon) viszik át, mint a kifelé irányuló áramokat. Ezek a csatornák érzékenyek az extracelluláris K + koncentrációkra. A Nernst-egyenlet szerint a plazma K + koncentrációjának csökkenése a K + egyensúlyi potenciálját hiperpolarizációvá tolja el, ami megváltoztatja a csatorna kapuzását és elnyomja a Kir teljes vezetőképességét. 66 Ezért feltételezték, hogy a Kir4.1 (valószínűleg a Kir5.1 heteromerjeként) a disztális tubulusokban K + szenzorként működik. 67 Különös hangsúlyt fektetnek arra, hogy az NCC milyen kulcsszerepet játszik az étrendi K + bevitel hatásának közvetítésében a vese K + kiválasztására. Meggyőző bizonyíték áll rendelkezésre arról, hogy a magas K bevitel gátolja, míg az alacsony K bevitel stimulálja az NCC aktivitást. 56,67–69
A homozigóta Kcnj10 -/- egerek nem élnek 1-2 hétnél tovább. 59,64,70 Ezért a legújabb tanulmányok technikákat alkalmaztak a Kir4.1 feltételes törlésére a vesében, miután a fejlesztés befejeződött, Pax8 promótert alkalmazva párosítva a doxiciklinnel. 67 A Kir4.1 törlése ezekben az egerekben mérsékelt sópazarláshoz, alacsony BP-szinthez és mély kálium-pazarláshoz vezetett. 67 Különösen az étkezési kálium hatása a bazolaterális kálium vezetőképességre és a membránpotenciálra DCT-ben ezekben a vese-specifikus Kir4.1 KO egerekben teljesen hiányzott. Ugyanez a tanulmány azonban azt is megjegyezte, hogy az étrendi K + bevitel befolyásolja a Cl - vezetőképességet DCT-ben. 56
Összefoglalás és következtetések
Jól ismert, hogy a magasabb nátriumbevitel összefügg a megemelkedett BP-vel. Fontos, hogy a magas nátrium BP-re gyakorolt hatása az étrend összetételétől, különösen a káliumtartalomtól függ. Nyilvánvaló, hogy a magas diétás kálium a BP csökkenésével jár, különösen magas nátriumtartalmú étrend esetén. Az ebben a rövid áttekintésben összefoglalt tanulmányok hangsúlyozzák a bazolaterális Kir-csatornák, különösen a Kir4.1/Kir5.1 alapvető szerepét a kálium homeosztázis és a BP szabályozásában. Ezenkívül számos más Kir-csatorna van azonosítva a vese tubuláris sejtekben, például a Kir7.1 és a Kir2.3 (ezeket kódolja Kcnj13 és Kcnj4, illetve 48,72–74, amelyeknek jórészt feltáratlan szerepük van. További erőfeszítésekre van szükség ezen csatornák relevanciájának megvizsgálására a BP és a vesebetegség szempontjából, különösen a só által kiváltott magas vérnyomás és a magas káliumtartalmú étrend-kiegészítő körülmények között. Az új vérnyomáscsökkentő terápiák kifejlesztéséhez elengedhetetlen a vesekirály-csatornák megértése. Ezen tanulmányok egy része folyamatban van. 39,75,76 Ezért van remény, hogy a Kir-csatornákat szelektíven célzó új kis molekulájú inhibitorok hasznosak lehetnek a BP és a vesebetegségek kezelésében.
Köszönetnyilvánítás
Nagyra értékelem Dr. Oleg Palygint, Anna Manist (Wisconsini Orvosi Főiskola) és Dr. Oleh Pochynyukot (Texasi Egyetem Egészségügyi Tudományos Központja Houstonban) a beszámoló segítő beszélgetéséért és kritikus olvasatáért. Hálás vagyok továbbá Dr. Allen W. Cowley Jr. és Dr. Richard J. Romannek jelölésükért, valamint az American Heart Association Hypertension Council Awards Award Bizottságának, hogy engem választottak a Kutatási Kiválóság 2017. évi középpályázati díjának címzettjévé. Elnézést kérek a K + közlekedés nyomozóitól, akiknek a vonatkozó kiadványait a helykorlát miatt közvetlenül nem tárgyalták.
A finanszírozás forrásai
A Staruschenko laboratóriumban végzett munkát az American Heart Association (16EIA26720006) és az Országos Szív-, Tüdő- és Vérintézet (R35 HL135749, R01 HL122662 és P01 HL116264) támogatja.
- Az oolong teafogyasztás jótékony hatása az étrend okozta túlsúlyos és elhízott személyekre - PubMed
- A Hibiscus sabdariffa L természetes természetes bioaktív vegyületeinek jótékony hatása
- Bipoláris rendellenességek és karbamazepin farmakokinetika, farmakodinamika, terápiás hatások és
- Bisac-evac mellékhatások, felhasználások, kölcsönhatások, képek, figyelmeztetések; Adagolás
- Keserű dinnye (balzsam alma, balzsam körte) mellékhatások, adagok, kezelés, kölcsönhatások, figyelmeztetések