A magas zsírtartalmú étrend okozta elhízás hatása az emlő tumorigenesisére a PyMT/MMTV egér modellben
Taryn L. Cranford
a Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC, USA
Kandy T. Velázquez
a Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC, USA
Reilly T. Enos
a Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC, USA
Alexander T. Sougiannis
a Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC, USA
Jackie E Bader
a Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC, USA
Meredith S. Carson
a Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC, USA
Rebecca R. Bellone
b Lakosság Egészségügyi és Szaporodási Tanszék, Állatorvos-tudományi Kar, Kaliforniai Egyetem, Davis, Davis, Kalifornia, USA
Ioulia Chatzistamou
a Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC, USA
Mitzi Nagarkatti
a Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC, USA
E. Angela Murphy
a Patológiai, Mikrobiológiai és Immunológiai Tanszék, Orvostudományi Kar, University of South Carolina, Columbia, SC, USA
ABSZTRAKT
Bevezetés
Az elhízást valószínűleg számos mechanizmus kapcsolja össze a BrCA-val. A gyulladás azonban vitathatatlanul az élen jár. A krónikus gyulladást fontos közvetítőnek ismerik el az elhízással, valamint az emlődaganatok biológiai és okozati összefüggéseivel összefüggő klinikai és biokémiai komplikációkban. A zsírszövet (AT) gyulladása, a makrofágok által történő beszivárgással, az elhízás jól megalapozott jellemzője, és a mellben való jelenléte olyan helyi körülményeket teremt, amelyek elősegítik a mell hámsejtjeinek átalakulását, a rákos sejtek szaporodását és invázióját, valamint a daganattal kapcsolatos neovaszkularizációt, amelyek hozzájárulnak a rossz prognózishoz. Beszámoltak továbbá arról, hogy az elhízás által közvetített gyulladás hajtja az ösztrogénszintézist, ami növeli a HP BrCA kockázatát; korábbi tanulmányok összefüggésbe hozták az AT gyulladásgátló citokinek upregulációját az ösztrogén-szintáz citokróm P450 (aromatáz) expressziójával egérvizsgálatokban 24, valamint pre- és postmenopauzás humán BrCA 25-ben, 26-ban. .
Eredmények
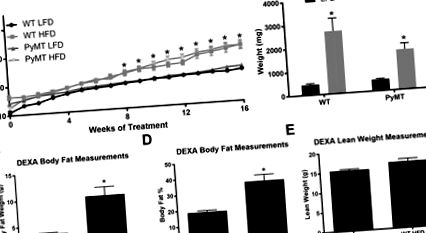
A HFD-vel táplált PyMT és vad típusú egereknél nagyobb a testtömeg-növekedés és nagyobb a zsigeri zsírbetétek össztömege, mint az LFD-vel táplált egereknél
A HFD kezelés szignifikánsan megnövelte a testtömeget mind a WT, mind a PyMT csoportban a diétás kezelés 8. hetétől kezdve, és a 16 hetes kezelési periódus alatt magas maradt (1. ábra a)), P 1. ábra b), P 1. ábra ( a)) és a zsigeri zsírpárna összes tömege (1. ábra (b)). A WT egerek testösszetétel-elemzése a kezelés 16. hetében azt mutatta, hogy a HFD-vel táplált egerek testtömeg-tömege grammban és testzsírszázalékban szignifikánsan nagyobb volt (1. ábra (c), D, P 1. ábra (e)).
Testtömeg-jellemzők a menopauza előtti kísérlethez. A WT és PyMT egereket 16 hétig LFD-vel vagy HFD-vel etettük. A testtömeget minden csoportban hetente ellenőriztük. A WT egerek testösszetételét a vizsgálat végén (20 hetes korban) értékeltük; A PyMT csoportokat nem elemezték a testösszetétel szempontjából, mivel a daganatok megváltoztathatják a sovány tömeg számítását. A zsigeri zsírpárnákat eltávolítottuk és lemértük a 16 hetes diétás kezelés végén. a. Testtömeg grammban. b. A zsigeri zsírpárnák teljes abszolút tömege. c. A WT egerek testösszetételének elemzése, testzsír grammban. d. Testzsírszázalék. E. A sovány tömeg grammban. * a diéta fő hatása. Az adatok ± SEM, WT LFD, n = 8 WT HFD, n = 8 PyMT LFD, n = 12 PyMT HFD, n = 15.
A HFD diéta krónikus fogyasztása premenopauzális modellben növeli a tumorgenezist és a hisztopatológiai tumor stádium progresszióját
A tumor feláldozása és a hisztopatológiai pontozás a menopauza előtti kísérlethez. A WT és PyMT egereket 16 hétig LFD-vel vagy HFD-vel etettük. 16 hetes táplálkozás után az egereket eutanizálták és a tumorokat eltávolították, megmérték, megszámolták és lemérték. Annak megerősítésére, hogy az étrend nem befolyásolta a transzgén expresszióját, mértük a PyMT transzgén mRNS expresszióját az emlőmirigyben. Az emlőmirigy hisztopatológiai pontozását az LFD-vel és a HFD-vel kezelt csoportok H&E festésével követték. a. Feláldozzuk a tumor mennyiségét egérenként. b. Feláldozzuk a tumor számát egérenként. c. Feláldozzuk a tumor terhet (súly) egérenként. d. A PyMT transzgén mRNS expressziója az emlőmirigyben. e. Az emlőmirigy hisztopatológiai pontozása mindkét kezelési csoportnál. f. A diszplázia fokozatának reprezentatív képei az egyes kezelési csoportok azonosításához. * P 3. ábra (a), P 3. ábra (b), P 3. ábra (c), P # a genotípus fő hatása. Az adatok ± SEM, WT LFD, n = 8 WT HFD, n = 8 PyMT LFD, n = 12 PyMT HFD, n = 15.
A tumorgenezis növeli az emlőmirigy gyulladásos és proliferációs markereit
A PyMT egerek emlőmirigyében a makrofág markerek (F4/80 és CD64) mRNS expressziójában nem volt különbség az LFD és HFD rákcsoportok között. A HFD-etetések azonban emelkedő tendenciát eredményeztek a Mer-tirozin-kináz (Mertk) makrofág marker expressziójában az emlőmirigyben (3. ábra (d), p = 0,06). A genotípus jelentős fő hatását a gyulladásos citokin és kemokin markerek (IL-6, TNFα és MCP-1) mRNS-expressziójában és az emlőmirigy Ki67 proliferációs markerében figyelték meg (3. ábra (e), P 3. ábra f).
A hosszú távú HFD-etetés drasztikusan növeli az ovariectomizált egerek testtömeg-növekedését, ami az összes zsigeri zsír tömegének jelentős növekedését eredményezi az LFD-vel táplált egereknél
A HFD kezelés szignifikánsan (több mint 2-szeres) megnövelte az ovariectomizált egerek testsúlyát a diéta kezelés első hetétől kezdve, és a 18 hetes kezelési periódus alatt magas maradt (4. ábra (a), P ábra: 4 (b)) és az összes ivarmirigy zsírpárna súlya (2-szeres) (4. ábra (c)), a HFD-vel táplált egerek összsúlya szignifikánsan nagyobb (P 5. ábra a), tumor száma (5. ábra a)), sem a tumor súlya Az 5. ábra (c) ábra) a diétás kezelési csoportok között ebben a modellben. Valójában az egyes csoportokból származó egereknek csak kis százaléka, az egyes csoportokból LFD-vel és HFD-vel táplált egereknek csak 25% -a, illetve 20% -a számolt be hisztopatológiai emlőmirigy-stádium progressziójáról MIN fokozatba vagy azon túl (5. ábra (d)). Hasonlóképpen, a HFD kezelésnek nem volt hatása a gyulladásos citokinekre, az IL-6 és a TNFα expressziójára az emlőmirigyben (5. ábra (e)).
Összefoglalva, beszámolunk arról, hogy a HFD által kiváltott elhízás az emlő tumorigenesisének növekedését és a gonadal AT AT szabályozott aromatáz expressziójának növekedését eredményezi a premenopauzális BrCA HP PyMT/MMTV egér modelljében. Bár az aromatáz expressziója szerepet játszik a postmenopausalis BrCA több mechanizmusának modulálásában, a tumorigenesisben való részvétele premenopauzális modellben nem bizonyított. Bár köztudott, hogy az elhízás a proinflammatorikus mediátorok szintjének növekedéséhez vezet, további kutatások szükségesek az aromatáz fokozott expressziójának funkcionális kapcsolatának kimutatására az emlő tumorigenesisében. Ez az elhízás, gyulladás és aromatáz tengely adja az alapját a mechanizmuson alapuló stratégiák kidolgozásának a HP BrCA kockázatának csökkentésére a populáció ezen növekvő szegmensében.
Anyagok és módszerek
Állatok
A C57BL/6 háttérrel rendelkező hím PyMT/MMTV egereket véletlenszerűen tenyésztették nőstény vad típusú (WT) egerekkel, hogy a PyMT transzgénre heterozigóta nőstény egereket kapjanak. Két független kísérletet végeztek az emlődaganatképződés vizsgálatára, mivel az a menopauza állapotára vonatkozik. Az első kísérletben (Exp1) PyMT petefészek intakt nőstényeket és női WT alomtársakat alkalmaztak nem betegség kontrollként. Az Exp1 egereket 20 hetes korukban (16 hetes diétás kezelés) eutanizálták. A második kísérlet (Exp2) csak PyMT petefészekektől eltávolított nőstényeket tartalmazott. Öt hetes korukban az egereknek petefészek-eltávolítási műtétet hajtottak végre, és egy hétig hagyták őket helyreállni a diétás kezelések megkezdése előtt. Az Exp2 egereket 24 hetes korukban (18 hetes diétás kezelés) eutanizálták. Az összes kísérleti egeret a Dél-Karolinai Egyetem állatkutató létesítményében tenyésztették és gondozták. 3–5/ketrecben helyezték el őket, 12: 12 órás világos-sötét ciklusban, alacsony stressz mellett (22°C, 50% páratartalom, alacsony zajszint) és ad libitum étel és víz. A laboratóriumi állatok gondozásának alapelveit betartották, és a Dél-Karolinai Egyetem Intézményi Állatgondozási és Használati Bizottsága minden kísérletet jóváhagyott.
Genotipizálási protokoll
Minden kísérletben nőstény egereket használtak, és a PyMT transzgén genotípusát a primer szekvenciák felhasználásával készítettük el az alábbiak szerint:
Az egér farokrészét 150 ul DirectPCR farokpufferhez (Viagen Biotech Inc., Los Angeles, Kalifornia) és 2 ul Proteinase K-hez (Viagen Biotech Inc., Los Angeles, Kalifornia) adtuk, és egy éjszakán át emésztettük 55 ° C-on. Másnap a mintákat 95 ° C-on inkubáltuk egy órán át, majd hozzáadtuk PCR-koktélhoz amplifikálás céljából. A PCR koktél tartalmaz DNS templátot, upstream és downstream primereket, ddH20 és GoTaq Green Master Mix (Promega Corp, Madison, WI). A mintákat 2% -os agaróz gélen futtattuk, és összehasonlítottuk a kontroll mintákkal a genotípus meghatározásához (520 bázispár molekulatömeg PyMT/MMTV pozitív mintákhoz).
Ovariectomia műtét
Az egereket rövid ideig izofluránnal altattuk. A hátsó deréktáji területet megborotválták, és jóddal és alkohollal letörölték. A borda mellkasának farka és a farok töve között félúton 2 cm-es hátsó középvonalú bőrmetszést végeztek. A fasciát tompa boncolással megtisztítottuk. Egyetlen, 1 cm-nél rövidebb metszést végeztek az izomfalban mind a jobb, mind a bal oldalon, körülbelül 1 cm-re a gerinc felé nézve. A petefészket és a hátizom alatti zsírpárnában elhelyezkedő méhszarvakat csipesszel kivágták a bemetszéseken keresztül. Mindkét méhszarvat varrattal kötöttük össze a petefészek alatt (nem felszívódó 5–0. Varrat, cat # S-G518R13), és a petefészket egyetlen vágással eltávolítottuk. A méhszarvakat visszahelyeztük a hasüregbe. Az izommetszeteket 5–0 felszívódó varrattal zártuk le (Cat # S-G518R13-U). A sebmetszőket a bőr bemetszésének lezárására használták. Az állatokat a műtét után legalább 72 órán át megvágták metszésjavításon vagy fertőzésen. A sebkapcsokat a műtét utáni 7. napon eltávolítottuk.
Fogyókúrák
Az Exp1 esetében a PyMT egereket és a WT nem betegség kontroll kontroll egereket véletlenszerűen vagy alacsony zsírtartalmú étrendbe (LFD), vagy HFD kezelési csoportba sorolták 4 hetes kortól kezdve. Az AIN-76A étrendet (zsírban 11,5% kcal) az LFD-hez használták (Bioserv, Frenchtown, NJ) 45, 46. Az AIN-76A tisztított, kiegyensúlyozott étrend, amely fitoösztrogénmentes. Az étrendi fitoösztrogénekről kimutatták, hogy befolyásolják a szorongással kapcsolatos viselkedést, a zsírlerakódást, a vér inzulin-, leptin- és pajzsmirigyszintjét, valamint az adipociták lipogenezisét és lipolízisét 47. A D12492 diétát (zsírban 60% kcal) a HFD-hez (Research Diets, New Brunswick, NJ) használták. Az egereket 16 hétig etették a megfelelő étrendjükkel.
Az Exp2-ben a 6 hetes PyMT egereket véletlenszerűen osztották ugyanahhoz az 1. kísérletben használt LFD és HFD kezelési csoporthoz. Az egereket 18 hétig etették a megfelelő étrendjükkel.
Testtömeg, táplálékfelvétel és testösszetétel
A testtömeget és az étkezés mennyiségét hetente ellenőriztük mindkét kísérletben. A WT egerek testösszetételét a vizsgálat végén (20 hetes kor) értékeltük az Exp1-ben. A PyMT csoportokat nem elemezték a testösszetétel szempontjából, mivel a daganatok megváltoztathatják a sovány tömeg számítását. Röviden, az egereket altatásnak vetettük alá (izoflurán inhaláció), és a kettős energiájú röntgenabszorpciós módszerrel (DEXA) értékeltük a sovány tömeg, a zsírtömeg és a testzsír százalékát (Lunar PIXImus, Madison, WI) 46 .
Daganat tapintása
A tumorokat 14 hetes korban (10 hetes diétás kezelés) és 14 hetes korban (8 hetes diétás kezelés) mértük az Exp1 és az Exp2 mindegyikére, ugyanaz a vizsgáló. A PyMT/MMTV egereknél tipikusan 12 és 16 hetes, 27 éves kor között tapintható emlődaganatok alakulnak ki. Daganat tapintása után féknyergeket használtak a daganat leghosszabb és legrövidebb átmérőjének mérésére. Minden egérben feljegyeztük a daganatok számát, és a daganat térfogatát becsültük az egyes daganatokra a következő képlet alkalmazásával: 0,52 X (legnagyobb átmérő) X (legkisebb átmérő) 2, az előzőekben leírtak szerint 48 .
Szövetgyűjtemény
16 hetes (Exp1) és 18 hetes (Exp2) étrendi kezelést követően az egereket feláldoztuk a szövetgyűjtéshez. Látható daganatokat boncoltak az emlőmirigyekből, és mértük a daganat tömegének és térfogatának meghatározásához. Ezután a mellkasi emlőmirigy maradék szövetének egy részét eltávolítottuk mind a jobb, mind a bal oldalról. A zsigeri zsírpárnákat eltávolítottuk. Ezeket a szöveteket vagy folyékony nitrogénben lefagyasztották gén expressziós elemzés céljából, vagy 4% formaldehidben rögzítették immunhisztokémiai elemzés céljából.
Szövettan
Mind az Exp1, mind az Exp2 mellkasi emlőmirigy egy részét kivágtuk mindegyik egérből, egy éjszakán át 4% -os formaldehidben rögzítettük, alkohollal dehidratáltuk és viaszba ágyazottuk. A paraffin metszeteket hematoxilinnal és eozinnal (H&E) festettük. Az emlőmirigyet ezt követően vakon értékelte egy patológus, és a dysplasia fokozatának megfelelően jellemezte: nincs hiperplázia, adenoma/emlő intraepithelialis neoplasia (MIN), valamint korai és késői invazív carcinoma mindkét kísérletben 27. Immunhisztokémiát végeztünk az a-SMA festésére (Cell Signaling # 19245), hogy megerősítsük a dysplasia fokozatát. Továbbá monocita/makrofág infiltrációt figyeltünk meg az emlőmirigy CD68 + (Cell signaling # 76437) sejtjeinek pozitív festésével.
PCR-tisztítás a PyMTtransgene szekvenálásához
Az egyes kezelési csoportokból (PyMT Con 4 és PyMT HFD 2) egy gDNS-mintát és egy cDNS-mintát alkalmaztunk a PyMT transzgén szekvenálási kísérleteihez. A gDNS-t és a cDNS-t egyaránt bevontuk annak megerősítésére, hogy a transzgén szekvencia nem tartalmaz plazmid/vektor intron inszerciókat. A minták PCR-tisztítását az EdgeBio Quick Step 2 PCR tisztító készlet segítségével hajtottuk végre a gyártási protokoll szerint (Edge Biosystems, Gaithersburg, MD). Az eluátumokat a szekvenáláshoz megtartottuk.
A PyMT transzgén szekvenálása
Két Sanger szekvenálási reakciót hajtottunk végre (mindegyik primerhez egyet-egyet) a három mintához Big Dye kémia alkalmazásával (Applied Biosystems, Foster City, Kalifornia), a gyártó ajánlásait követve, hacsak másképp nem jelezzük. Pontosabban, minden 20 µL reakció tartalmazott 1 ul Big Dye 3.1-es verziót, 0,5 ul primert (10 mM PYVT1 vagy PYVT2) és 5 ul PCR-tisztított terméket. A lánczáró PCR-t 50 cikluson keresztül végeztük. A termékeket a felesleges primerekből és a dNTPS-ből megtisztítottuk Edge Bio Performa gélszűrő patron (Edge Biosystems, Gaithersburg, MD) segítségével, és detektáltuk egy Applied Biosystem 3730 DNS analizátorral (Applied Biosystems, Foster City, CA). A szekvenciákat a Sequencher 5.2.4 verziójával (http://www.genecodes.com) vizualizálták és állították össze.
Valós idejű kvantitatív PCR
Statisztikai analízis
Az összes adatot kereskedelmi szoftverek segítségével elemeztük (GraphPad Software, Prism 7, La Jolla, CA, USA). Az Exp1 esetében a teljes testtömeg elemzését minden idõpontban kétirányú varianciaanalízissel végeztük. A zsigeri zsír teljes tömegét, az ivarmirigy teljes tömegét, az ivarmirigy F4/80 mRNS-analízisét, az emlőmirigy-gyulladás és proliferációs mediátorokat, valamint a VEGFα-t kétirányú varianciaanalízissel elemeztük. Az összes DEXA információt, az áldozati tumor adatait, az ivarmirigy CD11c, CD64, Cy19A1 mRNS elemzését, az emlőmirigy MMP2/9 mRNS elemzését kétfarkú t-teszttel elemeztük. Bonferroni korrekciót alkalmaztunk minden post-hoc elemzéshez. Az Exp2-ben az összes adatot kétfarkú t-teszttel elemeztük. A statisztikai szignifikanciát P ≤ 0,05 α értékkel állítottuk be. Az adatokat átlag ± SEM-ként ábrázoljuk.
Finanszírozási nyilatkozat
Ezt a munkát az Országos Egészségügyi Intézetek támogatásai támogatták (F31CA183458 - T.L.C. és R21CA167058, R21CA175636, R21CA191966 és K01AT007824 - E.A.M.)
A lehetséges összeférhetetlenség nyilvánosságra hozatala
Potenciális összeférhetetlenséget nem hoztak nyilvánosságra.
- A ginzeng étrend-kiegészítők hatása a magas zsírtartalmú étrend által kiváltott elhízásra C57BL6 egerekben -
- Az AM80 hatásai az AC261066-hoz képest magas zsírtartalmú étrendes májbetegség-modellben
- Az FTO haplotipizálása kiemeli az elhízás kockázatát az európai lakosság körében - PubMed
- A ritmus megzavarása A diéta okozta elhízás rontja a napi ritmust a metabolikus szövetek cukorbetegségében
- Az Akkermansia muciniphila és a bélhám közötti keresztbeszélgetés szabályozza az étrend okozta elhízást