A NAD + és az ADP-riboziláció szerepe a Golgi-struktúra fenntartásában
Alekszandr Mironov
* Sejtbiológiai és Onkológiai Tanszék, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Santa Maria Imbaro (Chieti), Olaszország; és ‡ Kaliforniai Egyetem Biológiai Tanszéke, San Diego, La Jolla, Kalifornia 92093
Antonino Colanzi
* Sejtbiológiai és Onkológiai Tanszék, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Santa Maria Imbaro (Chieti), Olaszország; és ‡ Kaliforniai Egyetem Biológiai Tanszéke, San Diego, La Jolla, Kalifornia 92093
Maria Giuseppina Silletta
* Sejtbiológiai és Onkológiai Tanszék, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Santa Maria Imbaro (Chieti), Olaszország; és ‡ Kaliforniai Egyetem Biológiai Tanszéke, San Diego, La Jolla, Kalifornia 92093
Giusy Fiucci
* Sejtbiológiai és Onkológiai Tanszék, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Santa Maria Imbaro (Chieti), Olaszország; és ‡ Kaliforniai Egyetem Biológiai Tanszéke, San Diego, La Jolla, Kalifornia 92093
Silvio Flati
* Sejtbiológiai és Onkológiai Tanszék, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Santa Maria Imbaro (Chieti), Olaszország; és ‡ Kaliforniai Egyetem Biológiai Tanszéke, San Diego, La Jolla, Kalifornia 92093
Aurora Fusella
* Sejtbiológiai és Onkológiai Tanszék, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Santa Maria Imbaro (Chieti), Olaszország; és ‡ Kaliforniai Egyetem Biológiai Tanszéke, San Diego, La Jolla, Kalifornia 92093
Roman Polishchuk
* Sejtbiológiai és Onkológiai Tanszék, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Santa Maria Imbaro (Chieti), Olaszország; és ‡ Kaliforniai Egyetem Biológiai Tanszéke, San Diego, La Jolla, Kalifornia 92093
Alekszandr Mironov, ifj.
* Sejtbiológiai és Onkológiai Tanszék, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Santa Maria Imbaro (Chieti), Olaszország; és ‡ Kaliforniai Egyetem Biológiai Tanszéke, San Diego, La Jolla, Kalifornia 92093
Giuseppe Di Tullio
* Sejtbiológiai és Onkológiai Tanszék, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Santa Maria Imbaro (Chieti), Olaszország; és ‡ Kaliforniai Egyetem Biológiai Tanszéke, San Diego, La Jolla, Kalifornia 92093
Roberto Weigert
* Sejtbiológiai és Onkológiai Tanszék, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Santa Maria Imbaro (Chieti), Olaszország; és ‡ Kaliforniai Egyetem Biológiai Tanszéke, San Diego, La Jolla, Kalifornia 92093
Vivek Malhotra
* Sejtbiológiai és Onkológiai Tanszék, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Santa Maria Imbaro (Chieti), Olaszország; és ‡ Kaliforniai Egyetem Biológiai Tanszéke, San Diego, La Jolla, Kalifornia 92093
Daniela Corda
* Sejtbiológiai és Onkológiai Tanszék, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Santa Maria Imbaro (Chieti), Olaszország; és ‡ Kaliforniai Egyetem Biológiai Tanszéke, San Diego, La Jolla, Kalifornia 92093
Maria Antonietta De Matteis
* Sejtbiológiai és Onkológiai Tanszék, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Santa Maria Imbaro (Chieti), Olaszország; és ‡ Kaliforniai Egyetem Biológiai Tanszéke, San Diego, La Jolla, Kalifornia 92093
Alberto Luini
* Sejtbiológiai és Onkológiai Tanszék, Istituto di Ricerche Farmacologiche Mario Negri, Consorzio Mario Negri Sud, 66030 Santa Maria Imbaro (Chieti), Olaszország; és ‡ Kaliforniai Egyetem Biológiai Tanszéke, San Diego, La Jolla, Kalifornia 92093
Absztrakt
Anyagok és metódusok
Sejtkultúra
Patkány bazofil leukémia (RBL) -2H3 sejteket tenyésztettünk 16% FCS-sel és 1 mM 1 -glutaminnal kiegészített DME-ben. CHO sejteket 10% FCS-sel kiegészített DME-ben tenyésztettünk.
Antitestek és egyéb reagensek
A csontváz nyúlizmokból származó NAD +, NADP +, NADH +, NADH, BFA és GAPDH-t a Sigma Chemical Co.-tól (St. Louis, MO) szereztük be. A szöveti tenyésztési anyagok a GIBCO BRL-től (Grand Island, NY) és a Seromed-től (Berlin, Németország) voltak. A GTP és az ATP a Boehringer Mannheim-től (Mannheim, Németország) származott. Nyúl anti-α-mannozidáz II (Man II) antitestet K. Moremen (University of Georgia, Athén, GA), nyúl anti-β-COP antitestet J. Donaldson és J. Lippincott-Schwartz (Nemzeti Intézetek) szolgáltatott. Bethesda, MD). Az összes többi vegyi anyagot a lehető legnagyobb tisztasággal kereskedelmi forrásokból nyertük. A BFA-t -20 ° C-on DMSO törzsoldatokban tároltuk. A dikumarolt vizes oldatként történő felhasználás előtt állítottuk elő.
Sejtek permeabilizálása
Az RBL-t (üvegkamrás tárgylemezeken növesztve) jégre helyeztük és azonnal átmostuk a permeabilizációs pufferrel (PB: 25 mM Hepes-Koh, pH 6,95, 125 mM KOAc, 2,5 mM Mg [OAc] 2, 10 mM glükóz, 1 mM DTT, 1 mM EGTA és 0,5 μM taxol). A sejteket ezután 3 U/ml sztreptolcin O-val (SLO) (Biomerieux, Marcy l'Etoile, Franciaország) inkubáltuk, amelyet előzőleg 5 percig aktiváltunk szobahőmérsékleten PB-ben 8 percig jégen. A nem kötött SLO-t eltávolítottuk, és a sejtek egyrétegét hideg PB-vel mostuk, majd 1 mg/ml patkányagyi citoszollal, 1 mM ATP-vel, 250 μM UTP-vel, 2 mM kreatin-foszfáttal, 7,3 U/ml kreatin-foszfokinázzal kiegészített permeabilizációs pufferrel kezeltük 37 ° C-on. ° C-on 20-30 percig (a jelzett kezelések jelenlétében). A permeabilizáció mértékének ellenőrzésére a sejteket Trypan kék (és propidium jodid) festékkel mértük, és mértük a citoszolos enzim tejsav-dehidrogenáz szivárgását. Az SLO-kezelés elfogadott ütemtervével a sejtek 95% -át Trypan-kékkel vagy propidium-jodiddal festették, és a tejsav-dehidrogenáz aktivitás> 80% -át a permeabilizált sejt egyrétegű felülúszójában nyertük el. Patkány agyi citozolt készítettünk Malhotra és mtsai. (1989).
BFA-függő ADP-ribozilezés
ADP-ribozilezés permeabilizált sejtekben.
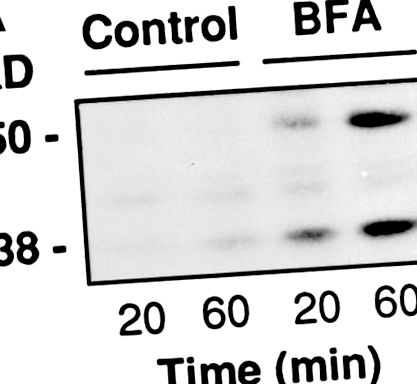
Az RBL sejteket 24 üregű lemezekre szélesztettük, és 24 óra elteltével 90% -os összefolyásnál (300 000 sejt/üreg/250 μl) felhasználtuk. A fent leírtak szerint permeabilizáltuk, majd 20 vagy 60 percig PB-nek tettük ki 500 μM timidint, 30 μM 32 P-NAD + -ot (3 μCi/minta) és adott esetben BFA-t tartalmazó PB-vel. Az inkubációk végén a felülúszót és a sejtfehérjéket 10% TCA-val kicsapjuk, mintapufferben oldjuk és SDS-PAGE-n elválasztjuk. A BARS-50-hez és a GAPDH-hoz kötött radioaktivitást fluorográfiával értékeltük.
A citoszol ADP-ribozilezése.
A citoszolt és a membránokat patkányagyból készítettük a leírtak szerint (De Matteis és mtsai, 1994). A citoszolt (10 mg/ml) és a sóval mosott membránokat (2 mg/ml) inkubáltuk 200 μM NAD + vagy 100 μM BFA vagy mindkettő jelenlétében vagy hiányában 60 percig 37 ° C-on. Ilyen kísérleti körülmények között a BARS-50 ADP-ribozilációja (amelyet 32 P-NAD + jelenlétében futtattunk párhuzamos kísérletekben értékeltünk) maximális volt (> 90%), míg a GAPDH csak részleges (3–4%). Semmilyen más fehérjét nem detektálhatóan ADP-ribozilezett a BFA (lásd a 3. ábrát). 3). Az inkubáció végén a mintákat 100 000 g-vel 60 percig centrifugáltuk, majd a felülúszókat (citoszolt) 16 órán át 4 ° C-on dializáltuk, és permofilizált sejtekben végzett immunfluoreszcencia kísérletekben használtuk az alábbiakban leírtak szerint.
A BFA a BARS-50 és a GAPDH ADP-ribozilezését indukálja permeabilizált sejtekben. (A) Az RBL sejteket 3 U/ml SLO-val permeabilizáltuk, és 10 μg/ml BFA-nak tettük ki 32 P-NAD + jelenlétében 20 vagy 60 percig, 37 ° C-on. Az inkubáció végén a fehérjéket SDS-PAGE-n szétválasztottuk, és a BARS-50-hez és a BAP jelenlétében a GAPDH-hoz kötött radioaktivitást fluorográfiával értékeltük. Hasonló eredményeket kaptunk négy kísérletben. (B) A citoszolt ADP-riboszilezettük pontosan az Anyagok és módszerek részben leírtak szerint. A fehérjéket SDS-PAGE-n szétválasztottuk, és a radioaktív sávokat fluorográfiával tártuk fel. Csak a BARS-50 és a GAPDH volt detektálhatóan ADP-ribozilezett a BFA-val. A GAPDH a toxin hiányában is gyengén módosult, a BFA által kiváltottaktól eltérő nemenzimás ADP-riboziláció következtében (De Matteis et al., 1994).
Immunfluoreszcencia és lektinfestés
Elektronmikroszkópia
A sejteket 2% glutáraldehiddel PBS-ben (pH 7,4) rögzítettük, redukált ozmiummal (1% OsO4 és 1,5% kálium-ferrocianid 0,1 M kacodilátpufferben, pH 7,4) utólag rögzítettük, és az Epon 812-be ágyazottuk, a korábban leírtak szerint (Buccione et al., 1996).
BARS-50-del dúsított citoszolos frakciók előállítása
A patkány agyi citozolt (Malhotra és mtsai, 1989) 35% telített (NH4) 2SO4-tal kicsapjuk. A csapadékot 25 mM Hepes-ben (pH 8,0) oldjuk, amely 5% glicerint, 0,5 M (NH4) 2SO4 és 1 mM DTT-t (A puffer) tartalmaz, és egy fenil-szefaróz HP oszlopra (Pharmacia Biotech, Piscataway, NJ), pufferral egyensúlyba hozva. A. A fehérjéket az A puffer lineáris gradiensével eluálva mínusz (NH4) 2SO4. A BARS-50-et tartalmazó frakciókat a BFA-függő ADP-ribozilációs esszével azonosítottuk (De Matteis et al., 1994). Ezeket a (45-szeresen dúsított BARS-50-t és GAPDH-t nem tartalmazó) frakciókat betöményítettük, és egy éjszakán át B pufferrel (25 mM Hepes, pH 7,2, 50 mM K és 1 mM Mg acetát) szemben dializáltuk. A végső fehérjekoncentráció 2-3 mg/ml volt.
Eredmények
NAD + szükséges a Golgi-komplex BFA által kiváltott tubuláris retikuláris transzformációjához és a Golgi-enzimek ER-be történő újraelosztásához
NAD + szükséges a Golgi markerek BFA által indukált újraeloszlásához permeabilizált sejtekben. Az ép RBL-sejteket (a és b) 3 μg/ml BFA-val kezeltük 15 percig (b), vagy 3 U/ml SLO-val (c – f) permeabilizáltuk, és 20 percig inkubáltuk 37 ° C-on, az alábbiak szerint: Anyagok és módszerek (c) vagy 150 μM NAD + (e), vagy 10 μg/ml BFA önmagában (d) vagy BFA és 150 μM NAD + (f) hiányában. A sejteket ezután anti-Man II antitesttel festettük. Hasonló eredményeket kaptunk a helix pomatia lectin alkalmazásával, amely a cis Golgi rekesz markerje (nem látható). A kísérleteket négyszer ismételtük meg, hasonló eredményekkel. Rúd, 5 μm
A Golgi komplex ultraszerkezete permeabilizált sejtekben: NAD + szükséges a BFA hatásához. Az ép RBL-sejteket (a és b) 3 μg/ml BFA-val kezeltük 15 percig (b), vagy 3 U/ml SLO-val (c – f) permeabilizáltuk, és 20 percig inkubáltuk 37 ° C-on. (c) vagy önmagában BFA (d) vagy 150 μM NAD + (e) vagy BFA és 150 μM NAD + (f) kombinációjában. A sejteket ezután elektronmikroszkóppá dolgoztuk fel. A kísérleteket legalább háromszor ismételtük meg, hasonló eredményekkel. Rúd, 0,5 μm.
Ezután megvizsgáltuk a NAD + hozzáadását a permeabilizáló közeghez. A nukleotid (15–450 μM) és a dializált citoszol (1 mg/ml) jelenlétében a BFA feltűnően visszanyerte képességét a Golgi-komplex újraeloszlásának kiváltására (1. ábra 1 f), bár alacsonyabb hatékonyság, mint ép sejtekben (EC50: ∼5 μg/ml). Mind a NAD +, mind a citoszolra volt szükség a BFA aktivitásának kifejezéséhez. A NAD + BFA hiányában nem volt látható hatással (1. ábra e). A BFA nagyon magas koncentrációi (> 50 μg/ml) vagy a toxinnal végzett hosszú inkubációk képesek voltak lassú Golgi-szétesést kiváltani, még NAD + hiányában is az inkubációs közegben (nem látható). A BFA, amely feltételezhetően a permeabilizálás után megmaradt, a sejtek NAD + -ja elegendő lehet a Golgi-szétszerelés fenntartásához. Annak megvizsgálására, hogy a NAD + ezen hatása a nukleotid redoxireakciókban való részvételének köszönhető-e, az NADH (amely inaktív az ADP-szubsztrátjaként) riboszilezést) adtunk a NAD + -val együtt az oxidált nuklé kétszeres koncentrációjáig eotid. A NADH nem volt hatással a Golgi morfológiájára mind BFA jelenlétében, mind annak hiányában (nem látható).
BFA-függő ADP-ribozilezés permeabilizált sejtekben
Mivel az ADP-ribozilezést korábban csak sejthomogenátumokon vizsgálták, fontos volt ellenőrizni, hogy a reakció permeabilizált sejtekben is lejátszódik-e. A sejteket a morfológiai kísérletekhez használt körülmények között SLO-val porizáltuk, radioaktív NAD + -nak és BFA-nak tettük ki az permeabilizált sejtekben az EC50 kétszeres koncentrációjában, és értékeltük a GAPDH és a BARS-50 jelölését. A 3. ábra A 3 A ábra azt mutatja, hogy az ADP-riboziláció (a maximális szint ~ 10% -ánál) 20 perc elteltével egyértelműen kimutatható volt. Az erősebb jel hiányának oka lehet a BARS-50 (natív Mol Wt: ∼200 kD; Di Girolamo és mtsai, 1995) lassú cseréje az SLO által indukált pórusokon keresztül. Ez a BARS-50 hosszú állandóságát eredményezné a sejtben (az ADP-riboziláló enzim közvetlen közelében), és ezért az ADP-ribozilezett fehérje magas intracelluláris koncentrációját eredményezné, míg az extracelluláris citoszol ADP-riboszilezett lehet kisebb mértékben.
Az ADP-ribozilációs szubsztrátumok bevonása a BFA hatásaival a golgi morfológiára
A pre-ADP-ribozilezett citoszol helyettesíti a NAD + -ot a BFA Golgi-szétszerelő aktivitásának fenntartásában. A BARS-50 tartalmú kivonatok hatása. Az RBL sejteket 3 U/ml SLO-val permeabilizáltuk, és kontroll (a – c) vagy ADP-ribosilált (d – i) citozollal (1 mg/ml) inkubáltuk 20 percig 37 ° C-on, a és d hiányában. vagy 10 μg/ml BFA jelenlétében (b, c és e – i). A natív BARS-50-et (az Anyagok és módszerek szerint előállított és ADP-ribozilezett citoszollal tízszer hígított kivonatot) i-be (NAD + -val) és g-ba NAD + nélkül adtuk. AD-riboszilezett BARS-50-et (a natív BARS-50-et tartalmazó kivonattal megegyező kivonatot, de ADP-ribozilezett citozolból készített kivonatot; lásd: Anyagok és módszerek) h-hez adtuk. A sejteket rögzítettük és anti-Man II antitesttel jelöltük. Hasonló eredményeket kaptunk négy különböző kísérletben. Rúd, 5 μm.
A Coatomer szerepe
NAD + nem szükséges a BFA által indukált koatomer disszociációhoz a Golgi komplextől permeabilizált sejtekben. Az ép RBL-sejteket (a és b) 3 μg/ml BFA-val (b) kezeltük, vagy 3 U/ml SLO-val permeabilizáltuk, majd kontroll puffernek (c) vagy 150 μM NAD + -ot (e ), vagy 10 μg/ml BFA önmagában (d), vagy BFA 150 μM NAD + (f) -vel kombinálva. A sejteket rögzítettük, szaponinnal permeabilizáltuk és anti-β-COP antitesttel festettük. Az SLO permeabilizáció a β-COP részleges leválását indukálja a Golgi-komplexből (c) az ép sejtekhez képest (a), de a BFA teljesen hatékonyan indukálja a β-COP teljes citoszolos redisztribúcióját, függetlenül a NAD + jelenlététől a permeabilizációs pufferben (d és f). Az pre-ADP-ribozilezett citoszol (g és h) megkülönböztethetetlenül viselkedik a kontroll citozoltól. Hasonló eredményeket kaptunk permeabilizált CHO sejtekben (nem látható). A kísérleteket négyszer ismételtük meg, hasonló eredményekkel. Rúd, 5 μm.
A BFA-függő ADP-ribosiláció gátlói megakadályozzák a BFA által kiváltott Golgi szétszerelést. Az ADP-ribozilációs szubsztrátok szerepe
A dicumarol megakadályozza a BFA által kiváltott tubuláris-retikuláris transzformációt a Golgi-készülékben. Az RBL sejteket 30 percig 200 μM dikumarollal végzett előkezelés után 15 percen keresztül kezeltük a megadott BFA koncentrációval. Ezután elektronmikroszkópiára dolgozták fel őket. A dicumarol (és az ilimaquinone, nem látható) megakadályozza a Golgi-kötegek tubuláris-retikuláris átalakulását és eltűnését, amelyet a közepes (a), de nem a BFA (b) magas koncentrációja indukál. Hasonló eredményeket kaptak három független kísérletben, amelyeket két példányban futtattak. Rúd, 0,5 μm.
Az pre-ADP-ribozilezett citoszol megakadályozza, és a natív BARS-50 megmenti a dikumarol anti-BFA hatásait a permigilizált sejtekben a Golgi komplexre. Az RBL sejteket 3 U/ml SLO-val permeabilizáltuk, és 20 percig 37 ° C-on inkubáltuk BFA-t (10 μg/ml) és NAD + -ot (150 μM) tartalmazó táptalajban (a, c, e és g) vagy 200 μM dicumarollal (b, d, f és h) kontroll (a és b) vagy pre-ADP-ribosilezett (c – h) citoszol (1 mg/ml) jelenlétében. Egy natív BARS-50-tel dúsított kivonatot (lásd a 4. ábra 4. ábráját) adtunk az (e) és (f) pontokhoz, míg az ADP-riboszilezett BARS-50-et a (g) és (h) pontokhoz adtuk. A sejteket rögzítettük és anti-Man II antitesttel jelöltük. Hasonló eredményeket kaptunk három független kísérletben. Rúd, 5 μm.
Vita
NAD + szükséges a Golgi szétszereléséhez a BFA-nál
Az ADP-ribozilezett citoszol helyettesíti a NAD + -ot a BFA által kiváltott Golgi-szétszerelés támogatásában
Az ADP-riboziláció-gátlók megakadályozzák a BFA hatását a golgi szerkezetére, és a citoszolos ADP-ribozilációs szubsztrátokon keresztül hatnak.
A szubsztrát fehérjék ADP-ribozilációja a permeabilizált sejtekben történik
Összességében a fenti megállapítások a NAD + és az ADP-ribozilezett citoszol szerepéről erősen alátámasztják a NAD + és az ADP-ribosiláció szerepét a Golgi architektúrát ellenőrző BFA-érzékeny gépekben. Az ADP-ribozilezés azonban nem elegendő a toxin morfológiai hatásainak magyarázatához, mivel az ADP-ribozilezett citozol önmagában nem tudta kiváltani a BFA fenotípust. További mechanizmusokra van szükség, amelyek valószínűleg a koatomer BFA-indukálta disszociációját jelentik a Golgi-membránoktól, szükségesek a Golgi-megbontáshoz.
A Coatomer és a NAD + -függő mechanizmusok szerepe a Golgi szétszerelésében
A Golgi-apparátus bonyolultsága ellenére nagyon dinamikus organelle, amelyet a BFA gyors és visszafordítható hatásai mutatnak be a legdrámaibban. Ez a tanulmány azt sugallja, hogy a NAD + és az ADP-ribosiláció új tényezők a Golgi-komplex szerkezetét és különösen a BFA-val szembeni tubuláris-retikuláris transzformációját vezérlő gépezetben. Új kérdéseket vet fel a NAD + -függő szabályozás jelentőségével ezen organella fiziológiájában, valamint az ADP-ribosilációs fehérje szubsztrátok pontos szerepével (szerepeivel) kapcsolatban.
- Az elhízás kezelése a foglalkozási terapeuták szerepe Scandinavian Journal of Occupational Therapy
- Sikeres fogyás fenntartása A súlykontroll regiszterek szisztematikus felülvizsgálata - Paixão - 2020
- A gyermeki elhízás csökkentése Az úszás szerepe
- Renee Dhyani, hogy elveszített egy szerepet, mert lefogyott Több műsor lesz és
- Szilícium A posztmenopauzás megelőzésében és kezelésében játszott potenciális szerepének áttekintése