A nagy molekulatömegű növényi poliszacharidok (Panavir®) vírusellenes hatása ☆
Tatiana S. Kalinina
egy V.V. Zakusov RAMS Farmakológiai Intézet, Oroszország
Dmitrij V. Zlenko
b M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
d N.N. Szemenovi Szövetségi Kémiai Fizikai Kutatóközpont, Orosz Tudományos Akadémia, Moszkva, Oroszország
Aleksei V. Kiselev
d N.N. Szemenovi Szövetségi Kémiai Fizikai Kutatóközpont, Orosz Tudományos Akadémia, Moszkva, Oroszország
Litván A. Litvin
c Szövetségi Fizikai-Kémiai Orvostudományi Kutatási és Klinikai Központ FMBA, Oroszország
Szergej V. Stovbun
d N.N. Szemenovi Szövetségi Kémiai Fizikai Kutatóközpont, Orosz Tudományos Akadémia, Moszkva, Oroszország
Absztrakt
Ez a rövid jelentés a Panavir® immunmoduláló szer széles antivirális és antibakteriális aktivitásának leírásával foglalkozik. A Panavir® a Solanum tuberosum hajtásaiból kivont poliszacharidok nagy molekulatömegű frakciója. Sok vírustípus, köztük az állati koronavírus és a bakteriális fertőzések elleni aktivitást mutat. Ezek a tulajdonságok nagyon ígéretesnek tűnnek, figyelembe véve a COVID-19 járványt, és lehetővé teszik azt a javaslatot, hogy a Panavir® hatékony legyen a SARS-CoV-2 fertőzés kezelésében.
1. Bemutatkozás
A Panavir® a Solanum tuberosum (burgonya) hajtásokból kivont poliszacharidok nagy molekulatömegű frakciója. A Panavir® kémiai összetétele meglehetősen változó: glükóz (10–67%), galaktóz (2–27%), arabinóz (3–15%), ramnóz (2–10%), mannóz (0,1–5%), és xilóz (0,1–3%). Ezenkívül tartalmaz néhány uronsavat (2–5%), nyomokban lipideket, valamint peptideket és fehérjéket, elsősorban RuBisCo-t (összesen kevesebb, mint 1%). A jódszínezés hiánya a hexózpolimerek térhálósodását jelzi, ami megakadályozza a jellegzetes kék színezéshez szükséges csatornatípusú klatrátok képződését [1].
PH 7-nél és 36 ° C hőmérsékleten a Panavir® oldhatósága 100 g-onként 13 g. A Panavir® oldat a monodiszperz kolloid rendszer, amely a gömb alakú részecskékből áll. A részecskék zéta-potenciálja negatív volt, és körülbelül -25 mV. Az ultrahangos akusztikai spektrális elemzés szerint az átlagos részecskék átmérője körülbelül 140 nm, míg a DLS vizsgálat eredményei szerint körülbelül 350 nm. Az oldat szárítása után visszamaradó anyag EM-vizsgálata körülbelül 250 nm-es becslést eredményezett. Ezeknek a részecskéknek az átlagos molekulatömege 3 · 10 9 Da volt [1, 2].
2. Módszerek
2.1. Vírusellenes aktivitás
A visszatérő nemi herpesz elleni hatást olyan felnőtt nőknél becsülték meg, akik olyan jellegzetes herpesz tünetekben szenvednek, mint fájdalom, égő érzés és viszketés (ALS-MED orvosi központ, Szentpétervár). A kísérleti csoport 33 nőből állt, míg csak 20 nő volt a kontrollban. A diagnózist PCR-rel igazolták. A Panavir®-t bőrkenőcs (2 mg/100 g gél) és intravénás injekciók (0,004% -os oldat, napi 5 ml naponta egyszer) formájában alkalmazták 14 napon keresztül [6].
A kullancs által okozott encephalitis elleni hatást egerekben és emberben vizsgálták. A 10–12 g-os fehér kinőtt egereket (mindegyik csoportban 24 minta) megfertőztük az encephalitis vírus Sofin törzsével (a fertőzött egerek 10% -os agyszuszpenziójának hipodermikus injekciója), és a fertőzés után 24 és 72 órával Panavir®-vel kezeltük. (0,01 mg/1 g élő tömeg, intravénásán). A vírusrészecskék koncentrációját a fertőzött egerek agyában az agyszuszpenzió disznóvese sejtvonalon (SPEV) való fertőződésével értékeltük. A kezdeti szuszpenziót egymás után 10-szer hígítottuk, és sejtkultúrában teszteltük. A vírus elleni antitestek koncentrációját a szérum azon képességével is értékelték, hogy semlegesíti a vírust, és megakadályozza ugyanazon SPEV sejtek fertőzését.
Emberben a Panavir® kullancs által okozott encephalitis elleni aktivitását olyan betegeknél vizsgálták (30 ember a kísérleti csoportban és 113 a kontrollban), akik a szindróma akut (lázas) stádiumában szenvedtek, specifikus immunglobulinnal kezelték, és elbocsátották őket. De néhány hónap múlva fejfájással, adynamiaval és hyporeflexiával tért vissza. A leukocita csoportosítás a Diagno-Tex (Moszkva) cégtől kapott monoklonális antitestek felhasználásával történt. Az interferonok koncentrációját a Vector-Best (Szentpétervár) specifikus tesztkészleteivel mértük [10]. A Panavir®-t 5 ml 0,004% -os oldat intravénás injekció formájában, 18 órás időközökkel elválasztva (fa idők).
A Panavir® rhabdovírusfertőzés elleni aktivitását egereken, tengerimalacokban és kutyákban igazolták. Egerekben a fertőzést az intramuszkulárisan injektált rabdovírus ERA-CB-20 M törzse indukálta (0,1 ml 3% -os agyi szuszpenziót kaptunk a fertőzött egerekből). A kísérleti és a kontrollcsoportban 20 fehér tenyészállat volt (egyenként 12–13 g). A Panavir®-t (egérenként 0,04–4 μg) intramuszkulárisan (közvetlenül a fertőzés kapujába) vagy hasi úton ötször alkalmaztuk: 2 órával a fertőzés előtt, majd négyszer 48 órás intervallummal. A kontroll egerek ugyanolyan térfogatú sóoldatot kaptak. Az anti-rhabdovírus antitestek koncentrációját immunhisztokémiai úton mértük a BIO-RAD kit segítségével.
Az influenza A vírus elleni hatást in vitro, MDCK sejttenyészetben és fiatal, fehér, külsejű egerekben (9–11 g) igazolták. Az MDCK sejttenyészetet a vírus szuszpenzióval (A/WSN/1933 törzs, H1N1 altípus) fertőztük 0,01-10 ID50 dózisonként sejtenként. A Panavir®-t 12 órával a fertőzés előtt, vagy 6 órával a fertőzés után alkalmazták (10, 100, 500 és 1000 μg/ml). A vírusproliferációs aktivitást a víruskoncentrációval szabályoztuk a táptalajban 24 órával a fertőzés után. Az egereket intranazálisan fertőztük Aichi H3N2 2/68 influenza A vírus törzzsel. A Panavir®-t intravénásán alkalmaztuk (0,2 mg/egér, 24 és 96 órával a fertőzés után) [9].
Becsültük a Forvet® (a Panavir® állati analógja) aktivitását macskák koronavírusfertőzésével szemben. Vizsgálatot végeztek azon 22 kitenyésztett hajléktalan macskán, amelyeknél a koronavírus fertőzést PCR-rel igazolták. Tizenhat macskát kezeltünk Forvet®-val (1 ml 0,005% -os oldat hipodermikusan), ötször egy napos intervallummal, és egy hét múlva megismételtük a tanfolyamot. Hat macskát használtunk kontrollcsoportként. A kezelés hatását az anti-coronavirus antitestek koncentrációja szabályozta a vérben a Forvet® alkalmazása után egy és öt hónappal. Az antitestek koncentrációját immunhisztokémiai készlettel értékeltük, amelyet macskák fertőző peritonitisének diagnosztizálására terveztünk (VetBioChim, Oroszország) [12].
2.2. Antibakteriális aktivitás
A Panavir® bakteriális fertőzések elleni védő aktivitását a Klebsiella pneumoniae vagy a Shigella flexneri 516 által fertőzött fehér külsejű egerek fiatal (18–20 g) hímjeinél vizsgálták; valamint a fehér, túlnövekedett patkányok fiatal (190–230 g) nőstényein, akiknek székletüregi peritonitisük van. A kísérleti csoportba tartozó egereket (20 állat/készlet) kétszer kezeltük a Panavir®-rel (0,4 ml 0,004% -os oldat hasi úton): a kísérlet első és második napján (a fertőzés után). A kísérleti csoportba tartozó patkányokat (készletenként 10 állatot) csak egyszer kezeltünk Panavir®-rel (0,4 ml 0,004% -os oldat/100 g élő tömeg, hasi úton), 4 órával a fertőzés előtt. A kontrollcsoportban lévő egereket és patkányokat ugyanolyan térfogatú sóoldattal kezeltük, mint a kísérleti állatokat. Az egereket 4 órával a Panavir® vagy sóoldat második hasi injekciója után fertőztük meg. A K. pneumoniae sejtek szuszpenzióját intravénásán injektálták (
Egérenként 10 4 CFU), míg Sh. a flexneri sejteket hasi injekcióval (
Egérenként 5 · 10 8 CFU). Patkányok hashártyagyulladását 20% széklet-szuszpenzió hasi injekciójával indukálták (0,4 ml/100 g élő tömeg).
3. Eredmények
3.1. Vírusellenes aktivitás
A Panavir® kimutatta az embernél a kiújuló genitális herpesz elleni kiemelkedő hatást. A 30 fős kísérleti csoportban (113 a kontrollcsoportban) a tünetek enyhülését 2,3 ± 0,1 nap elteltével figyelték meg, míg az eróziós fókuszok epithelializációja a kezelés kezdete óta 5,4 ± 0,1 nap elteltével valósult meg. A kontroll csoportban az enyhülést 3,8 ± 0,2 nap múlva regisztrálták, az epithelializációt pedig csak 8,9 ± 1,1 nap múlva [6].
A Panavir® kimagasló pozitív hatást mutatott a kullancs által okozott encephalitis ellen. A kísérleti csoportban az egerek 30 ± 5% -kal jobb túlélést mutattak, mint a kontroll csoportban. A Panavir®-vel kezelt egerek agyában a vírusrészecskék koncentrációja szignifikánsan (2,5–3,0 lg) alacsonyabb volt, mint a kontroll csoportban. A fejfájás és a szédülés enyhülésének statisztikailag szignifikáns gyorsulását okozta, emellett a limfociták mennyiségének (CD3 +, CD4 +, CD8 + és CD16 + sejtek), valamint a 2α és γ interferonok koncentrációjának növekedését is kényszerítette. 10].
A Panavir® rhabdovírusfertőzés elleni aktivitását egereken, tengerimalacokban és kutyákban igazolták. A Panavir® intramuszkuláris alkalmazása a fertőzés portálján elősegítette a morbiditás arányának jelentős csökkenését (35–45%), a túlélés növekedését (30–40%) és az anti- rhabdovírus antitestek az életben maradt egerek agyában és vérében. A hasi alkalmazás nem volt hatékony [11].
In vitro a Panavir® meglehetősen nagy koncentrációban (0,5–1,0 mg/ml) mutatta be az influenza A vírus elleni hatást. Ennél a koncentrációnál és a masszív fertőzésnél (sejtenként 10 ID50) a vírusrészecskék koncentrációja a táptalajban kétszer-négyszer kisebb volt, mint a kontroll tenyészetben. A hatás a gyógyszer előzetes alkalmazása esetén volt hangsúlyosabb. Egerekben a Panavir® 25% -kal növelte a túlélhetőséget (55-ről 70% -ra), míg az elhullott állatok átlagos élettartama 11,0 ± 0,3-ról 13,0 ± 0,6 napra nőtt [9].
A Panavir®/Forvet® kimutatta a macskák koronavírus-fertőzésének kiemelkedő hatását. Hat kísérleti macskából három halt meg a kísérlet kezdete óta öt hónapon belül, és a 16 macskából csak egy halt meg a kísérleti csoportban. A kísérleti csoportban a koronavírus elleni antitestek koncentrációja a kezelés óta eltelt egy és öt hónap elteltével 4,8 ± 0,8 és 3,3 ± 0,6-szor csökkent, míg a kontrollcsoportban az antitestek koncentrációja nem változott a kezelés első hónapjában. kísérlet, és csak 1,5 ± 0,6 csökkenés öt hónap után (túlélő állatoknál) [12].
3.2. A bakteriális fertőzések elleni aktivitás
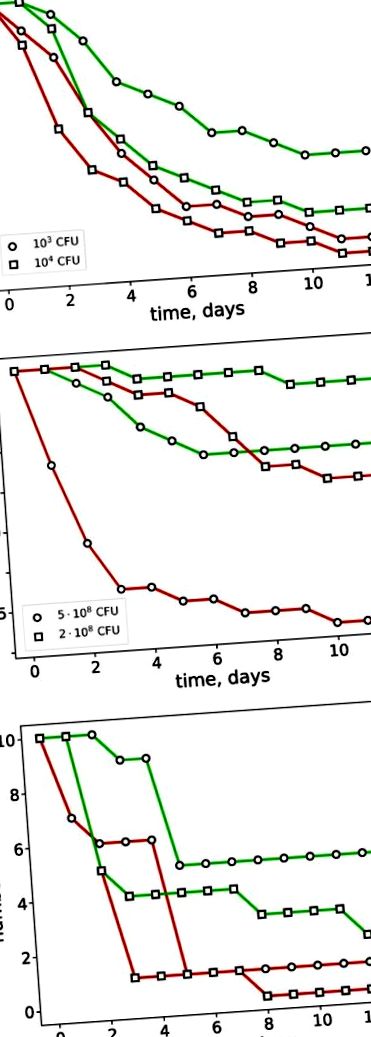
Eredményeink szerint a Panavir® szignifikánsan megnövelte az állatok túlélését, kitéve a fertőző ágensek halálos dózisának közelében. A tüdőgyulladás modelljében a Panavir® a 12 napos túlélhetőség négyszeres növekedését okozta (1. ábra A): 10-ről 40% -ra (103 CFU/egér) és 5-ről 20% -ra (104 CFU/egér) ). A bakteriális peritonitis modelljében a Panavir® is jelentős védőhatást mutatott. Masszív fertőzés (5-10 8 CFU/egér) esetén a mortalitás 85-ről 30% -ra csökkent, míg enyhébb körülmények között (2,10 8 CFU/egér) a mortalitás 40-ről 10% -ra csökkent (1. ábra B) . Hasonló hatást értek el a patkányok székletének peritonitisében (1. ábra C). A kontroll csoportban a széklet peritonitis 14 napos mortalitása ugyanolyan magas volt, mint 90–100%, míg a Panavir® alkalmazása ezt az értéket 50–80% -ra csökkentette. Ezért a Panavir® hasi alkalmazása hatékonnyá vált a magas mortalitású fertőzések ellen, függetlenül a fertőzés előtti vagy utáni alkalmazástól.
A Klebsiella pneumoniae (A) vagy a Shigella flexneri (B) által fertőzött egerek és a fekális peritonitisben (C) szenvedő patkányok mortalitásának dinamikája. A kísérleti csoportokat (zöld görbék) Panavir®-rel kezeltük, míg a kontrollt (piros görbék) nem. A C-ben két független kísérlet eredményeit mutatjuk be.
4. Következtetés
Rövid jelentésünk végén szeretnénk leírni első tapasztalatainkat a Panavir® SARS-CoV-2 fertőzés elleni alkalmazásában. Mostanra már csak tizenkét (22–56 éves) alanyunk van, akik szenvedtek a COVID-19 súlyos formájától, beismerték a Panavir®-t és sikeresen felépültek. A kezelési menetrend a következőket tartalmazta: 1. Öt intravénás Panavir® injekció (5 ml 0,004% -os oldat), három 24 órás, majd további kettő 48 órás intervallummal; 2. Azitromicin, 500 mg naponta kétszer, három napig az első három Panavir® injekció után, majd 500 mg naponta egyszer további három napig. Az összes alany a Panavir® első injekció beadása után tíz napon belül teljesen felépült. Tisztában vagyunk azzal, hogy a Panavir® anti-COVID-19 aktivitására vonatkozó jelenlegi statisztikák nem elégségesek, de úgy érezzük, hogy tapasztalatainkat mindenki számára hallani kell.
A szerzők nyilatkozata
Tatiana S. Kalinina: Vizsgálat, konceptualizáció, írás - eredeti tervezet. Dmitrij V. Zlenko: Érvényesítés, írás - eredeti vázlat, írás - áttekintés és szerkesztés, megjelenítés. Aleksei V. Kiselev: Vizsgálat. Litván A. Litvin: Vizsgálat. Szergej V. Stovbun: Koncepcionálás, validálás, írás - eredeti tervezet, felügyelet, projekt adminisztráció, finanszírozás megszerzése.
Lábjegyzetek
☆ A munka az állami feladat részeként készült el (téma száma AAAA-A20-120013190076-0).
- A Bell Peppers fokozza az anyagcserét, az aktivitást, a növényi gyógyszerek testzsír-folyóiratát
- Viselkedésmódosítás és tevékenység - Elhízás elleni akció koalíció
- Minden tevékenység
- A fizikai aktivitás előnyei A fizikai aktivitás CDC
- 10 hetes testmozgás program hipertóniás, elhízott felnőttek számára - Physiopedia