A nyugati étrend hatása az egerek agyi lipidösszetételére
- Ez a cikk frissült
- A cikk javítását a Nutrition & Metabolism 2020 17: 30-ban tették közzé
Absztrakt
Háttér
Az agyi lipidek megfelelő zsírsavösszetétele kritikus fontosságú e szerv működéséhez. Az agy zsírsav-összetételének megváltozása neurológiai és neurodegeneratív betegségekhez vezethet.
Mód
A munka célja az volt, hogy értékelje a magas zsírtartalmú nyugati étrend hatását az agyi lipidek zsírsav-összetételére. Ebben a vizsgálatban 19 hétig magas zsírtartalmú étrendet (HFD) táplált egereket használtunk. Az agyi lipideket SPE extrakcióval választottuk el, és a zsír- és zsírsav-összetételeket a chow, az egér szérumában, az agyban és más szövetekben GC-MS módszerrel elemeztük.
Eredmények
Az egerek testtömege és zsírszöveti súlya a HFD után jelentősen megnőtt. A legtöbb zsírsav koncentrációja az egerek szérumában a HFD után megnövekedett, mivel magasabb az élelmiszerből történő szállítás. Váratlanul alacsonyabb volt a szérum eikozapentaénsav (EPA) koncentrációja egerekben a HFD után, mint a kontrollokban. Az agy és más szövetek EPA-tartalma is alacsonyabb volt. A vizsgált agyi lipidcsoportok között az EPA szignifikánsan csökkent a foszfolipidekben és a szfingolipidekben.
Következtetések
Figyelembe véve az agy EPA fontos szerepét, beleértve a sejtmembrán lipidek megfelelő összetételének és gyulladáscsökkentő tulajdonságainak fenntartását, arra a következtetésre jutunk, hogy az agy EPA csökkenése a nyugati étrend után károsíthatja az agy működését.
Háttér
A nyugati étrendet az n-3 többszörösen telítetlen zsírsavak (PUFA) csökkent bevitele, a magas telített FA-k és az n-6 PUFA bevitele, valamint a finomított cukor magas szintje és a só túlzott felhasználása jellemzi [1]. A fent említett tényezők hozzájárulnak az elhízás járványához, amely a világ egyik legnagyobb közegészségügyi problémája [2]. Az Egyesült Államokban három felnőttből több mint kettő elhízott vagy túlsúlyos [3, 4]. A nyugati étrend számos negatív hatása egyike a megnövekedett rákos megbetegedéseknek, a megnövekedett gyulladásnak, a fertőzések csökkentett kontrolljának, valamint az allergiás és auto-gyulladásos betegségek fokozott kockázatának. Lenyűgöző módon néhány rossz étkezési magatartásunk genetikai háttérrel rendelkezik, és átkerül utódainkhoz [5].
Anyagok és metódusok
Munkánk célja a magas zsírtartalmú étrenddel etetett egerek agyában és más szerveiben a többszörösen telítetlen zsírsavszint meghatározása volt, ami egyenértékű az emberi nyugati étrenddel.
A Gdanski Orvostudományi Egyetem, a Tri-City Animal Laboratory Research and Service Center huszonhat hetes C57BL/6 egerét véletlenszerűen két kísérleti csoportba soroltuk (átlagos testtömeg: 21,8 g). Minden egérnek külön jelölése volt. Az első csoport normál étrendet kapott, amely 10% zsírt tartalmazott (Altromin, ME 14,6 MJ/kg), míg a második csoportba tartozó egereket magas zsírtartalmú étrendben, 60% zsírt tartalmazó táplálékkal (Altromin, ME 21,1 MJ/kg). Az állatokat 18 hétig poliszulfonketrecekben tartottuk 22 ± 2 ° C hőmérsékletű, 55 ± 10% páratartalmú, 12 órás sötét-fény ciklusban, óránként 12-szer vagy többször cserélve a levegőt. Az egereket ad libitum etették, és szabadon hozzáférhettek a vízhez. A testsúlyt és a takarmányfelvételt hetente mértük. A kísérlet végén egereket feláldoztunk, és vért, valamint agy-, máj-, vese-, izom- és szubkután, epididymális és retroperitoneális zsírszövetmintákat gyűjtöttünk. A vért 3000 x g-vel 15 percig 4 ° C-on centrifugáltuk, és a szérumot -80 ° C-on tároltuk. A szövetmintákat folyékony nitrogénben azonnal lefagyasztották, és az elemzésig -80 ° C-on tárolták.
Lipidek elemzése
A minta előkészítése
A teljes lipidek kivonását a szövetekből és a szérumból kloroform: metanol (2: 1, v/v) elegyével hajtottuk végre, Folch és mtsai. [26], a kloroformos fázist összegyűjtjük és nitrogénáram alatt szárítjuk. Ezután a lipidkivonatokat két részre osztottuk: az SPE extrakcióhoz és a zsírsavak (FA) profiljának elemzéséhez az összes lipidmintából.
SPE kitermelés
A szövetmintákat két eljárás szerint frakcionáltuk, amelyek különböztek az összegyűjtött lipidfrakciók tekintetében. I. eljárás, Kaluzny et al. [27] szabad zsírsavakat (FFA), poláros lipideket/foszfolipideket (PL) és acil-glicerineket (AG) eredményezett. Röviden, 2 mg szövetkivonatot készítettünk Folch és mtsai. [26] módszert kloroformban oldottuk és aminopropil patronokra (Strata® NH2 500 mg, Phenomenex®) töltöttük fel, 4 ml diklór-metánnal előkezelve. n-hexán. Ezután a lipideket a következőképpen eluáljuk: 6 ml kloroform: izopropanol (2: 1, v/v) - semleges lipidek (NL), 6 ml dietil-éter: ecetsav (98: 2, v/v) - FFA, 6 ml metanol - PL. Ezeket a frakciókat mentettük és szárazra pároltuk. Ezután NL-t helyreállítottuk n-hexánt és másodlagos aminopropil patronra töltjük a fent leírtak szerint. Ezt követően az oszlopot 6 ml-rel eluáljuk n-hexán - koleszteril-észterek, eldobva, 9 ml dietil-éter: metilén-klorid:n-hexán (1:10:89, v/v/v) - triacil-glicerin (TAG), 18 ml etil-acetát:n-hexán (5:95, v/v) - koleszterin, eldobott, 6 ml etil-acetát:n-hexán (15:85, v/v) - diacil-glicerin (DAG) és 6 ml kloroform: metanol (2: 2, v/v) - monoacil-glicerin (MAG). Az acilglicerin (AG) frakciókat egyesítjük és nitrogénáram alatt szárítjuk.
A II. Eljárás követte Bodennec et al. [28] módszer. 1,5 mg szövetkivonatot készítettünk Folch és mtsai. A módszert kloroformban oldottuk fel, és 5 ml-rel előkondicionált aminopropil patronokra (Strata® NH2 500 mg Phenomenex®) töltöttük. n-hexán. Ezután a mintákat 5 ml etil-acetáttal eluáljuk:n-hexán (15:85, v/v) - semleges lipidek ceramidok (Cer), MAG és FFA nélkül, 4 ml kloroform: metanol (23: 1 v/v) - Cer, 3 ml diizopropil-éter: ecetsav (98: 5), v/v) - FFA és α-hidroxi-FFA (α-OH-FFA), 11 ml aceton: metanol (9: 1,35 v/v) - glikoszfingolipidek (GSPL) és kloroform: metanol (2: 1, v/v) v) - szfingomielinek (SM). Az eluátumokat szárazra pároljuk.
Hidrolízis lépés
Az I. és II. SPE eljárásokból nyert mintákat, valamint az összes lipidmintát ezután 1 ml 0,5 M KOH-dal metanolban 90 ° C-on 3 órán át hidrolizáljuk. Ezt követően az elegyet 0,2 ml 6 M sósavval megsavanyítottuk. Ezután 1 ml vizet adunk hozzá, és az FA-t háromszor extraháljuk 1 ml vízzel n-hexánt és nitrogénáram alatt szárítjuk.
GC-MS elemzés
A hidrolízist követően az FA-t 10% -os bór-trifluorid-metanol oldattal 55 ° C-on derivatizáltuk FA-metil-észterek (FAME) előállítása céljából. 1,5 óra múlva 1 ml vizet adunk az elegyhez, és a FAME-t háromszor extraháljuk 1 ml vízzel n-hexánt és nitrogénáram alatt szárítjuk. Az elkészített FAME-t GC-EI-MS QP-2010SE-vel (Shimadzu, Japán) elemeztük. A FAME szétválasztást Zebron ZB-5MSi kapilláris oszlopon hajtottuk végre (30 m hosszúság × 0,25 mm i.d. × 0,25 μm filmvastagság). A GC kemence hőmérsékletét 60–300 ° C-ra (4 ° C/perc) állítottuk be, a teljes futási idő 60 perc volt. Héliumot használtunk hordozógázként, az oszlop feje nyomása 100 kPa. A tömegspektrometriás detektálást 70-eV feszültségen működő elektronütközési forrás segítségével végeztük. A tömegspektrum-felvételt teljes pásztázási üzemmóddal, m/z 45–700 tömegszkennelési tartományban végeztük. Belső standardként 19-metil-raud-savat használtunk. Az FA-t referencia standardok (37 FAME Mix, Sigma-Aldrich) és a NIST 2011 referencia könyvtár segítségével azonosították.
Statisztikai analízis
A normálisan elosztott adatokhoz az átlagok közötti különbségek statisztikai szignifikanciáját paraméteres (Student's T) alkalmazásával becsültük meg, míg a normális eloszlás nélküli adatokat nem paraméteres (U Mann-Whitney, Wilcoxon) tesztekkel elemeztük. Az adatokat átlag ± SD-ként adjuk meg. Az összes számítást a Sigma-Plot 11 szoftverrel hajtottuk végre (Systat Software, Inc., 2008).
Eredmények
Elhízás kiváltása HFD-vel
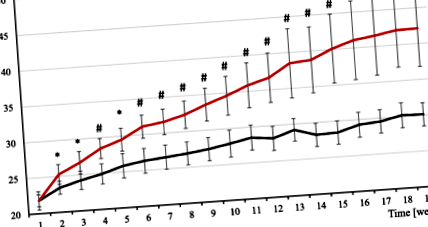
Az egerek HFD-vel történő kezelése (60% zsírt tartalmaz) 19 héten keresztül a testtömeg jelentős növekedését eredményezte, összehasonlítva a 10% zsírtartalmú laboratóriumi egerek (SD) normál étrendjével etetett kontrollokkal (1. ábra). A statisztikailag szignifikáns különbséget a kezelés második hónapjától kezdve láthattuk (1. ábra). 19 hetes kísérlet után a HFD egerek átlagos testtömegének körülbelül 30% -os növekedését figyeltük meg (1. táblázat). Az agy, a szív és a máj tömegében nem történt jelentős változás, azonban a HFD egerekben megfigyelhető a nem nagyobb statisztikai tendencia a máj nagyobb tömegére (1. táblázat). Az összes zsírszövet (AT) depó sokkal nehezebb volt a HFD egerekben, mint a kontrollokban, és a vese súlya is szignifikánsan magasabb volt (1. táblázat).
A HFD hatása a szérum és a kiválasztott egérszervek FA-tartalmára
Az összes n-3 PUFA (az EPA kivételével), valamint az n-6 PUFA koncentrációja magasabb vagy hasonló volt a HFD egerek szérumában, összehasonlítva a kontrollokkal (2. táblázat), ami valószínűleg az egyes PUFA magasabb tartalmával jár együtt a magas zsírtartalmú chow (2. táblázat). Meglepő módon az EPA koncentrációjának kétszeres csökkenését figyeltük meg a HFD egerek szérumában, annak ellenére, hogy mind a kontroll egerek, mind az indukált elhízással rendelkező egerek olyan étrendet fogyasztottak, amelyek étrendjükben az összes n-3 PUFA azonos arányát tartalmazták. Az n-3 PUFA magasabb volt a magas zsírtartalmú chow-ban (2. táblázat). Szintén alacsonyabb EPA-koncentrációkat mutattak ki, mint a DHA, mind SD, mind HFD egerek szérumában (2. táblázat). A HFD egerekben az összes zsírsav majdnem kétszerese volt, mint az SD csoportban (2. ábra).
Az EPA-tartalom legnagyobb statisztikailag szignifikáns különbségét a májban figyelték meg, és három zsírszövet-depóban is jelentősek voltak (2. táblázat). A szérum telített zsírsavak (SFA) szintje magasabb volt a HFD egerekben, míg az egyszeresen telítetlen zsírsavak (MUFA) különbsége statisztikailag nem volt szignifikáns (2. táblázat). Sőt, az SFA tartalma szignifikánsan alacsonyabb volt a retroperitoneális és a szubkután zsírszövetben, míg a MUFA alacsonyabb volt az epididymális zsírszövetben, a szívben és a vesében. A többi n-3 és n-6 PUFA-tartalom nagy része megnőtt vagy nem változott a vizsgált szövetekben. Csak a dihomo-γ-linolénsav (DGLA) szintje csökkent a májizomban és az összes zsírszövetraktárban, míg az ARA-tartalom kizárólag a szubkután zsírszövetben csökkent (2. táblázat). Megfigyeltük azt is, hogy a zsírszövetekben az EPA volt a legelterjedtebb FA az n-3 PUFA között, ami a májban nem fordult elő. Valószínűleg az EPA magas koncentrációinak hatása volt a használt chow-ban (2. táblázat). A máj az FA metabolizmusának fő szerve, míg a zsírszövet főleg a keringésből veszi fel az FA-t és TAG formájában tárolja.
Az agy EPA-tartalmának megváltozása HFD-diéta után
Az egerek agyában a teljes FA-k között a leggyakoribb a DHA, amelyet az ARA követett. Az EPA lényegesen alacsonyabb mennyiségben volt jelen (2. táblázat). Az EPA tartalma több mint kétszer alacsonyabb volt a HFD-vel táplált egerek agyában, és ami a legfontosabb, ez volt az egyetlen PUFA, amely alacsonyabb volt a HFD agyában, mint SD egerekben.
A lipidek nagyon változatos vegyületcsoportok, és mindegyikük különféle funkciókat tölt be. Ezért több lipidcsoporton elválasztottuk a lipideket az egerek agyától. A lipidfrakciók szétválasztásának egyik alkalmazott kémiai eljárása Kaluzny és mtsai. [27] SPE-módszer, amely három lipidfrakció, acil-glicerin (AG), poláros lipidek/foszfolipidek (PL) és szabad/nem észterezett zsírsavak (NEFA) előállítását teszi lehetővé. A HFD egerekben az egyes lipidfrakciók százalékos aránya megváltozott az SD egerekhez képest (3. ábra). A HFD egerek agyában szignifikánsan magasabb AG-frakciót találtunk (3. ábra). A PL tartalma SD egerek agyában Kaluzny és mtsai után. [27] az elválasztás a lipidek majdnem 70% -át teszi ki, és kissé alacsonyabb volt a HFD egerek agyában, de statisztikailag nem szignifikáns (3. ábra).
Az agyi lipidek elválasztásának második módszere Bodennec és munkatársai módosítása volt. [28] módszer. E módszer alkalmazásával hat frakciót kaptunk, köztük a) semleges lipideket, b) keramidokat (Cer), c) normál és α-hidroxi szabad zsírsavakat, d) semleges glikoszfingolipideket (GSPL), e) szfingomielint (SM) és f ) szfingozin-1-foszfát, ceramid-1-foszfát és szulfatidok. Vizsgálatunkban Cerre, GSPL-re és SM-re összpontosítottunk, az agy sarkalatos funkciójának köszönhetően [29]. Jelentősen csökkent GSPL-frakciót találtunk, míg az egerek agyában a HFD után megnövekedett SM-frakció, összehasonlítva a kontrollokkal. A Cer agytartalma mindkét csoportban hasonló volt (4. ábra).
Ezután elemeztük az FA összetételét az egerek agyából származó lipidek elválasztott frakcióiban (3. táblázat). Az SD egerek agyában a lipidfrakciók közül a legmagasabb EPA-szintet a PL-frakcióban figyeltük meg, és csak ebben a frakcióban a Kaluzny et al. [27] SPE módszer az EPA tartalma statisztikailag alacsonyabb volt a HFD egerek agyában (3. táblázat). Acilglicerinekben az SDA és a HFD egerek agya között nem volt különbség az EPA-tartalomban, míg az FFA frakcióban az EPA tartalom még magasabb volt a HFD egerekben. Érdekes módon annak ellenére, hogy az EPA és a DHA az hosszú láncú n-3 PUFA-hoz tartozik, részvételük az agy bizonyos lipidfrakcióiban nagyon eltérő. A PL frakcióban a leggyakoribb PUFA a DHA volt, amely szint a HFD agyban szignifikánsan magasabb volt (3. táblázat). A GSPL és a Cer frakcióban az EPA és a DHA szintje szignifikánsan alacsonyabb volt, mint az ARA szint (3. táblázat). Továbbá, ellentétben a DHA-val és az ARA-val, mindegyik meghatározott szfingolipid (SPL) frakcióban szignifikánsan csökkent EPA-szintet figyeltünk meg a HFD egerek agyában (3. táblázat).
Vita
Az agy EPA-tartalmának megváltozása HFD-diéta után
Különleges lipidfrakció megváltozása az egerek agyában HFD-diéta után
Ebben a vizsgálatban először vizsgálták a zsírsavak, különösen a lipidfrakciók profilját a HFD-vel kezelt egerek agyában. A lipidfrakciók elválasztásának egyik alkalmazott kémiai eljárása Kaluzny és mtsai. [27] SPE módszer, amely lehetővé tette három lipidfrakció előállítását: AG, PL és FFA. Különleges lipidfrakciók részvétele HFD egerekben megváltozott az SD egerek agyához képest (3. ábra). HFD egerekben statisztikailag szignifikáns növekedést tapasztaltunk az AG frakcióban (3. ábra), amelyet főként a diacilglicerin (DAG) és a triacilglicerin (TAG) alkot [39]. Az AG megemelkedett szintje a MUFA magasabb szintjének tulajdonítható a HFD egerekben (3. táblázat). Borg és munkatársai megfigyelték az acil-glicerin megnövekedett szintjét is. [39], a HFD egerek hipotalamuszában összehasonlítva az alacsony zsírtartalmú étrenddel etetett állatokkal. A DAG mind a foszfolipidek, mind a TAG metabolizmusának terméke, és szerepet játszik az agy központi inzulinrezisztenciájának kialakulásában [39].
Az SM frakcióban domináns PUFA volt a DHA, amely jelentős szerepet játszik a lipid tutajok komponenseként jelző sejtekben [48]. A DHA nagyobb rugalmassága miatt könnyebben beépül a glikoszfingolipidek membránjába [49]. A GSPL és a Cer frakcióban az EPA és a DHA szintje szignifikánsan alacsonyabb volt, mint az ARA szint (3. táblázat). A DHA-val és az ARA-val szemben minden egyes meghatározott szfingolipid frakcióban az EPA szintjének jelentős csökkenését figyeltük meg a HFD egerek agyában (3. táblázat). Az egerek agyának HFD utáni csökkent EPA-tartalmának egyik oka a vér alacsonyabb hozzáférhetősége lehet. Ezenkívül az alacsonyabb EPA-szintek egyéb okai lehetnek az EPA részvétele az agy lipidanyagcseréjében, beleértve a β-oxidációt, a dokoszapentaénsavvá (22: 5n-3; DPA) való megnyúlást/deszaturálódást, amely a DHA elődje [50]. ]. Az EPA nemcsak a fent említett tulajdonságok miatt olyan fontos sav, hanem befolyásolja az agy működését is. A patkányagyakon végzett vizsgálatok azt mutatták, hogy az EPA megnövekszik a kérgi szövetekben, javítja a térbeli memóriát az idős patkányokban, és helyreállítja a log-termikus potenciációt [51]. A fent említett adatok arra utalnak, hogy a HFD egerek agyában az EPA csökkent szintje és a szfingolipidek hozzájárulhatnak az agy diszfunkciójához.
A PUFA/EPA változásai más egérszervekben
A zsírban elért élelmiszer-fogyasztás zsírgyarapodáshoz és megnövekedett testtömeghez vezet, különösen az olyan étrendeknél, amelyek a teljes energia több mint 30% -át tartalmazzák, mivel a zsír elhízáshoz vezet [52]. Beszámoltak azonban arról, hogy nem minden zsír obesogén, és a zsírsavprofil, nem pedig a zsírból származó energia döntő fontosságú az elhízás kialakulásában [52]. Másrészt egyes tanulmányok nem mutattak különbségeket a különféle zsírsavakat tartalmazó táplálékot fogyasztó állatok testtömeg-növekedése között [52].
Egyes szerzők a magas zsírtartalmú étrend után a TAG és az FFA megemelkedett szintjét írták le a szérum egerekben [53, 54]. A TAG és az FFA felelős az oxidatív stressz, a lipotoxicitás, a diszlipidémia, az inzulinrezisztencia és a cukorbetegség kiváltásáért [55]. Vizsgálatunk szignifikánsan megnövekedett szérum összes zsírsavat mutatott, amelyek esetleg szerepelnek mind a TAG, mind az FFA frakciókban. A lipidek túlzott mértékű lerakódása az adipocitáktól eltérő sejtekben sejtstresszhez, diszfunkcióhoz és néha apoptotikus sejthalálhoz vezet, amelyet lipotoxicitásnak neveznek. Ez a folyamat számos betegség kialakulásában vesz részt [39]. A különféle lipidek zsírsavösszetétele gyakran tükrözi az elfogyasztott élelmiszerek zsírsavösszetételét [56]. Annak ellenére, hogy az összes FA koncentrációja a magas zsírtartalmú chow-ban négyszer magasabb volt, mint a standard Chow-ban (2. táblázat), az EPA szintje szignifikánsan csökkent a szérumban és az összes elemzett HFD egér szervben (2., 3. táblázat).
Az EPA-tartalom jelentős különbségei a májban és a három zsírszövet-raktárban (2. táblázat) szintén az adiponektin szekréciójának növekedéséhez vezethetnek a zsírterületen [57], ami növelheti az elhízás társbetegségének kockázatát, beleértve a szív- és érrendszeri betegségeket és az inzulinrezisztenciát [58] . Sőt, a bevitt étrend megfelelő mennyiségű EPA megakadályozza az elhízást azáltal, hogy mitokondriális biogenezist és béta-oxidációt indukál az adipocitákban [59].
Következtetések
Vizsgálatunk kimutatta, hogy a többi PUFA-val ellentétben a nyugati étrend az egerek szérumában, agyában és más szövetekben az EPA-tartalom jelentős csökkenését okozta. Az agyban az EPA csökkenése szignifikáns volt a foszfolipidek és a szfingolipidek között, amelyek a sejtmembránok alapvető elemei. Az agyban az EPA csökkenése a HFD után ennek a vérnek a vérből való alacsonyabb rendelkezésre állásának vagy az agysejtekben más FA-vé történő átalakulásának az eredménye lehet. Az agyban csökkent EPA-szint fokozott gyulladáshoz, a sejtmembrán szerkezeti változásaihoz és ennek következtében károsodott agyműködéshez vezethet.
Az adatok és anyagok rendelkezésre állása
Az adatmegosztás nem alkalmazható erre a cikkre, mivel a jelenlegi vizsgálat során nem hoztak létre és nem elemeztek adatkészleteket.
- Az alultáplált idősek kórházi elbocsátása után a táplálkozás nyomon követésének hatása - teljes szöveg
- Az elhízás családi kórtörténetének önmagában bejelentett mértékének érvényessége Nutrition Journal Full Text
- A növények 70% fehérjét tartalmazó étrend hatása az ásványi anyagcserére és a mozgásszervi
- A rizs-gyümölcs étrend hatása a test összetételére; NEJM
- Az omega-3 zsírsavak hatása az alkoholmentes zsírmáj betegségre - Teljes szöveg megtekintése