A pajzsmirigy hormon metabolitjainak színes sokfélesége
Társított adatok
Absztrakt
Bevezetés
Juhokból és nagyobb állatokból származó pajzsmirigy-kivonatokat sikeresen adagoltak a hypothyreosis myxedematous betegek tüneteinek enyhítésére az 1890-es évek végén. Az ezzel az új terápiás sémával rendelkező tudatos orvosok megfigyelései egyértelműen jelezték a testhőmérséklet, a pulzusszám és a légzés növekedését, valamint a myxedema és a zsírszövet hatékony csökkentését a kezelt betegeknél [1]. Magnus-Levy, aki pajzsmirigy-kivonatokat táplált egy hypothyreosis myxedematous betegnek Frankfurtban, Németországban, megadta ennek a kezelésnek az első kvantitatív értékelését, figyelemmel a megnövekedett oxigénfogyasztásra és CO2-termelésre, valamint a növekvő légzési gyakoriságra, amely paraméter a következő évtizedekben arra irányította a kezelőorvosokat, hogy elkerüljék pajzsmirigyhormon (TH) mérgezés, tachycardia és túlzott testhőmérséklet [2]. 1
Az 1. online kiegészítés (az összes online kiegészítő anyagért lásd: www.karger.com/doi/10.1159/000497141) rövid összefoglalót ad a jód nyomelem felfedezése közötti hosszú történelem során elért főbb eredményekről [10], annak kulcsszerepéről mint a TH T4 és a 3,3 ′, 5-L-trijód-tironin (T3) fő kémiai alkotóeleme, különféle állati eredetű pajzsmirigy-kivonatok első jellemzése és klinikai alkalmazása, megbízható biológiai vizsgálatok létrehozása számszerűsítve hatás az oxigénfogyasztásra [14], az alapanyagcsere sebessége, a termogenezis a kísérleti állatokban, beleértve az ebihal metamorfózisát [15], és a T3, a fő tiromimetikus hormon [16, 17, 18, 19, 20, 21] receptorainak azonosításával végződik.
Ez az áttekintés az endogén metabolitok, azaz a „tironóm” biológiai funkcióját tárgyalja, amelyek enzimatikusan keletkeznek a szülő TH T4-ből. Fókuszban vannak a 3,5-T2, a Tetrac és a Triac tiromimetikailag aktív vegyületek, valamint a „hűvös” 3-T1-amin.
A TH felfedezésének kezdetétől számoltak a jód-tironinok különböző metabolitjairól, amelyek szulfáttal vagy glükuronsavval konjugáltak a 4'OH helyzetben, valamint oxidálódtak vagy metabolizálódtak az alanin-aminosav-oldalláncukon, például az ecetsavról és a TH különböző jódozási fokozatokkal, 0 és 4 között [22]. Inkonzisztens adatokról számoltak be hatékonyságuk, mechanizmusuk és hatásmódjuk, in vivo előfordulásuk, valamint fiziológiai vagy patofiziológiai jelentőségük tekintetében, nem beszélve a lehetséges farmakológiai beadásról. Az 1990-es évektől kezdve azonban következetesen biológiai hatásokról és endogén előfordulásokról is beszámoltak a 3,5-T2 esetében [23], amelyek alacsonyabb koncentrációknál úgy tűnik, hogy a mitokondriumokat célozzák meg, és a klasszikus T3 receptorhoz kötődéstől eltérő gyors és közvetlen hatást fejtenek ki. ligandum [24]. Magasabb koncentrációk esetén azonban a 3,5-T2-ről beszámoltak arról, hogy elnyomja a TSH-t és a HPT-tengelyt, a hyperthyroid állapotokhoz hasonló káros hatásokat okozhat a szívben, és szabályozza a T3-ra reagáló T3-hoz hasonló gének expresszióját [25, 26, 27].
2004-ben jelentős felfedezés történt a 3-jod-tironamin (3-T1AM), mint figyelemre méltó biológiai tulajdonságokkal rendelkező farmakológiai szer első azonosításával [28]. Ez az ornitin-dekarboxiláz (ODC) [29] és esetleg más aminosav-metabolizáló enzimek által szintetizált jódszegény biogén amin különböző állatmodellekben reverzibilisen csökkentette a testhőmérsékletet 8 ° C-kal, és negatív inotrop és kronotrop hatást mutatott a szívre, és szoros időbeli összefüggésben adva megakadályozta a kísérletileg kiváltott szívizom- és agyinfarktus elváltozásokat is [30]. E hatások kifejtéséhez azonban meglehetősen nagy farmakológiai dózisokra volt szükség, amelyek jelenleg vizsgálat alatt állnak. Több mint 100 évvel a pajzsmirigyben a hormonelv jódozott aminosavszármazékként történő kimutatása után [11, 31] sikeres kísérleteket tettek pajzsmirigy előállítására egy csészében embrionális őssejtekből és emberi indukált progenitor őssejtekből [32, 33, 34, 35], amely az elv bizonyítékaként egy egérmodellben helyreállíthatja a TH-t atyreotikus hypothyreoid egerekben. Így reálisnak tűnik a hipotireózis és a veleszületett hypothyreosis kezelésének elvárása az in vitro szaporított pajzsmirigy-tüszők átültetésével hypothyreos betegek számára a következő évtized (ek).
TH dezodináció és a kapcsolódó T4 metabolitok
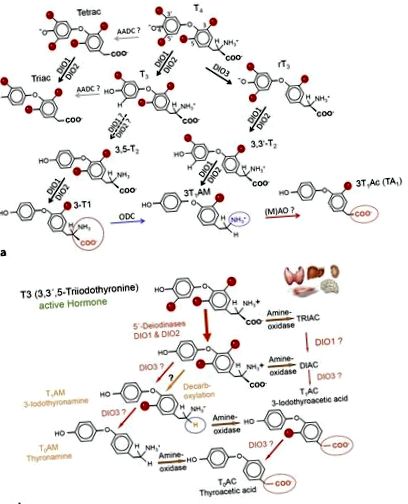
a A pajzsmirigyhormonok metabolitjai és a T4, T3 és 3-T1AM fő metabolikus útvonalai. A deodinázok (DIO), az ornitin-dekarboxiláz (ODC) és az amino-oxidázok (AO) hozzájárulnak a THM fejlődéséhez, szövet- és sejtspecifikus metabolizmusához. T4, L-tiroxin; T3, 3,3 ', 5-trijód-L-tironin; 3-T1AM, 3-jod-tironamin; DIO1, 2, 1-es és 2-es típusú jód-dinázok. b A TAM-anyagcsere sematikus nézete. A T4 és metabolitjai metabolikus reakciók kaszkádján mennek keresztül, amelyek ecetsav (TAC) és aminszármazékok (TAM) kialakulásához vezethetnek. Ezen reakciók nem minden részletét jellemezték. A szervek a vizsgált főbb szöveteket szimbolizálják és hozzájárulnak a THM kialakulásához.
Míg a 3,5-T2-hez biológiai funkciókat rendeltek, az rT3, a T4 tirozilgyűrűjén végzett reduktív jódosítás útján keletkező fő T4 metabolit szerepe, amelyet akár a dejodináz 3, akár a dejodináz 1 katalizál, jelenleg nem világos [58]. A nagyon rövid életű rT3 termelését, lebomlását és szérumkoncentrációját szigorúan ellenőrzik. Az rT3 szérumkoncentrációk növekedését különböző patofiziológiai körülmények között találták [59, 60] (online 3. kiegészítés). Az rT3 szövetet a közelmúltban vizualizálták metamorfizáló ebihalokban (online S3. Ábra), de biológiai hatásai [61, 62, 63, 64, 65, 66, 67], ha egyáltalán vannak ilyenek, pl. mint T3-antagonista továbbra is ugyanolyan ellentmondásos marad, mint más hormonok alacsony molekulatömegű metabolitjai, amelyek kölcsönhatásba lépnek a nukleáris receptorokkal (pl. szek-szteroidok, retinoidok vagy zsírsavakból származó hormonok) [22, 68, 69, 70, 71].
Az rT3 az egyik legtitokzatosabb endogén THM, amelyet már a T3 után korán kimutattak a tiroglobulin kisebb összetevőjeként [74, 75], de kromatográfiás és immunvizsgálati módszerek kidolgozása után az emberi vérben bőséges T4 metabolitként. A vér rT3-koncentrációja ekvimoláris vagy néha még magasabb is, mint az aktív T3 hormoné (1. táblázat (1. táblázat) 1), és a változások általában inverzek a T3-hoz [40, 41, 59, 72, 73, 85, 93]. Az rT3 mind a Dio1, mind a Dio2 lelkes szubsztrátja [86], amely inert 3,3′-dijód-L-tironin (3,3-T2) képződéséhez vezet [22]. Az in vitro megfigyelt Dio1 aktivitás rT3 általi gátlásának valószínűleg nincs fiziológiai jelentősége [87]. Sem a magzat placenta jodid-ellátásának forrásaként feltételezett szerepét nem erősítették meg [88], sem a sztöchiometriai megfontolások nem támasztják alá az rT3 mint jódforrás potenciális funkcióját idegen (bakteriális) fehérjék fagocitózissal összefüggő jódozásában, amelyet az aktivált dejodinázok elősegítenek. monocitákban vagy leukocitákban [39, 89, 90]. A placenta membránjai bőségesen expresszálják mind a nátrium-jodid-szimportert [91], mind a dejodinázokat [92, 93, 94].
Asztal 1
Az endogén TH-metabolitok főbb jellemzői
| T4 | T4 | prohormon, ανβ3 integrin receptor liganduma | 110 000 | [76] |
| T3 | T3 | thyromimeticus hormon, TR ligandum | 2,100 | [76] |
| rT3 | rT3 | „Inaktív” metabolit | 620; 140–320 | [76, 77] |
| 3,5-T2 | 3,5-T2 | aktív „forró” metabolit | 55; 240 nM; 150–700 | [76, 78, 79, 80] |
| 3,3′-T2 | 3,3′-T2 | inaktív | 58 | [76] |
| 3-jód-tironamin | 3T1AM | „Hűvös” pajzsmirigyhormon | 15 000 | [81] |
| Tironamin | T0AM | „Hűvös” pajzsmirigyhormon | ||
| Tetraiodo-tiroecetsav | Tetrac | antagonista az integrin receptor alfaβ3-hoz | 7,200; 115 | [76, 82, 83] |
| Trijód-tiroecetsav | Triac | tiromimetikus ligandum a T3 receptorokhoz | 2,800 | [76, 84] |
| 3-jód-tiroecetsav | TA1 | |||
| 4′-O-glükuronidok | TH-G | metabolitok a széklet eliminációjához, az enterohepatikus keringéshez | ||
| 4′-O-szulfátok | TH-S | metabolitok a vesén keresztüli eliminációhoz, az enterohepatikus keringéshez | 10–80 | [76] |
A Dio2 és Dio3 tevékenységek összehangolt tevékenységei szabályozzák a T3 helyi elérhetőségét és működését
A dezaminált ecetsav-származékok (Tetrac és Triac) endogén biológiailag aktív TH-metabolitok
Nem sokkal a klasszikus TH felfedezése után T4 és T3 jódozott aminosavszármazékként dezaminált propionsav-, ecetsav- és hangyasavszármazékok képződését bizonyították kromatográfiás módszerekkel és radioaktív jóddal jelzett TH-prekurzorokkal szubsztrátként [105, 106, 107]. . Ez azt eredményezte, hogy biológiailag aktív vegyületekként kimutatták az endogén Tetrac és Triac termékeket (pl. Golyva-megelőzési vizsgálatokban), ezen metabolitok és köztitermékeik képződését a különböző szövetekben (pl. Pajzsmirigy, máj, vese stb.) Vagy ezek kivonataiban. szubcelluláris frakciók, például mitokondrium és citozolok [7, 8, 36, 107., 108., 109., 110., 111., 112.] (a részleteket lásd a 4. online kiegészítésben).
Tetrac
Triac
A Triacot szintén primordiális bioaktív TH-ként azonosították a protochordate amphioxusban, ahol Triac, de nem T3 a jóhiszemű dejodináz szubsztrát [129] és aktív TR ligandum egy korai evolúciós kontextusban, ahol az ősi glikoproteohormon „tirostimulin”, egy TSH prekurzor szabályozza a T4-et. szintézis [130, 131].
A Triac nagy figyelmet kapott, mint egy rövid életű, de erős T3-utánzó metabolit, amely modulálja a T3 -ra reagáló gének expresszióját, némi előnyben részesítve a TRβ-kötést, beleértve néhány mutált TRβ-variánst is [124, 125, 132, 133]. A szövetszelektív célpontok között szerepel a TSH elnyomása az agyalapi mirigyben, a 14-es folt és a DIO-k indukciója a májban és más kiválasztott célszövetekben. A Triac (és a Tetrac) nem befolyásolhatja a hipotalamusz TRH-ját [119] és a szívműködését, míg a csont-, bőr-, vese- és máj-végpontok és testtömeg-paraméterek hasonlóan reagálnak a Triac-ra, de nem azonosak a klasszikus TH-kezeléssel (áttekintést lásd [84]) magyarázza visszaélését 3 [137]. A közelmúltban a szövetszelektivitás összekapcsolódott azzal a képességével, hogy megkerülje az MCT8-at THTT-ként, ami kísérleti felhasználását eredményezte mind az AHDS-szindróma állatmodelljeiben, mind a klinikai vizsgálatokban [84, 119, 121, 122, 134] (további részletekért lásd az online 4. kiegészítést), 1. táblázat, 1. táblázat és áttekintés [84]). Hogy az endogén Triacnak van-e jelentősége a sejtspecifikus TH-aktivitás szempontjából a (pato) fiziológiában, ahol megváltozott szérumkoncentrációról számoltak be [113], azt még részletesebben és továbbfejlesztett analitikai eszközökkel, például tömegspektrometriával (MS) kell megvizsgálni, amelyek kerülje a Triac keresztreaktivitás hibára hajlamos számszerűsítésének határait a T3 immunvizsgálatokban [22].
3,5-T2, egy elhanyagolt, de tiromimetikailag aktív THM
a A pajzsmirigyhormonok 3,5-T2 és 3-T1AM metabolitjainak hatása. A forró 3,5-T2 és a „hűvös” 3-T1AM jelentett metabolikus hatásainak áttekintése a kísérleti állatok kiválasztott célszöveteire (a részletekért lásd a szöveget). FA, zsírsavak; NIS, a pajzsmirigy nátrium-jodid szimportere; syst. aort. sajtó., szisztolés aorta nyomás. Az ábrát Lietzow Julika, az IEÉ tervezte. b 3,5-T2 hatások a HPT tengelyre. A 3,5-T2 elnyomja a HPT tengelyt egerekben HFD és normál étrend alatt. Már a 3,5-T2 alacsony dózisa (0,25 µg/testtömeg g) csökkenti a hipotalamusz Tshβ expresszióját és a máj és a szérum T3 tartalmát. Dio1, 1. típusú jód-jináz; HFD, magas zsírtartalmú étrend; Trh, tirotropin-felszabadító hormon; Tsh, tirotropin; Tshr, TSH receptor; SD, szokásos étrend. Az ábrát Julika Lietzow, IEÉ tervezte [25].
3,5-T2 szérumkoncentrációk
Ebben az összefüggésben nagy érdeklődésre tartanak számot a nem emlős fajok, például egyes halfajok megfigyelései [168]. A TRβ T3 receptorok két formáját azonosították genomjukban. Hosszú TRβ izoform 9 aminosav inzerttel a ligandumkötő domén elején, és egy rövidebb változat ezen inszert nélkül. Érdekes módon a 3,5-T2 megköti és aktiválja a hosszú TRβ izoformákat, míg a T3 szelektív a rövid TRβ izoformaktiválásra. Ezeknek a megfigyeléseknek az anyagcsere és a szabályozás hatása további vizsgálatokat igényel, és eddig nem azonosítottak ilyen különböző TRβ izoformákat sem emberekben, sem emlősökben [168, 169].
Az endogén THM 3-T1AM sajátos jellemzői és farmakológiai hatásai
A 3-T1AM humán szérumkoncentrációja 10–70 nM tartományban van, kemilumineszcencia immunvizsgálattal meghatározva [81]. Nem figyeltek meg nagyobb különbségeket a férfiak és a nők között, és korfüggő változásokat még nem sikerült azonosítani. Az emberi szérumban a 3-T1AM felezési ideje rendkívül hosszú. Még 6 nappal a T4 megvonása után sem figyelték meg a koncentrációk csökkenését, míg a T4 és T3 koncentrációk a várakozásoknak megfelelően csökkentek [81]. A szerzők ezt a figyelemre méltó stabilitást egy biogén amin kapcsán azzal magyarázták, hogy nagy affinitással kötődik a szérum apolipoprotein B100-hoz, amelyet a Scanlan-csoport a 3-T1AM-hoz nagyon specifikus és nagy affinitású kötő fehérjeként azonosított [178]. A szérum 3-T1AM koncentrációja nem csökkent a nem pajzsmirigy-megbetegedésekben vagy a posztoperatív pitvarfibrillációban [163], míg a kritikusan súlyos ICU-betegeknél alacsonyabb koncentrációt figyeltek meg az egészséges egyénekhez képest [164]. Az ICU túlélői és nem túlélők azonban nem különböztek szérum 3-T1AM koncentrációjukban.
Nyitott kérdések a THM kutatásban
A színes TH-metabolit sokféleség hatása a klinikai gyakorlat és a kutatás elemzési kihívásaira
A pajzsmirigyfunkciós tesztek jelenleg a TSH meghatározására koncentrálnak immunvizsgálaton alapuló módszerekkel, mint első vonalbeli biomarkerek. A TSH emelkedésétől vagy szuppressziójától függően részletesebb elemzéseket jeleznek, és a TSH mérését megismételik és kiegészítik a szabad T4 (fT4) szérumkoncentrációk meghatározásával, esetenként az fT3-t is meghatározzák. Gyermekgyógyászati klinikai praxisban gyakran részesítik előnyben a teljes T4 meghatározását, figyelembe véve a referencia-tartomány kor- és fejlettségfüggő változásait, valamint a szérummentes TH-koncentráció leolvasásával szembeni bizalmatlanságot gyermekgyógyászati betegeknél. Emellett a terhesség alatt különös figyelmet kell fordítani a trimeszter-specifikus referencia tartományokra a TH funkcióvizsgálatokhoz, amelyek a terhesség alatti fokozott TBG termeléshez és szekrécióhoz kapcsolódnak, vagy szájon át történő fogamzásgátlással társulnak [217, 218, 219, 220].
A 3. ábra a 3. ábrán szemlélteti a T4 prohormon és a fő THM közötti kvantitatív kapcsolatokat. Ez a kép azokat az analitikai problémákat kívánja szemléltetni, amelyeket a teljes T4-koncentráció (58–161 nM) hatalmas meghaladása okoz a teljes T3-hoz képest (1. táblázat). 1). Ezeket a hormonkoncentrációkat általában immunvizsgálaton alapuló módszertan határozza meg, amely szemlélteti, hogy a T4 keresztreakciója problémákat okozhat a másik THM koncentrációjának meghatározásában, ha az antitestek nem túl specifikusak. Ezen a fő kérdésen kívül a kép a szabad TH-koncentrációk pontos meghatározásának megbízhatóságával kapcsolatos óriási kihívást kívánja szemléltetni. A nagyító már megkísérli vizualizálni az fT4 koncentrációit 10-szeresére tágítva a teljes T4-hez képest, vagy 1000-szeresére tágítva az fT4 és fT3-hoz, ábrázolva az fT4 referenciaértékeit (> 10 pM 4 [224, 225]. az L-T4 gyógyszer tartalmának és összetételének minőség-ellenőrzésére alkalmazzák [226, 227].
Következtetések
Közzétételi nyilatkozat
A szerző kijelenti, hogy a felülvizsgálat tárgyával kapcsolatban nincs összeférhetetlenség, és mivel klinikailag orientált alaptudós sem a betegeket, sem a pajzsmirigyhormon-gyógyszereket gyártó vállalatokat nem tanácsolja. A szerzőnek etikai konfliktusai nincsenek.
Hivatkozások
Hivatkozásokat, kiegészítéseket és kiegészítő ábrákat lásd az online kiegészítő anyagokban.
- Pajzsmirigyhormon terápia elhízás és nem pajzsmirigy betegségek esetén szisztematikus áttekintés - PubMed
- A pillangó hatása A pajzsmirigy túlméretezett hatása az egészségére, Marina Tarasova figyelemre méltó -
- Wellbutrin a fogyás pajzsmirigy alapjaihoz
- Mit tudsz az endorfin hormonról - ZSÍR HASZLÁS
- A híres tibeti gyakorlat a pajzsmirigy kezelésére