A PIK3CA-aktiváló H1047R mutációt hordozó étrendi restrikciós rezisztens humán tumorok érzékenyek a metforminra
Sílvia Cufí
1 Anyagcsere- és rákcsoport, Transzlációs Kutatólaboratórium, Katalán Onkológiai Intézet, Girona, Katalónia (Spanyolország)
2 Girona Biomedical Research Institute (IDIBGi), Girona, Katalónia (Spanyolország)
Bruna Corominas-Faja
1 Anyagcsere- és rákcsoport, Transzlációs Kutatólaboratórium, Katalán Onkológiai Intézet, Girona, Katalónia (Spanyolország)
2 Girona Biomedical Research Institute (IDIBGi), Girona, Katalónia (Spanyolország)
Eugeni Lopez-Bonet
3 Anatómiai Patológiai Osztály, Dr. Josep Trueta Kórház, Girona, Girona, Katalónia (Spanyolország)
14 A METTEN-01 nyomozók nevében (EudraClinicalTrial Number 2011-000490-30)
Rosa Bonavia
4 Állattartó létesítmény, Bellvitge Kutatóintézet (IDIBELL), L'Hospitalet de Llobregat, Barcelona, Katalónia (Spanyolország)
Sonia Pernas
5 Orvosi Onkológiai Osztály, Emlőegység, Katalán Onkológiai Intézet-Kórház Universitari de Bellvitge-Bellvitge Kutatóintézet (IDIBELL), L'Hospitalet de Llobregat, Barcelona, Katalónia (Spanyolország)
14 A METTEN-01 nyomozók nevében (EudraClinicalTrial Number 2011-000490-30)
Isabel álvarez López
6 Orvosi Onkológiai Szolgálat, Donostia kórház, Donostia-San Sebastián, Baszkföld (Spanyolország)
14 A METTEN-01 nyomozók nevében (EudraClinicalTrial Number 2011-000490-30)
Joan Dorca
2 Girona Biomedical Research Institute (IDIBGi), Girona, Katalónia (Spanyolország)
7 Orvosi Onkológiai Osztály, Katalán Onkológiai Intézet, Girona, Katalónia (Spanyolország)
14 A METTEN-01 nyomozók nevében (EudraClinicalTrial Number 2011-000490-30)
Susana Martínez
8 Orvosi Onkológiai Osztály, Mataró Kórház, Mataró, Barcelona, Katalónia (Spanyolország)
14 A METTEN-01 nyomozók nevében (EudraClinicalTrial Number 2011-000490-30)
Norberto Batista López
9 Orvosi Onkológiai Szolgálat, Universitario de Canarias Kórház, La Laguna, Tenerife, Kanári-szigetek (Spanyolország)
14 A METTEN-01 nyomozók nevében (EudraClinicalTrial Number 2011-000490-30)
Severina Domínguez Fernández
10 Orvosi Onkológiai Szolgálat, Hospital de Txagorritxu, Vitoria-Gasteiz, Araba, Basque Conutry (Spanyolország)
14 A METTEN-01 nyomozók nevében (EudraClinicalTrial Number 2011-000490-30)
Elisabet Cuyàs
1 Anyagcsere- és rákcsoport, Transzlációs Kutatólaboratórium, Katalán Onkológiai Intézet, Girona, Katalónia (Spanyolország)
2 Girona Biomedical Research Institute (IDIBGi), Girona, Katalónia (Spanyolország)
Joana Visa
4 Állattartó létesítmény, Bellvitge Kutatóintézet (IDIBELL), L'Hospitalet de Llobregat, Barcelona, Katalónia (Spanyolország)
Eszter Rodríguez-Gallego
11 Unitat de Recerca Biomèdica (URB-CRB), Institut d'Investigació Sanitaria Pere i Virgili (IISPV), Universitat Rovira i Virgili, Reus, Katalónia (Spanyolország)
Rosa Quirantes-Piné
12 Analitikai Kémia Tanszék, Természettudományi Kar, Granadai Egyetem, Granada (Spanyolország)
Antonio Segura-Carretero
12 Analitikai Kémia Tanszék, Természettudományi Kar, Granadai Egyetem, Granada (Spanyolország)
Jorge Joven
11 Unitat de Recerca Biomèdica (URB-CRB), Institut d'Investigació Sanitaria Pere i Virgili (IISPV), Universitat Rovira i Virgili, Reus, Katalónia (Spanyolország)
Begoña Martin-Castillo
2 Girona Biomedical Research Institute (IDIBGi), Girona, Katalónia (Spanyolország)
13 Klinikai Kutatási Osztály, Katalán Onkológiai Intézet, Girona, Katalónia (Spanyolország)
14 A METTEN-01 nyomozók nevében (EudraClinicalTrial Number 2011-000490-30)
Javier A. Menendez
1 Anyagcsere- és rákcsoport, Transzlációs Kutatólaboratórium, Katalán Onkológiai Intézet, Girona, Katalónia (Spanyolország)
2 Girona Biomedical Research Institute (IDIBGi), Girona, Katalónia (Spanyolország)
14 A METTEN-01 nyomozók nevében (EudraClinicalTrial Number 2011-000490-30)
Absztrakt
BEVEZETÉS
Nemrégiben azt javasoltuk, hogy a CR/DR-nem reagáló tumorokat, amelyek aktiválják a PIK3CA onkogén mutációit, ellenőrizni kell, hogy reagálnak-e a metformin klinikailag releváns koncentrációira. Most bebizonyítottuk, hogy az inzulin-nem reagáló PIK3CA-aktiváló H1047R mutációt hordozó humán rák xenotumorok továbbra is érzékenyek a metforminra. Adataink megerősítik, hogy a metformin nem tekinthető jóhiszemű CRM-nek, legalábbis rákellenes aktivitását tekintve. Figyelembe véve az emberi rákban előforduló PIK3CA mutációk magas számát, ez a megállapítás jelentős hatással lehet a metformin alapú terápiák tervezésére, amelyek célja mind a tumor kialakulásának korai szakaszainak, mind a progresszió és a rák megismétlődésének befolyásolása előrehaladott daganatokban.
EREDMÉNYEK
A PIK3CA H1047R által mutált, DR-rezisztens MCF10DCIS.com xenotumorok nagyon érzékenyek az intraperitoneálisan (i.p.) beadott metforminra. A humán rák onkogén PIK3CA-vezérelt korai stádiumainak modellezéséhez az MCF10DCIS.com klonális emlőrák sejtvonalat alkalmaztuk, amelyet egy olyan premenignus MCF10AT sejtekből származó xenograftból nyertünk, amelyeket SCID egerekbe injektáltunk. Az MCF10DCIS.com sejtvonalról kimutatták, hogy a PI3K kináz doménjében egy missense mutáció, H1047R található. Ez a funkciógyarapodási mutáció az egyik „hot-spot” mutáció a PI3KCA gén p110α katalitikus doménjében, és ez generálja a leghatékonyabban onkogén PI3K-t, amely nagy gyakorisággal fordul elő különböző rákos megbetegedésekben. Ennél a tanulmánynál ennél is fontosabb, hogy az MCF10DCIS.com sejtek in vitro inzulin jelenlététől vagy hiányától függetlenül szaporodnak, és tumorokat képeznek, amelyek inaktívak a DR in vivo [8].
Két különböző metformin kezelési protokollt teszteltünk (n = 5 egér csoportonként). Az első eljárásban az egereket kontroll (víz) vagy metformin (250 mg kg -1) ad libitum hatásának tettük ki egy héttel a tumorsejt beoltása előtt. A vizet hetente kétszer cserélték, és folyamatosan szolgáltatták, összesen 56 napig. A második protokollban a metformint i.p. injekcióval, és az egereket naponta 200 mg kg -1 metforminnal kezeltük a sejt beoltása előtt 1 héttel. Ez az i.p. a metforminnal történő ütemtervet összesen 56 napig folytatták. A metformint mindkét kezelési módban jól tolerálták, és ez nem befolyásolta szignifikánsan az egerek súlyát (1. ábra) és az étrend-fogyasztási profilokat (az adatokat nem közöltük) a kezelés során.
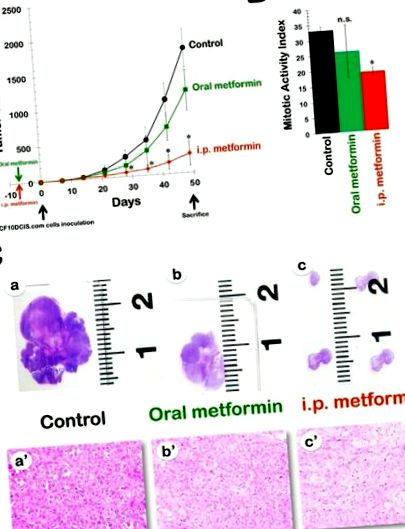
Az orális metformin hatékonysága a DR-rezisztens MCF10DCIS.com xenograft modellben. Az 1A. Ábra az 1A. Ábra mutatja a tumor növekedésének ütemét a három kezelési csoportban, az adatokat az egyes csoportok átlagos tumormennyiségének ábrázolásával az idő függvényében. A vivőanyaggal kezelt csoportba tartozó állatokkal (az xenograftolt MCF10DCIS.com daganat térfogata átlagosan 1794 ± 273 mm 3) összehasonlítva, azok az állatok, amelyek orális metforminnal kezelték a 8 hetes kezelést, kissé lassított tumor növekedést mutattak, a daganat átlagos átlagos térfogata 1186 ± 293 mm 3 (ábra (1A ábra). 1A). Azonban a kezeletlen kontrollok és az orális metforminnal kezelt xenotumorok közötti különbségek egyike sem ért el statisztikai szignifikanciát. Ezt a megállapítást jobban tükrözte az MCF10DCIS.com tumor növekedés gátlásának százalékos aránya, amelyet a következőképpen számítottunk ki: 1-kezelt/kontroll térfogat arány (1-T/C). Az orális metformin gátló hatása mérsékelt volt, a sejtek beoltását követő 4 héten belül elérte a maximum 43% -ot, és a kezelés vége felé csökken (kb. 30-35%).
metformin a DR-rezisztens MCF10DCIS.com xenograft modellben. A. Megmutatjuk az MCF10DCIS.com xenograftot hordozó meztelen egerek átlagos tumormennyiségét (± SD) szájon át (ad libitum hozzáférés a 250 mg kg -1 metformint tartalmazó vízhez) és i.p. (napi i.p. 200 mg kg -1 metformin injekciók) metformin beadása 8 hétig. A tumor növekedési sebessége szignifikánsan különbözött a kontroll és az i.p. metformin csoportok (* Student t-próbája P 3) a kezeletlen kontroll állatokban, naponta i.p. a metforminnal végzett kezelés az átlagos tumor térfogatának drámai csökkenését eredményezte 280 ± 171 mm 3 -ig (1.A ábra. 1A. ábra). Nevezetesen, az i.p. a metformin csak a sejt beoltása után 7 nappal (49%) már nagyobb volt, mint az orális metforminnal bármikor elért maximális aktivitás. Ezenkívül az i.p metformin gátló hatása időfüggő módon nőtt, és a sejt beoltása után 42 nappal a maximális 84% -ot érte el.
Az intraperitoneálisan beadott metformin jelentősen csökkenti a mitotikus aktivitást az MCF10DCIS.com rákszövetekben. Elemeztük az MCF10DCIS.com tumor xenograftokat, hogy megvizsgáljuk a metformin lehetséges proapoptotikus és/vagy anti-proliferatív hatásait; ezek a hatások szerepet játszhattak a gyógyszer átfogó daganatellenes hatékonyságában. Nem figyeltünk meg szignifikáns különbséget az apoptotikus sejtek számában a kontrolldaganatok és a két terápiás séma daganatai között (azaz orális metforminnal kezelt egerek és i.p. metforminnal kezelt egerek). Ezután összehasonlítottuk a hematoxilin és az eozin (H&E) festett paraffinba ágyazott szelvények mitotikus számát a Scarff-Bloom-Richardson hisztoprognosztikus osztályozási rendszer szerint, Elston és Ellis módosítása szerint (ábra (1B ábra). 1B). Az első protokoll esetében az MCF10DCIS.com daganatok H&E festésének mikroszkópos elemzése az orális metformin csoportban az átlagos mitotikus számok mérsékelt csökkenését (21%) mutatta (26 ± 8) a kezeletlen kontrollhoz képest (33 ± 1), de ez a különbség nem érte el a statisztikai szignifikanciát (p = 0,5). A második protokoll esetében azonban az átlagos mitotikus számok számszerűsítése statisztikailag szignifikáns (p = 0,01) 42% -os csökkenést mutatott ki a mitotikus aktivitás indexében az i.p. metformin csoport (19 ± 1) a kontroll csoporthoz képest.
Az MCF10DCIS.com karcinómák mikroszkópos megjelenése kissé megváltozott a metformin kezelés után. A szövettani vizsgálat megerősítette, hogy a kezeletlen MCF10DCIS.com daganatok olyan sejtekből álltak, amelyek citológiailag rosszindulatúnak tűntek, magas fokú magokkal, pleomorfizmussal és bőséges központi nekrózissal (azaz a 3. fokozatú invazív ductalis carcinomákkal; 1. C ábra, 1C. Ábra a és a '). Az orális metforminnal kezelt állatokban végzett MCF10DCIS.com emlő xenotumorok anatomopatológiai vizsgálata azt mutatta, hogy a daganatos szövetek rosszul differenciáltak maradtak, annak ellenére, hogy vizuálisan bizonyíték volt a daganat méretének csökkenésére (1. ábra, 1.C ábra, 1C, b és b 'panelek). Érdekes módon a nagyon kicsi MCF10DCIS.com daganatokban, amelyek napi ip metformin jelenlétében alakultak ki, a cellularitás csökkenésének szignifikáns tendenciáját figyelték meg, az extracelluláris kötőszöveti mátrix mennyiségének növekedésével együtt (1. ábra, 1C, c és c panelek ').
A metformin in vitro gátolja a PIK3CA H1047R-mutált tumorsejtek inzulinfüggetlen növekedését. Mivel a PI3K út konstitutív aktiválása arra ösztönzi az MCF10DCIS.com sejteket, hogy in vivo DR-rezisztens tumorokat képezzenek, és in vitro inzulinfüggetlen módon növekedjenek, meghatároztuk, hogy a metforminnal végzett exogén kiegészítés befolyásolja-e jelentősen a daganatos sejtek in vitro inzulinreakcióját. A DR-rezisztens MCF10DCIS.com sejtek kultúrában hasonlóan növekedtek inzulinfüggetlen módon, vagyis az inzulin nem okozta a dózisfüggő sejtszám növekedést. A metformin nem hatott inzulin-szenzibilizátorként az inzulinrezisztens PIK3CA H1047R-mutált MCF10DCIS.com sejteknél; inkább dózisfüggő módon növekedésgátlóként működött (ábra (2. ábra 2).
A. Felső. Az inzulin és/vagy a metformin növekvő koncentrációinak jelenlétében tenyésztett MCF10DCIS.com sejtek szaporodási görbéi. Az MCF10DCIS.com sejteket 24 lyukú lemezekre szélesztettük, 5000 sejt/üreg sűrűségben, és 0,1% lószérumban tenyésztettük inzulin (0, 100 és 1000 ng/ml), metformin (1 μmol/l) hiányában vagy jelenlétében., 10 μmol/L, 100 μmol/L, 1 mmol/L és 10 mmol/L), vagy az előírt inzulin és metformin kombinációja. A bemutatott adatok a három cellában készített és 0, 2, 4 és 6 nap után kapott reprezentatív kísérletből származó cellák száma × 104/üreg (± SD). Alsó. Az inzulin és/vagy a metformin növekvő koncentrációinak jelenlétében tenyésztett MCF10DCIS.com sejtek MTT felvételi görbéi. Az MCF10DCIS.com sejteket 96 lyukú lemezekre szélesztettük ~ 2000 sejt/lyuk sűrűségben, és 0,1% lószérumban tenyésztettük inzulin (0, 100 és 1000 ng/ml), metformin (1 μmol/L, 10 μmol/L, 100 μmol/L, 1 mmol/L és 10 mmol/L), vagy az előírt inzulin és metformin kombinációja. A bemutatott adatok az OD570-szeri hajtások növekedésének átlagai ± SD.
MÓD
Sejtvonalak
Az MCF10DCIS.COM sejteket az Asterand, Inc.-től (Detroit, MI, USA) szereztük be. Az X-MAN ™ izogén sejtvonalakat a Horizon Discovery Ltd-től szereztük be (http://www.horizondiscovery.com). Az X-MAN ™ SW48 PI3Kα (H1047R/+) izogén sejtvonalat, a PIK3CA kináz domén aktiváló mutáció heterozigóta bekapcsolását használtuk ebben a vizsgálatban (HD103-005). A szülői sejtvonalat, az SW48 PI3K (+/+) -ot is alkalmaztuk. A sejteket a szállítói ajánlásoknak megfelelően tartottuk fenn.
Tumor xenograft vizsgálat
Szövettan
A megfelelő időpontokban az állatokat eutanizálták, a daganatokat eltávolították és kettévágták. Az egyik felét 10% -os pufferelt formalinban rögzítettük, a másikat pedig pillanatszerűen lefagyasztottuk. A tumorszövetek apoptózisának és mitózisának értékeléséhez a formalinnal rögzített, paraffinba ágyazott xenograft szövetek metszeteit H&E.
A H&E festési protokoll alapján megfigyelhető mitotikus számokat van Diest et al. [52], némi módosítással, az alábbiak szerint: a) a maghártya hiánya, ami a profáz végét jelzi, és b) kondenzált kromoszómák jelenléte, amelyek össze vannak csoportosítva (kezdő metafázis), síkba rendeződve (metafázis vagy anafázis), vagy különálló klaszterekben (telofázis) mind egy mitotikus alaknak számít. A hiperkromatikus magokat, a fragmentált kromatint és az apoptotikus magokat figyelmen kívül hagyták. Az összes H & E-vel festett szakaszt gondosan megvizsgáltuk (nagyítás, × 400), és a mitotikus aktivitás értékeléséhez a legnagyobb proliferációt mutató szakaszt választottuk ki. A daganat szubjektíven leginkább mitotikusan aktív területéből kiindulva és az egymást követő mezők között mozogva körülbelül 10 egymást követő nagy teljesítményű mezőt (HPF) számláltunk meg egy Olympus BH-2 mikroszkóppal. Nem tettek kísérletet a számlálás maximalizálására oly mezők kiválasztásával, amelyek nagyobb számú mitotikus ábrával rendelkeznek. A mitotikus számlálást a kezelési csoport alapú immunhisztokémiai festés ismerete nélkül végeztük. A MAI aktivitásokat kétfarkú, kétmintás, egyenlő szórású Student-féle t-teszt alkalmazásával hasonlítottuk össze.
Proliferációs vizsgálat
A 0. napon a sejtvonalakat a megfelelő táptalajba oltottuk 24 üreges lemezeken, 5000 sejt/üreg sűrűségben, és az összes lemezt egy éjszakán át inkubáltuk. Az 1. napon az egyes sejtvonalak vizsgálati lemezeit kétszer mossuk normál táptalajjal, szérum hiányában, és a táptalajt kicseréljük kizárólag 0,1% szérummal, 0,1% szérummal és két különböző koncentrációjú inzulinnal kiegészített tápközeggel (100 és 1000 ng/ml), 0,1% szérumot és a metformin hét különböző koncentrációjának egyikét (10 nmol/L, 100 nmol/L, 1 μmol/L, 10 μmol/L, 100 μmol/L, 1 mmol/L és 10 mmol/l), vagy inzulin és metformin kombinációja, a specifikáció szerint. Mindegyik lemezre táptalajonként három üreg került. Minden sejtvonalhoz egy további lemezt használtunk kiindulási 0. napon a sejtek számának mérésére a vizsgálati közeg hozzáadása nélkül. A sejtszámokat a 0., a 2., a 4. és a 6. napon Coulter számlálóval (Coulter Electronics, Inc.) használtuk.
A sejtek életképességi vizsgálata
A metformin inzulin hiányában vagy jelenlétében a sejtek életképességére gyakorolt hatását standard kolorimetriás 3,4,5-dimetil-tiazol-2-il-2,5-difenil-tetrazolium-bromid (MTT) redukciós vizsgálattal határoztuk meg. Minden kezelésnél a sejtek életképességét a következő egyenlet segítségével számoltuk ki: (a kezelt minta OD570/a kezeletlen minta OD570) × 100.
Köszönetnyilvánítás
Ezt a munkát anyagilag támogatta az Instituto de Salud Carlos III (Ministerio de Sanidad y Consumo, Fondo de Investigación Sanitaria (FIS), Spanyolország, az EC10-125, CP05-00090, PI06-0778 és RD06-0020-0028 támogatások). Fundación Científica de la Asociación Española Contra el Cáncer (AECC, Spanyolország) és Ministerio de Ciencia e Innovación (SAF2009-11579 és SAF2012-38914, Plan Nacional de I + D + i, MICINN, Spanyolország). Sílvia Cufí kutatási ösztöndíjat (BES-2010-032066, Formación de Personal Investigador, FPI) kapott a Ministerio de Ciencia e Innovacióntól (MICINN, Spanyolország).
Együttműködők (METTEN-01 nyomozók):
Maria Luque Cabal (Orvosi Onkológiai Szolgálat, Central de Asturias Kórház, Oviedo, Spanyolország), César A. Rodríguez-Sánchez (Orvosi Onkológiai Szolgálat, Universitario de Salamanca Kórház, Salamanca, Spanyolország), Jose Luis Alonso Romero (Orvosi Onkológiai Osztály, Kórház Universitario Virgen de la Arrixaca, Murcia, Spanyolország), Ricardo Cubedo Cervera (Orvosi Onkológiai Osztály, Puerta de Hierro Kórház, Madrid, Spanyolország), Jose Manuel López-Vega (Orvosi Onkológiai Osztály, Hospital Universitario Marqués de Valdecilla, Santander, Spanyolország), Noelia Martínez Jáñez (Orvosi Onkológiai Osztály, Universitario Ramón y Cajal Kórház, Madrid, Spanyolország), Kepa Amillano Parraga (Orvosi Onkológiai Szolgálat, San Joan de Reus Kórház, Reus, Spanyolország).
- Diétás cukor, só és zsír az emberi egészségtudománybanDirect
- Fedezze fel az étrendi halolaj emberi bőrre gyakorolt hatásait - teljes szöveges nézet
- Diétás minták és személyre szabott táplálkozás - Jean Mayer, az USDA emberi táplálkozási kutatóközpontja
- Étrend-kiegészítők és gyulladások központja - Dél-Karolinai Orvostudományi Egyetem
- Az étrendi betartással járó tényezők a lisztérzékenységben Országos tanulmány - FullText -