A pro-opiomelanocortin gén mutációanalízise elhízott francia gyermekeknél új, káros heterozigóta mutáció azonosítására vezetett, amely az α-melanocita stimuláló hormon tartományban található
Absztrakt
Jelen tanulmányban a POMC gén mutációs elemzéséről számolunk be 322 elhízott gyermekből és 363 kontrollból álló francia kohorszban. Leírunk egy újszerű heterozigóta mutációt is a POMC gén αMSH doménjében, amely korai kezdetű elhízással és káros hatással jár in vitro funkcionális hatások.
ANYAGOK ÉS METÓDUSOK
Közvetlen POMC génszekvenálás.
Ezt a tanulmányt a helyi etikai bizottság hagyta jóvá, és minden résztvevő tértől megkapta a tájékozott beleegyezést. Valamennyi alany genomi DNS-ét 10 ml vénás teljes vérből izoláltuk (Wizard Genomic DNA Purification Kit, Promega Madison, WI). A POMC gén kódoló régiójának közvetlen szekvenálását (Sequencer Applied Biosystem) 322 rokon elhízott és 363 nem elhízott gyermeknél végeztük. Elhízott gyermekek [átlagéletkor, 12,8 év ± 2,8 szórás (SD); átlagos testtömeg-index (BMI) Z pontszám = 4,3 ± 1,2 SD; BMI Z pontszámtartomány, 2,0–10,2 SD] prospektív módon toborozták 2001 és 2004 között a gyermekgyógyászati táplálkozás három különböző részlegén, Párizsban (Caen) és a franciaországi Margency-ben [a Dubern-ben leírtak szerint] et al. (20)]. Jelen tanulmányban az elhízást BMI-ként határozták meg Z legalább 2 SD-t szerezzen Franciaországban az átlagos életkor és a nemre jellemző BMI-érték felett (21). A kontroll csoportba 363 nem elhízott gyermek került (átlagéletkor, 11,5 év ± 0,6 SD; átlagos BMI Z pontszám = 0,2 ± 1,0 SD; BMI Z pontszámtartomány, -2,96-1,93 SD). Ezek a gyerekek egy randomizált, ellenőrzött, folyamatban lévő terepi vizsgálat (ICAPS) részesei voltak a középiskola első osztályú serdülői között nyolc véletlenszerűen kiválasztott iskolában a Bas-Rhin (Kelet-Franciaország) osztályon (22).
A proband családjában a Phe144Leu POMC mutáció genotipizálását a POMC gén kódoló régióinak közvetlen szekvenálásával (Sequencer Applied Biosystem) is elvégeztük. Alapozók és feltételek kérésre rendelkezésre állnak. A nukleotidokat és az aminosavakat a GenBank V01510 és NP 000930 belépési számai szerint számoztuk.
Klinikai és biokémiai adatok.
Valamennyi elhízott betegnek fizikális vizsgálatot végeztek antropometriai mérésekkel és Tanner stádium-értékeléssel, ugyanazon kutató minden központban. A magasság és a súly görbéket az alanyok egészségügyi egészségügyi nyilvántartásából nyertük.
Humán MC4R (hMC4R) aktiváció a Phe144leu POMC αMSH termékével.
A Leu144aMSH-t (Leu az aMSH 7. pozíciójában) és a Phe144aMSH-t (Phe a 7. pozícióban) szintetizáltuk és tisztítottuk nagy teljesítményű folyadékkromatográfiával (Genemed Synthesis Inc., South San Francisco, CA). Az MC4R aktivitást a ciklikus adenozin-monofoszfát (cAMP) -indukálható luciferáz gén expressziójának aktiválására való képességének elemzésével mértük a HEK 293-ban (23). A cAMP-indukálható luciferáz gént stabilan expresszáló HEK 293 sejteket átmenetileg transzfektáltuk a hMC4R-gyel, és 6 órán keresztül stimuláltuk egyedül táptalajjal, növekvő mennyiségű Phe144aMSH vagy Leu144aMSH mennyiségével, majd a luciferáz aktivitást a korábban leírtak szerint mértük (23). Az adatpontok öt meghatározás átlagát jelentik, a hibasávok pedig az SD-ket.
Versenyképes kötési vizsgálat.
A hMC4R-rel stabilan transzfektált HEK 293 sejteket [125 I] NDP aMSH-val inkubáltuk növekvő koncentrációkban Phe144aMSH vagy Leu144aMSH jelenlétében. Az eredményeket a teljes fajlagos megkötés (Bmax) százalékában fejezzük ki. A görbe illesztése nemlineáris regresszióanalízissel és egyhelyes versenymodellel történik (GraphPad Prism, graph szoftver, San Diego, CA). Minden pont a három párhuzamos érték átlaga. A hibasávok jelzik az SD-ket.
EREDMÉNYEK
A POMC mutációk gyakorisága elhízott és sovány francia gyermekeknél, valamint a Phe144Leu POMC mutációt hordozó beteg azonosítása.
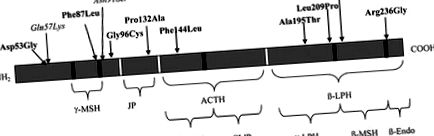
322 súlyosan elhízott gyermek POMC mutációinak szűrésével kilenc mutációt azonosítottak (Asp53Gly, Gly96Cys, Pro132Ala, Arg236Gly, Glu214Gly, Ala195Thr, Leu209Pro, Phe87Leu, Phe144Leu) 12 független egyénnél (3,72% 1,66%, 95%.). . Közülük hatról korábban nem számoltak be (Asp53Gly, Phe87Leu, Gly96Cys, Pro132Ala, Phe144Leu, Leu209Pro). A kontroll csoportban két új mutációt (Asn91Ser, Glu57Lys) egyedileg detektáltunk, míg két elhízott és kontroll populációban két mutációt (Glu214Gly, Ala195Thr) találtunk (1. táblázat és 1. ábra). Négy elhízott beteg és egy sovány kontroll volt az Asp53Gly mutáció hordozója (1,24%). Összességében a POMC génvariációk gyakorisága nem volt szignifikáns különbség az elhízottak (3,72%, 95% CI: 1,66–5,80) és a kontrollok között [2,20%, 95% CI: 0,69–3,71, o = nem szignifikáns (NS)] ebben a francia gyermekcsoportban. A POMC mutációs hordozók (elhízott és kontrollok) klinikai és biológiai jellemzőit a 2. táblázat mutatja be. Nincs különbség a tömegben és a BMI-ben Z pontszámot figyeltünk meg a POMC genetikai variáns hordozók és a nem hordozók között az elhízott és sovány csoportokban (az adatokat nem közöljük).
POMC fehérje és a változatok elhelyezkedése elhízott és sovány gyermekeknél. A fehér és fekete dobozok a PC-k kivágott helyeihez szolgálnak. Dőlt betű: csak a kontrollokban azonosított mutációk. JP, ízületi peptid; CLIP, kortikotropinszerű közbenső peptid; LPH, lipoprotein hormon; Endo, endorfin.
Mivel a legtöbb kimutatott mutáció a bizonytalan biológiai funkciójú POMC-propeptid régióiban fordult elő, tanulmányunkat a POMC-gén αMSH-t kódoló régiójában elhelyezkedő új Phe144Le heterozigóta missense mutációra koncentráltuk. A Phe144Leu mutációt csak egy elhízott gyermeknél mutatták ki, és a kontroll populációban hiányzott. A családban a mutáció szegregációs elemzése azt mutatta, hogy a mutáció az elhízott apában volt jelen (2. ábraA). A többi rendelkezésre álló családtag nem hordozta a mutációt, és nem volt sem túlsúlyos, sem elhízott.
A Phe144Leu POMC mutációs hordozó törzskönyve, genotípusa és klinikai jellemzői. (A) Törzskönyv és genotípusok. A II1 proband egy 12 éves nő, 22,5 kg/m 2 BMI-vel (BMI Z = 2,7 SD). Heterozigóta a Phe144Leu (t> c 431) mutációra. A mutált allélt közepesen elhízott édesapja továbbította (BMI, 31 kg/m 2 38 éves korban, BMI Z = 1,9 SD). I2 alanyok (BMI, 21 kg/m 2 40 éves korban, BMI Z pontszám = −0,5 SD), II2 (életkor, 8 év; BMI Z = 0,2 SD) és II3 (életkor, 6 év; BMI) Z skála = 0,9 SD) két normális allél nem obesz hordozói. Elhízott egyének (szilárd körök és négyzetek). Kor, BMI Z pontszám és genotípus (+, normál; -, mutált) a törzskönyvben szerepel; ÉN, nincs meghatározva. (B) A proband (HetPOMC), hat heterozigóta MC4R mutációs hordozó (HetMC4R) és három homozigóta null leptin receptor mutáns (LepR 1, 2, 3) BMI görbéi. HetPOMC (szilárd négyzetek); LepR 1 (szilárd körök); LepR 2 (nyitott háromszögek); LepR 3 (szilárd háromszögek); HetMC4R (nyitott gyémántok).
A phe144leu mutációs hordozó klinikai és biológiai fenotípusa.
Az endokrin és metabolikus kutatások a probandumban csak mérsékelt hiperinsulinémiát mutattak ki 16,9 μUI/ml plazma inzulinszinttel 120 perccel normál glükózszint mellett történő glükóz bevétele után (3. táblázat). A hipotalamusz-hipofízis-mellékvese tengelyfeltárások normálisak voltak (vizeletmentes kortizol, a mellékvese tengelyének dinamikus tesztje), valamint a pajzsmirigy tengelyének feltárása (szabad T4 és TSH) (3. táblázat). A keringő leptin mérése (leptin 20 ng/ml) megegyezett a test testével (leptin/kg zsírtömeg, 1,1). A lipid metabolizmus nem volt figyelemre méltó (összkoleszterin, 1,7 g/l; triacil-glicerin, 0,9 mM). 12 éves korában a nyugalmi anyagcsere sebessége, amelyet közvetett kalorimetriával értékeltek, normális volt a testösszetétel szempontjából (1260 kcal/24 óra, 39 kg zsírmentes tömeg).
A Phe144leu POMC mutáció funkcionális hatása.
Értékeltük a Leu144αMSH (mutált POMC allél) képességét a hMC4R aktiválására, összehasonlítva mind a cAMP termelést, mind a receptorhoz való kötődést a Phe144aMSH (vad típusú allél) kötésével. Vizsgálatunk során a hMC4R aktivációja a Leu144αMSH hatására szinte teljesen megszűnt (EC50 nem meghatározható), összehasonlítva a Phe144αMSH-val (EC50 ± SD = 1,5 ± 0,7 nM) (3. ábra).A). Ennek az eredménynek volt köszönhető, legalábbis részben, a Leu144aMSH drámai módon megváltozott kötődésének a hMC4R-hez (3. ábraB).
Az MC4R aktivációjának és kötődésének zavara a Phe144Leu POMC αMSH termékével. Leu144aMSH-t (Leu az aMSH 7. helyzetében, amely a mutált POMC allélnak felel meg) és Phe144aMSH-t (Phe a vad helyzetnek megfelelő 7. pozícióban) szintetizáltuk és nagy teljesítményű folyadékkromatográfiával tisztítottuk. (A) MC4R aktivitás a Phe144aMSH vagy a Leu144aMSH válaszaként. Az adatpontok öt meghatározás átlagát jelentik, a hibasávok pedig az SD-ket. Az αMSH aktiválásához szükséges EC50 ± SD-érték 1,5 ± 0,7 nM. (B) Phe144aMSH vagy Leu144aMSH versenykötési vizsgálata a humán MC4R-en. Minden pont a három párhuzamos érték átlaga, és a hibasávok jelzik az SD-ket. Ebben a kísérletben a Phe144aMSH IC50-értéke 29,6 ± 7,52 nM. Phe144αMSH (szilárd négyzetek); Leu144αMSH (szilárd háromszögek).
VITA
Vizsgálatunkban a POMC gén variációinak gyakorisága nem volt szignifikáns különbség az elhízott és a kontroll gyermekek között. Ellentétben az elhízott populációkban lényegesen gyakoribb MC4R mutációkkal (27,28), azt javasolja, hogy a POMC mutációk implikációja az elhízás kialakulásában még megvitatandó. Noha a POMC mutációk hordozóit több tanulmány is leírta (4,5,11–13,16–18), a mutációk hatása az elhízás fenotípusára változónak tűnik, és a POMC mutációk funkcionális következményeinek vizsgálata még mindig ritka, de kórokozó szerepük bemutatásához szükséges. Eddig csak néhány POMC mutáció tekinthető monogén elhízás okának (4,12,17,18).
Összegzésként elmondható, hogy a POMC mutációk hasonló gyakoriságát találtuk sovány és elhízott gyermekeknél. Csak a ritka káros mutációk, például az itt leírt Phe144Leu, járulhatnak hozzá a korán kialakuló elhízáshoz (11–13,16–18). Korábbi tanulmányok mellett megállapításaink megerősítik a POMC génmutációk kevésbé kritikus szerepét az emberi elhízás komplex determinizmusában, összehasonlítva az MC4R mutációkkal, amelyek az emberi elhízás 2–3% -ában vesznek részt (27,28). Ezenkívül megerősíthetik a βMSH, mint az αMSH kritikusabb szerepét az emberi energiamérleg szabályozásában, mivel az αMSH mutációi csak mérsékelten hatnak az elhízott fenotípusra, összehasonlítva a βMSH mutációk hatásával, és támogatják a a melanokortin útja az emberi súly szabályozásában.
- Az elhízott gyermekek anyái különböző szavakkal korlátozzák az étkezést Az elhízott gyermekek gondozói
- Elhízott, zsírmájú gyermekek A valóság és a betegségek ártalma között
- Az elhízott gyermekek hajlamosabbak a szorongásra, a depresszióra és az élet rövidítésére; News-Medical
- PRIME PubMed Az elhízott gén által kódolt plazmafehérje súlycsökkentő hatása
- Nincs visszaesés a gyorsétel-reklámozásban a gyermek televíziójában, áll az új CSPI elemző központ szerint