A prosztaglandin D-szintáz gátlása elnyomja az izmos nekrózist
Ikuko Mohri
A Mentális Egészségügyi és Környezeti Hatások Kutatási Osztályától, * a Gyermek Mentális Fejlődésének Molekuláris Kutatóközpontjától és a Fejlesztő Orvostudományi (Gyermekgyógyászati) Tanszéktől, † Oszakai Orvostudományi Doktori Iskola, Oszaka; és Molekuláris Viselkedésbiológiai Tanszék, Oszaka Biológiai Tudomány Intézet, Oszaka, Japán
Kosuke Aritake
A Mentális Egészségügyi és Környezeti Hatások Kutatási Osztályától, * a Gyermek Mentális Fejlődésének Molekuláris Kutatóközpontjától és a Fejlesztő Orvostudományi (Gyermekgyógyászati) Tanszéktől, † Oszakai Orvostudományi Doktori Iskola, Oszaka; és Molekuláris Viselkedésbiológiai Tanszék, Oszaka Biológiai Tudomány Intézet, Oszaka, Japán
Hidetoshi Taniguchi
A Mentális Egészségügyi és Környezeti Hatások Kutatási Osztályától, * a Gyermek Mentális Fejlődésének Molekuláris Kutatóközpontjától és a Fejlesztő Orvostudományi (Gyermekgyógyászati) Tanszéktől, † Oszakai Orvostudományi Doktori Iskola, Oszaka; és Molekuláris Viselkedésbiológiai Tanszék, Oszaka Biológiai Tudomány Intézet, Oszaka, Japán
Yo Sato
A Mentális Egészségügyi és Környezeti Hatások Kutatási Osztályától, * a Gyermek Mentális Fejlődésének Molekuláris Kutatóközpontjától és a Fejlesztő Orvostudományi (Gyermekgyógyászati) Tanszéktől, † Oszakai Orvostudományi Doktori Iskola, Oszaka; és Molekuláris Viselkedésbiológiai Tanszék, Oszaka Biológiai Tudomány Intézet, Oszaka, Japán
Shinya Kamauchi
A Mentális Egészségügyi és Környezeti Hatások Kutatási Osztályától, * a Gyermek Mentális Fejlődésének Molekuláris Kutatóközpontjától és a Fejlesztő Orvostudományi (Gyermekgyógyászati) Tanszéktől, † Oszakai Orvostudományi Doktori Iskola, Oszaka; és a Molekuláris Viselkedésbiológiai Tanszék, ‡ Osaka Bioscience Institute, Oszaka, Japán
Nanae Nagata
A Mentális Egészségügyi és Környezeti Hatások Kutatási Osztályától, * a Gyermek Mentális Fejlődésének Molekuláris Kutatóközpontjától és a Fejlesztő Orvostudományi (Gyermekgyógyászati) Tanszéktől, † Oszakai Orvostudományi Doktori Iskola, Oszaka; és a Molekuláris Viselkedésbiológiai Tanszék, ‡ Osaka Bioscience Institute, Oszaka, Japán
Toshihiko Maruyama
A Mentális Egészségügyi és Környezeti Hatások Kutatási Osztályától, * a Gyermek Mentális Fejlődésének Molekuláris Kutatóközpontjától és a Fejlesztő Orvostudományi (Gyermekgyógyászati) Tanszéktől, † Oszakai Orvostudományi Doktori Iskola, Oszaka; és Molekuláris Viselkedésbiológiai Tanszék, Oszaka Biológiai Tudomány Intézet, Oszaka, Japán
Masako Taniike
A Mentális Egészségügyi és Környezeti Hatások Kutatási Osztályától, * a Gyermek Mentális Fejlődésének Molekuláris Kutatóközpontjától és a Fejlesztő Orvostudományi (Gyermekgyógyászati) Tanszéktől, † Oszakai Orvostudományi Doktori Iskola, Oszaka; és Molekuláris Viselkedésbiológiai Tanszék, Oszaka Biológiai Tudomány Intézet, Oszaka, Japán
Yoshihiro Urade
A Mentális Egészségügyi és Környezeti Hatások Kutatási Osztályától, * a Gyermek Mentális Fejlődésének Molekuláris Kutatóközpontjától és a Fejlesztő Orvostudományi (Gyermekgyógyászati) Tanszéktől, † Oszakai Orvostudományi Doktori Iskola, Oszaka; és Molekuláris Viselkedésbiológiai Tanszék, Oszaka Biológiai Tudomány Intézet, Oszaka, Japán
Absztrakt
A Duchenne-féle izomdisztrófia (DMD) az egyik leggyakoribb típusú izomdisztrófia, amely 3500 fiúból körülbelül 1-et érint. 1 A DMD progresszív izomdisztrófiáját a membrán sérülékenysége okozza, 2 amely az izomfehérje dystrophin hibájából ered, 3, 4, de a betegség progressziójának pontos patofiziológiája nem ismert. Erre a katasztrofális betegségre még mindig nincs teljes gyógymód, bár a génátvitelt már alaposan kipróbálták emlős modellekben. Az 5., 6. glükokortikoidok és 7. analógjaik csak bizonyos mértékben képesek elnyomni a betegséget. A DMD-ben ezek a szteroidok csökkentik a gyulladásos sejtek behatolását az izomba 8 és csökkentik az immunválaszban részt vevő gének expresszióját. Ezek az adatok arra utalnak, hogy a gyulladás szerepet játszhat a betegség előrehaladásában.
Anyagok és metódusok
Minden állatkísérletet a kísérleti állatok védelméről szóló japán törvénynek megfelelően hajtottak végre, és megfeleltek az Országos Egészségügyi Intézet és az Idegtudományi Társaság által kiadott előírásoknak. A C57BL/6 egér törzset alkalmaztuk a BPVC által kiváltott izomelhalásos modellhez. Humán HPGDS (hHPGDS) -TG egereket FVB háttérrel állítottunk elő az előzőekben leírtak szerint. 17 FVB törzs vad típusú egerét használtuk kontrollként a hHPGDS-TG egerekkel végzett kísérletekhez.
Az mdx egerek (C57BL/10 ScSn, JAX Laboratories) Dr. Shin'ichi Takeda (Molekuláris Terápia Tanszék, Nemzeti Idegtudományi Intézet, Országos Neurológiai és Pszichiátriai Központ, Kodaira, Tokió, Japán) nagylelkű ajándéka volt. a mutációt keresztezéssel tartották fenn.
BPVC által kiváltott egérmodell
Ezt a vizsgálatot 7 hetes hím egerekkel végeztük, a korábban leírtak szerint. 16, 18 Mély érzéstelenítésben 0,05 ml 0,1% -os BPVC-t injektáltunk a kitett négyfejű izomba közvetlen látás alatt. Kontrollként az egerek quadriceps izmainak 0,05 ml steril sóoldatot kaptunk ugyanúgy.
A BPVC csoportba tartozó egereket véletlenszerűen két alcsoportba soroltuk, és kettős-vak módon vivőanyaggal (0,5% metil-cellulóz, n = 8) vagy HPGDS-gátlóval (HQL-79; 30 mg/kg/nap 0,5% metilben) kezeltük. cellulóz, n = 10) 19 szájon át, 1 órával és 24 óránként, a BPVC injekció után 7 napig. Specifikus DP1 antagonistával (BW A868C; Cayman, Ann Arbor, MI) 20 vagy DP2 (Ramatroban; Cayman) végzett kezelés esetén 21 egeret injektáltunk szubkután 1 órával a BPVC injekció előtt és 24 óránként 7 napig. A BW A868C és a Ramatroban kémiai vegyületek, amelyek a DP120 és a DP221 PGD2 receptoraihoz kötődnek, és gátolják a jelátvitelüket az expressziós helyeken.
Az mdx egér modell
Vad típusú C57BL/10 ScSn egereket használtunk kontrollként. A 4 hetes hím mdx egereket véletlenszerűen 2 csoportba soroltuk, és kettős-vak módon kezeltük vivőanyaggal (0,5% metil-cellulóz) vagy HPGDS-gátlóval (HQL-79; 30 mg/kg/nap 0,5% metil-cellulózban). ) szájon át 10 napig.
Izompatológia és immunocitokémia
Az eltávolított izmokat egy éjszakán át 4 ° C-on 4% paraformaldehidben 0,1 M/L nátrium-foszfátban (pH 7,4) merítettük és paraffin blokkokká dolgoztuk fel. A paraffin és a fagyasztott (5 μm vastag) szakaszokat 3-amino-propil-trietoxi-szilánnal bevont tárgylemezekre rögzítettük. Néhány soros paraffin metszetet rutinszerűen H & E-vel festettek, másokat immunfestéssel HPGDS-re; és fagyasztott metszeteket immunfestettünk DP1-re a korábban leírtak szerint. 22, 23
Western Blot elemzés
Az izmot 3 térfogat PBS-ben homogenizáltuk. 20 percig 16 000 x g sebességgel végzett centrifugálás után a kapott felülúszót használtuk a HPGDS Western-blottolásához. A fehérjét (10 μg/sáv) SDS-poliakrilamid gélelektroforézissel elválasztottuk, átvittük egy Immobilon PVDF membránra (Millipore, Bedford, MA), és immunfestést végeztünk a korábban leírtak szerint. 22.
Mennyiségi PCR
A teljes RNS-t az egér quadricepszéből guanidinium-tiocianát-fenol-kloroform módszerrel extraháltuk ISOGEN (Nippon Gene, Tokió, Japán) alkalmazásával. Az mRNS-ek mennyiségi kvantitatív analízise a HPGDS, DP1, DP2, CD11b (makrofágokon és 24, 25 granulocitákon expresszált felszíni antigén), tumor nekrózis faktor (TNF) α, transzformáló növekedési faktor (TGF) β1 és glicerinaldehid- A 3-foszfát-dehidrogenázt a LightCycler amplifikációs és detektáló rendszer (Roche Diagnostics, Indianapolis, IN) alkalmazásával hajtottuk végre, az alábbiakban leírtak szerint. Az alkalmazott szekvencia-specifikus primerek a következők voltak: HPGDS előreindító, 5'-GAATAGAACAAGCTGACTGGC-3 '; HPGDS reverz primer, 5'-AGCCAAATCTGTGTTTTTGG-3 '; DP1 előreindító, 5′-TTTGGGAAGTTCGTGCAGTACT-3 ’; DP1 fordított primer, 5′-GCCATGAGGCTGGAGTAGA-3 ’; DP2 előreindító, 5′-TGGCCTTCTTCAACAGCGT-3 ’; DP2 fordított primer, 5′-ACGCAGTTGGGGAATTCG-3 ’; CD11b előreindító, 5'-CAGGGACAACCACACCTCTTG-3 '; CD11b reverz primer, 5'-GCAGCGTCATACCAGCACAC-3 '; TNFα előreindító, 5'-AGTGACAAGCCTGTAGCCCACG-3 '; TNFα reverz primer, 5′-TTTCTCCTGGTATGAGATAGC-3 ’; TGFβ1 előreindító, 5'-TGCGCTTGCAGAGATTAAAA-3 '; TGFβ1 reverz primer, 5'-AGCCCGAAGCGGACTACTAT-3 '; glicerinaldehid-3-foszfát-dehidrogenáz előreindító, 5'-TGAACGGGAAGCTCACTGG-3 '; és glicerinaldehid-3-foszfát-dehidrogenáz reverz primer, 5'-TCCACCACCCTGTTGCT-3 '.
Az összes mRNS-szintet a glicerinaldehid-3-foszfát-dehidrogenáz mRNS-szintjével történő normalizálás után mutatjuk be. A standard görbe létrehozásához használt konstrukciókat úgy készítettük, hogy minden egyes amplifikált fragmenst egy pGEM vektor (Promega, Madison, WI) HindIII helyébe klónoztunk. Az összes PCR-terméket UV-fényben tettük láthatóvá, elektroforézis után, etidium-bromidot tartalmazó agarózgélben, majd szekvenáltuk, hogy ellenőrizzük, hogy a tervezett mRNS-ből csak a specifikus polimerizáció történt-e.
A nekrotikus izom térfogatának becslése Evans kék festék injektálásával
Az Evans Blue festéket (10 mg/ml PBS, Sigma, St. Louis, MO) intravénásán injektáltuk egerek farokvénájába (50 μl/10 g testtömeg), az előzőekben leírtak szerint. Az állatokat az injekció beadása után 4 órával leöltük. Az izmokat eltávolítottuk, száraz jégen lefagyasztottuk és liofilizáltuk. Az izmokban található Evans kék festéket formamiddal (Nakalai Tesque, Kiotó, Japán) egy éjszakán át 60 ° C-on extraháltuk. Az Evans kék festék mennyiségét az extraktumban 630 nm-es abszorpciós spektrométerrel és 10 és 1000 ng/ml közötti külső standardokkal határoztuk meg.
Számított tomográfiai letapogatás elemzése
A nekrotikus izom térfogatát radiográfiásan szemléltettük LaTheta röntgen-komputertomográfiával (CT, ALOKA, Tokió, Japán) a gyártó protokollja szerint. Az érzéstelenített egereket 15 percen át dorzális helyzetben pásztáztuk intravénás infúzió során egy nem ionos kontrasztanyag (Iopamiron, Bayer, Osaka, Japán) disztális farokvénáján 1,2 ml/óra infúziós sebességgel.
Az egerek CT-képének adatait vizualizációs szoftverrel (ALOKA) elemeztük, amely az adatokat 2D axiális keresztmetszeti képként jelenítette meg. Megerősítettük a nekrotikus térfogat lineáris korrelációját a röntgen CT elemzés és a nekrotikus izom térfogatának becslése között Evans kék festék injekcióval (az adatokat nem mutatjuk be). A háromdimenziós adatokat szeletelt CT képekből állítottuk össze, összegyűjtve ezeket a képeket a Z-tengely mentén, a VGStudio MAX szoftver segítségével (Volume Graphics, Heidelbelg, Németország).
A vizelet PGD2 metabolitjának mérése
A tömegspektrometriás módszerrel a 11,15-dioxo-9-hidroxi-2,3,4,5-tetranorprostan-1,20-dionsavat (tetranor-PGDM) az infúzióval beadott PGD2 metabolitjaként azonosítottuk, amely kimutatható egér és emberi vizeletben . 28 A vad típusú egerekből és az mdx egerekből napi vizeletet gyűjtöttünk, és az abban leírt tetranor-PGDM mennyiségét folyadékkromatográfia-tandem tömegspektrometria alkalmazásával határoztuk meg. 28 A kreatinin koncentrációt tesztkészlettel mértük (Wako Pure Chemical, Oszaka, Japán).
A markolat szilárdsági tesztje
A tapadás szilárdságát vízszintes elülső hálós hálóból álló tapadási szilárdságmérővel értékeltük (Brain Science Idea, Osaka, Japán). Öt sikeres mellső szilárdságmérést rögzítettünk 2 percen belül. A későbbi elemzéshez minden nap átlagértékeit használtuk. A fogási szilárdság méréseit a reggeli órákban gyűjtöttük össze.
Statisztikai analízis
Az értékeket átlag ± SE-ként fejeztük ki. Az adatokat kétfarkú t-teszt alkalmazásával elemeztük, és a nekrotikus rostokban felismert P + immunreaktivitás értékeket a BPVC által kiváltott izom-nekrózisban
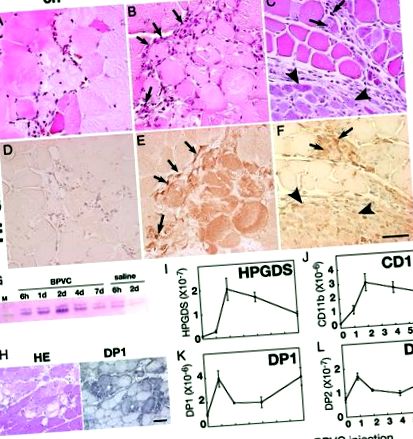
A – H: HPGDS expresszió nekrotikus izomrostokban. A HE festés eredményei (A – C) és HPGDS immunfestés (D – F) 6 órakor (A, D), 2 nap (LENNI) és 4 nap (C, F) BPVC injekció után. Méretarány = 50 μm. Nyilak és nyílhegyek jelzik a HPGDS-pozitív infiltráló makrofágokat és a regeneráló izomrostokat. G: Western blot a HPGDS-re. H: DP1 expresszió nekrotikus izomrostokban. Balra, HE festés; jobb, DP1 immunocitokémia. Méretarány = 50 μm. I – L: Kvantitatív RT-PCR HPGDS mRNS-ekhez (én), CD11b (J), DP1 (K) és a DP2 (L). n = 4. Az adatok az átlag ± SE.
A HPGDS-túlexpresszió súlyosbította az izom nekrózisát
Feltételeztük, hogy az izomkárosodásban a HPGDS által termelt PGD2 súlyosbította az izomnekrózist a BPVC által kiváltott izomnekrózis modellben. Ennek a lehetőségnek az értékeléséhez összehasonlítottuk a BPVC által kiváltott izmos nekrózist a vad típusú egerek és az azonos genetikai háttérrel rendelkező (FVB törzs) humán HPGDS-t overexpresszáló transzgenikus (hHPGDS-TG) egerek 17 között, amelyek konstitutív módon nagy mennyiségű humán HPGDS-t expresszálnak az endogén egér HPGDS mellett (2. ábra, A és B ábra). Amint a 2A. Ábra mutatja, a H-festés azt mutatta, hogy a 2. napon hatalmas izomelhalás következett be a BPVC-vel injektált hHPGDS-TG egerekben; és az izomban széles szálak voltak, ami súlyos ödémára utal. Összehasonlítva a kontroll izmokéval, a hHPGDS-TG egerek izomnekrózisa eltúlzott és elhúzódó volt. Amint a 2B. Ábra mutatja, a relatív víztartalom szignifikánsan magasabb volt a hHPGDS-TG egérizomban, mint a vad típusú egerekben a BPVC injekció után 2 nappal. Ezek az eredmények azt jelzik, hogy a PGD2 túltermelése fokozta az izom nekrózisát és ödémáját.
A 3D-G ábrák a BPVC-vel injektált egerek fokozott CT-jének rekonstruált 3D-s képeit szemléltetik a 4. napon a hordozóval, HQL-79, BW A868C vagy Ramatroban kezelés után, amelyen a nem ionos kontrasztanyagot tartalmazó sérült izom látható. pirosban. A számított nekrotikus izomtérfogat a 4. napon szignifikánsan csökkent a HQL-79-vel kezelt egereknél, de a DP1 vagy DP2 antagonistát kapóknál nem (3H. Ábra). Ezek az eredmények azt mutatják, hogy a HPGDS inhibitor hatékonyabban csökkentette az izom nekrózisát, mint akár a DP1, akár a DP2 antagonista önmagában, és hogy a PGD2 jelátvitel mind a DP1, mind a DP2 receptorokon keresztül fejtette ki működését izomelhalásban.
Az mdx egér izomzatában csoportosított nekrózis fókuszában felismert HPGDS-immunreaktív szálak
Nem világos, hogy a nekrotikus izomrostok hogyan fejezik ki a HPGDS immunreaktivitását. Az utóbbi időben azonban apoptózis-szerű jelenségről számoltak be izomelhalás során. Mizutani és Ohno 33, 31, 32 arról is beszámolt, hogy a kaszpáz-3, amely a mitokondriális közvetített apoptózissal függ össze, nekrotikus izomrostokban expresszálódott. Továbbá Honda és mtsai 34 arról számoltak be, hogy a kaszpáz-12 gén expressziója részt vesz az endoplazmatikus retikulum stressz útjában, és hogy a Bax, a kaszpáz-9 és a kaszpáz-3 gének részt vesznek az mdx masszírozó izom mitokondriális stressz útjában. . Ezek az adatok arra utalnak, hogy az mdx izom degenerációja során apoptózis lép fel. E bizonyítékok alapján lehetséges, hogy az apoptózis során a HPGDS expressziója izomrostokban indukálódik.
A HPGDS-gátlók terápiás következményei az izom nekrózisában
Ebben a tanulmányban bebizonyítottuk, hogy a HQL-79, egy HPGDS inhibitor, elnyomta a PGD2 termelést és javította az izomerőt az mdx egérben. Beszámoltak arról, hogy a kortikoszteroid DMD-ben szenvedő betegeknél klinikai javulást eredményez. A kortikoszteroid a proteázok alacsonyabb szintű szabályozását és/vagy a fehérjetartalom nettó növekedését okozhatja. 39 Ezenkívül a kortikoszteroid jótékony hatása a citoszolos foszfolipáz A2 és a ciklooxigenáz elnyomásának tudható be, ami a PG szintézisének teljes gátlásához vezet. 40 A kortikoszteroidok hosszú távú alkalmazása azonban súlyos mellékhatásokhoz vezet. Ezenkívül a kortikoszteroidok gátolják a citoprotektív prosztanoidok, köztük a prosztaglandin E2, 41 termelését, amely fontos a sérülés utáni gyógyulásban és izomregenerációban. Ezen bizonyítékok alapján elméletileg előnyös az izomnekrózis kezelése, különös tekintettel a PGD2 termelésére és jelátvitelére.
Shen és mtsai 42 megemlítették, hogy a nem szteroid gyulladáscsökkentők, amelyek a ciklooxigenáz gátlói, izomsérülések kezelésére történő alkalmazása kritikus értékelést igényel, mivel a nem szteroid gyulladáscsökkentők károsíthatják az izomgyógyulást, mivel gátolják a myogén prekurzor sejtek fúzióját. Ebben a tanulmányban azt tapasztaltuk, hogy a HPGDS a regeneráló izomban is kifejeződött a regeneráció korai szakaszában, bár a HPGDS szerepe az izomregenerációban még tisztázatlan.
A HPGDS molekuláris és enzimatikus tulajdonságait mi és más csoportok jól jellemezték. 43 A HPGDS kristályszerkezetét már meghatározták. A patkány HPGDS, 43 humán HPGDS, 44 kristályszerkezetét, valamint a humán HPGDS és HQL-79 19 komplexét már meghatározták. A humán HPGDS-HQL-79 komplex kristálytani felépítése alapján számos gyógyszergyár új HPGDS inhibitorokat tervez, hogy hatékonyabbak és szelektívebbek legyenek a HPGDS felé. Amint itt bemutattuk, mivel a PGD2 fokozta az izomnekrózist a BPVC által kiváltott nekrózisban és az mdx egerekben, a PGD2 termelésének HPGDS inhibitorok általi elnyomása előnyös lehet a DMD kezelésében. Továbbá, mivel korábban beszámoltunk arról, hogy a HPGDS expresszió kimutatható a polimiozitiszben szenvedő betegek izomzatában, 11 ilyen HPGDS gátló hatékonynak bizonyulhat a polimiozitisz kezelésében is.
Köszönetnyilvánítás
Köszönjük Shigeko Matsumoto asszonynak, az Oszaka Biológiai Tudományok Intézetének az immunocitokémia elvégzését; Yumiko Hoshikawa és Masumi Sakata, az Oszaka Biológiai Tudományok Intézete, technikai segítségért; Dr. Hiroshi Yamamoto, Oszakai Egyetem, mdx egerek ellátásáért; Dr. Tenjo Konishi és Dr. Norio Nakamura, a Doshisha Női Bölcsészettudományi Főiskola a tetranor – PGDM LC-MS/MS általi mérésének támogatásáért; és Masaki Kobayashi és Hiroshi Shigeta, az ALOKA Co. Ltd. CT-elemzésekhez.
- A fokozott lipid-felhalmozódás gátlása a poli (ADP-ribóz) polimeráz SREBP1 modulációval -
- Hogyan lehetséges, hogy a vékony lábak erősebbek, mint az izmos lábak Cyclingnews Forum
- A szénacél korrózió gátlása közegben H2S-sel, impedancia spektroszkópiai módszerrel tanulmányozva -
- Szívproblémák - Izomdisztrófia hírek
- Az alacsony szénhidráttartalmú diéták rosszul leheletet okozhatnak