A sztatinok jótékony szív- és érrendszeri pleiotróp hatásai
A hiperlipidémia és az érelmeszesedés kutatócsoportjából, Montreali Klinikai Kutatóintézet, Montreal, Québec, Kanada.
Absztrakt
A gyógyszer pleiotróp hatásai nem csak azok, amelyekre a szert kifejezetten kifejlesztették. Ezek a hatások összefügghetnek vagy nem kapcsolódhatnak a gyógyszer elsődleges hatásmechanizmusához, és általában nem várják őket. A pleiotróp hatások lehetnek nemkívánatosak (például mellékhatások vagy toxicitás), semlegesek, vagy - különösen, mint a HMG-CoA reduktáz inhibitorok (sztatinok) esetében - előnyösek. A sztatinok pleiotróp hatása magában foglalja az endotheliális diszfunkció javulását, a nitrogén-oxid fokozott biohasznosulását, antioxidáns tulajdonságait, a gyulladásos válaszok gátlását és az érelmeszesedéses plakkok stabilizálódását. Ezek és számos más felbukkanó tulajdonság együttesen működhet a sztatinok alacsony sűrűségű lipoprotein koleszterinszint-csökkentő hatásával, hogy korán és tartósan kardiovaszkuláris védőhatásokat fejtsen ki. A sztatinok pleiotrop hatásainak megértése fontos, hogy optimalizáljuk a szív- és érrendszeri betegségek kezelésében és megelőzésében való felhasználásukat.
Ahogy a HMG-CoA reduktáz inhibitorok (sztatinok) egyre nagyobb számban váltak be a betegek körében, a lipidcsökkentésen túli hatásuk kezdett megjelenni. Ilyen pleiotróp hatások közé tartozik az endotheliális diszfunkció javulása, a nitrogén-oxid fokozott biohasznosulása, antioxidáns hatások, gyulladáscsökkentő tulajdonságok és az érelmeszesedéses plakkok stabilizálása. Az egyre növekvő érdeklődés további hatásai közé tartozik az endoteliális progenitor sejtek (EPC) toborzásának képessége, egy feltételezett immunszuppresszív aktivitás és a szív hipertrófiájának gátlása. A kutatások azt mutatják, hogy a sztatinok pleiotrop hatásai némelyike nem lehet összefüggésben a gyógyszerek koleszterinszint-csökkentő tulajdonságával. Mások akár teljesen elszakadhatnak a HMG-CoA reduktáz gátlásától, és sokan nagyon alacsony gyógyszerkoncentráció mellett játszódnak le. Ez az áttekintés azokra a hatásokra összpontosít, amelyek különleges kardiovaszkuláris jelentőséggel bírnak. A statin-terápiához kapcsolódó előnyök teljes spektrumának megértése lehetővé teheti a jobb terápiás alkalmazást, és elősegítheti a sztatinok korai alkalmazását akut koszorúér-szindrómákban.
Az endoteliális diszfunkció javulása
Az endoteliális sérülés hozzájárul az atherogén folyamat megindulásához. Az endotheliális diszfunkció, amely egy ilyen sérülés korai megnyilvánulása, az endotheliumból származó nitrogén-monoxid (NO) szintézisének, felszabadulásának és aktivitásának zavara miatt paradox vaszokonstrikcióval társul az acetilkolinhoz képest. Az abnormális endothelium-függő vazomotoros válaszok előre jelzik az érelmeszesedés és az ezzel járó koszorúér-események, valamint az érsebészeti beavatkozások után röviddel bekövetkező eseményeket. 1,2 Ezért nem meglepő, hogy a sztatinok jól bevált képessége az endothel diszfunkció javítására, egy osztályhatás, nagy figyelmet kapott az elmúlt években.
Normalizált vasomotion
Kimutatták, hogy a rövid távú sztatin-kezelés javítja az endothel diszfunkcióját és fokozza a szívizom perfúzióját. Perfúziós rendellenességekben szenvedő hiperkoleszterinémiás betegeknél például a fluvasztatinnal (40–80 mg/nap) 6–12 héten keresztül végzett kezelés szignifikánsan fokozta a szívizom perfúzióját iszkémiás szegmensekben (30%; P 3 Mérsékelten emelkedett koleszterinszinttel (6,2-7,5 mmol/l) szenvedő betegeknél a 20 mg/nap szimvasztatinnal végzett kezelés a placebóval összehasonlítva szignifikánsan (P További 3 hónapos kezelés után a szimvasztatin csoport javulása szignifikánsan (P 5 összehasonlította a 10 mg/nap atorvasztatint és az étrendi terápiát kizárólag diétás terápiával a postmenopauzás nőknél, hiperkoleszterinémiában. Jelentős javulást figyeltek meg a brachialis artéria vazoreaktivitásában már 2 héttel az atorvasztatin megkezdése után, összehasonlítva a kizárólag diétás terápiával (P Csak gyenge korrelációt figyeltek meg az atorvasztatinnal végzett koleszterinszint-csökkenés és a vazoreaktivitás javulása között. Valójában egy egészséges normokoleszterinémiás fiatal férfiakkal végzett kisméretű tanulmány azt mutatta, hogy a 80 mg atorvasztatin-kezeléstől számított 24 órán belül javult az endothelium funkciója, és 30 nap elteltével a sztatin megvonása gyors károsodást mutatott. A hatás akkor jelentkezett, amikor a szérum koleszterinszintje és a magas érzékenységű C-reaktív fehérje (hsCRP) 2 napos kezelés után csökkent. Ezek az eredmények alátámasztják azt a nézetet, hogy a sztatinok jótékony hatást fejthetnek ki az endotheliális diszfunkcióra, függetlenül a plazma koleszterinszint-csökkentő fokától.
A hosszú távú sztatin-terápia javítja az endothel működését is ateroszklerózisban szenvedő betegeknél. Egyedül az étrendet, egy alacsony sűrűségű lipoprotein (LDL) szintet csökkentő rendszert (lovasztatin és kolesztiramin), valamint egy LDL-szintet csökkentő és antioxidáns rendszert (lovasztatin és probukol) teszteltek 1 évig az acetilkolin által kiváltott érszűkületen epikardiális koszorúerekben. 7 Az érszűkítő válasz legnagyobb javulását az LDL-szintet csökkentő antioxidáns csoportban tapasztalták (P= 0,01).
Azt vizsgálják, hogy a statin terápia hasonló jótékony hatással van-e az endothelium-függő vazodilatációra a diabetes mellitusban. A szimvasztatinnal és az atorvastatinnal végzett legutóbbi vizsgálatok nem mutatták ki, hogy a statin terápia hatással lenne az endothelium-függő vazodilatációra 2-es típusú cukorbetegségben. 8,9 Ugyanakkor egy másik vizsgálat az atorvasztatinnal 2-es típusú cukorbetegségben az endothelium-függő vazodilatáció jelentős javulását mutatta. 10 Hasonló eredményt jelentettek az atorvasztatin esetében 1-es típusú cukorbetegségben és normál koleszterinszinttel rendelkező fiatal betegeknél. 11 Az ezekben a vizsgálatokban elért ellentmondó eredmények oka lehet a sztatin dózisának, a vizsgálat felépítésének, a beteg kiválasztásának, az egyidejűleg alkalmazott gyógyszeres kezelésnek és az endotheliális funkció mérésére használt technológiának a különbsége.
A nitrogén-oxid fokozott biohasznosulása
A sztatinok az LDL-koleszterinszint csökkentésével részben javítják az endothel diszfunkcióját; pontosabban kimutatták, hogy megakadályozzák az endoteliális nitrogén-oxid-szintáz (eNOS), az enzim, amely katalizálja az NO-képződést l -argininből, natív LDL által. Az eNOS csökkentését szabályozhatja az LDL azon képessége, hogy növelje a caveolin-1 szintjét, amely az eNOS aktivitás fő gátlója. 13.
A sztatinok szintén közvetlenül fokozzák a konstitutív eNOS aktivitást, ezáltal növelve az NO biológiai hozzáférhetőségét. Számos mechanizmus vehet részt, köztük a caveolin-1 mennyiségének csökkenése és a Hsp90 növekedése, amely molekuláris chaperonként segíti az eNOS hosszú távú aktiválását. 13 Egyéb mechanizmusok közé tartozik az eNOS messenger RNS 15 stabilizálása és a NO-t inaktiváló reaktív oxigénfajok termelésének csökkenése. A sztatinok szintén zavarják az Rho GTPáz geranilgeranil-pirofoszfáttal (GGPP) történő prenilezését, megakadályozva annak transzlokációját a sejtmembránra, ahol negatívan szabályozzák az eNOS aktivitását. 17.
A PI3-kináz/Akt út is részt vesz a NO szabályozásában. A statinokról kiderült, hogy aktiválják a szerin/treonin kináz Akt-t (protein-kináz B) az endoteliális sejtekben, ezáltal fokozva az endogén Akt szubsztrát eNOS foszforilációját és növelve az NO-t. 18.
Antioxidáns hatások
Az antioxidánsok sikertelensége a koszorúér-betegség megelőzésében a legutóbbi vizsgálatokban 19 nem érvényteleníti az érelmeszesedés oxidációs elméletét. Az előny hiánya oka lehet a nem megfelelő adagolás, a kezelés hossza vagy az antioxidáns típusa. 20 Ezen túlmenően szükség lehet az akut események és a korai hatások irányába történő áttérésre, vagy nagyobb figyelmet kell fordítani az oxidatív stressz és a gyulladás kölcsönhatására az aterogenezis során. Tekintettel az oxidált LDL-nek az aterogenezisben betöltött központi szerepére, a sztatin-terápia megállapított antioxidáns hatása kiemelten fontos.
A sztatinok az oxidált LDL eNOS-ra kifejtett gátló hatásának megfordításán túl in vitro és ex vivo közvetlen antioxidáns hatással is rendelkeznek az LDL-re. 21,22 Az atorvasztatin hidroxi-metabolitjai, de az alapvegyület nem, gátolják az LDL és a nagyon kis sűrűségű lipoprotein, valamint a nagy sűrűségű lipoprotein oxidációját. Ezenkívül a hidroxi-metabolitok, amelyek az aktív atorvastatin 70% -át teszik ki a plazmában, szabad gyököket eltávolító képességeket mutatnak, amelyek hozzájárulhatnak a lipoprotein oxidációjának gátlásához. A sztatinok közvetett módon befolyásolhatják a normál oxidációs mechanizmusokat is, korlátozva a makrofágok lipoproteinek oxidáló képességét. 24 A sztatinok szintén kimutatták, hogy csökkentik a CD36 makrofág, az oxidált LDL elismert receptorának aktivitását. 25 Ennek a hatásnak a mechanizmusát vizsgálják.
Gyulladáscsökkentő hatások
Az elmúlt évtizedben egyértelművé vált a gyulladás fontossága az érelmeszesedés kialakulásában. A gyulladás markereinek, például a CRP, az interleukin-6, az intercelluláris adhéziós molekula-1 (ICAM-1) és a szérum amiloid A (SAA) megemelkedett szintjei összefüggenek az első és visszatérő kardiovaszkuláris események fokozott kockázatával. Különösen a 27,28 CRP-szint tűnik a jövőbeni események leghatékonyabb előrejelzői között.
A szérum CRP csökkenése
Meggyőző bizonyíték van arra, hogy a sztatin-terápia gyengítheti a gyulladás kardiovaszkuláris események kockázatára gyakorolt hatását. A koleszterin és a visszatérő események (CARE) vizsgálatban 708 posztinfarktusos beteg közül 27 magas CRP és SAA (> 90. percentilis) szinttel rendelkező alanynak volt nagyobb a kockázata, és jobban részesültek a 40 mg/nap pravasztatin-terápiában, mint azok, akiknél nem volt magas a ezek a gyulladásos markerek. A visszatérő koszorúér-esemény relatív kockázata 54% -kal, illetve 25% -kal csökkent a 2 csoportban, összehasonlítva a placebóval. 27 A kiinduláskor mindkét alcsoportnak közel azonos plazma lipid és lipoprotein profilja volt.
A CARE-vizsgálatban a pravastatinnal végzett hosszú távú terápia szintén csökkentette a CRP szintjét posztinfarktusos betegeknél. 29 Bár az aktív kezelés és a placebo kiindulási medián CRP szintje hasonló volt, 5 év után a mediánszint 21,6% -kal alacsonyabb volt a pravastatin csoportban, mint a placebo csoportban (P= 0,007). A pravastatin-kezeléssel összefüggő CRP-szintek változása nem volt összefüggésben az LDL-koleszterinszint csökkenésével. Ez utóbbi megállapítást megerősítette a legutóbbi 24 hetes prospektív Pravastatin gyulladás/CRP értékelés (PRINCE) vizsgálat. 30
Egy 6 hetes hármas crossover vizsgálat összehasonlította a pravasztatin, a szimvasztatin és az atorvastatin terápia hatását a hs-CRP szintre kombinált hiperlipidémiában szenvedő betegeknél. 31 Mindhárom gyógyszer az LDL-koleszterinre ekvivalens hatású dózisokban jelentősen csökkentette a medián hs-CRP szintet (pravasztatin 20%, szimvasztatin 23% és atorvastatin 28%; ábra), és ezek a csökkenések nem voltak összefüggésben az LDL-koleszterinszint csökkenésével. Ez a tanulmány ellentétben áll egy hasonló összehasonlítás negatív eredményével, amely párhuzamos tervezéssel és 3 hónapos expozícióval történt, és mindegyik alcsoportban kisebb számú alany található. 32 Az atorvasztatin és a szimvasztatin az ateroszklerózis progresszióval (ASAP) vizsgálatban az agresszív statin terápia (80 mg atorvasztatin) nagyobb mértékben csökkentette a CRP szintet, mint a hagyományos terápia (40 mg szimvasztatin). 33 Ezenkívül az egyváltozós elemzés során szignifikáns összefüggést találtak a carotis artéria szegmenseinek CRP csökkenése és intima közeg vastagságának (IMT) csökkenése között. 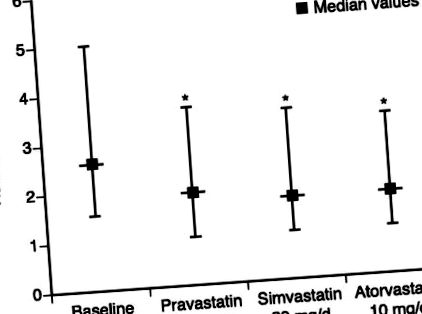
A sztatin terápia hatása a nagy érzékenységű C-reaktív fehérje (hs-CRP) szintjére. Az adatokat 25. percentilis, medián és 75. percentilis formájában mutatjuk be. *P
Egy nemrégiben végzett tanulmány kimutatta, hogy a szimvasztatin 14 napon belül csökkentette a CRP értékét, 34 függetlenül az LDL-koleszterinszint csökkenésétől. A CRP-szint gyors csökkenése a sztatinokkal részben megmagyarázhatja e gyógyszerek korai jótékony hatásait akut koszorúér-szindrómákban. 35
Adhéziós molekulák csökkentése
Az adhéziós molekulák és a kemoattraktánsok fontos szerepet játszanak a gyulladásos folyamatban. 36 Az atherogén folyamat részeként közvetítik a leukociták adhézióját és transzmigrációját a subendotheliumhoz. Mérhetjük az adhéziós molekulák oldható formáit a plazmában, vagy megvizsgálhatjuk in vitro kölcsönhatásukat a gyulladásos sejtfelszíni integrinekkel.
Úgy tűnik, hogy a sztatinok csökkentik az adhéziót és a kemotaktikus molekulákat, valamint gátolják az integrin aktivitását. A tanulmányok azonban következetlen eredményeket hoztak. A szimvasztatinnal és az atorvasztatinnal végzett agresszív lipidcsökkentő kezelés egy korai, kontrollálatlan vizsgálat során az oldható E-szelektin, de nem oldható vaszkuláris sejtadhéziós molekula (VCAM) vagy az oldható ICAM csökkenésével járt. Nemrégiben azt találták, hogy az atorvasztatin és a szimvasztatin jelentősen oldja az E-szelektint, a P-szelektint és az ICAM-1-t, de a szimvasztatin növeli az oldható VCAM-1-et. 38 Az atorvastatin és a szimvasztatin nagy dózisú újabb összehasonlítása azonban mindkét gyógyszer csak kicsi és következetlen hatásait mutatta az ICAM-1 szinteken. A hiperkoleszterinémiában szenvedő betegeknél a fluvasztatin-terápia csökkentette a keringésben lévő P-szelektin és ICAM-1 szintjét; ez a hatás látszólag független volt a lipidcsökkentő hatástól. Egy fontos, nemrégiben készült tanulmány kimutatta, hogy a HMG-CoA reduktázt gátló hatás nélküli módosított sztatin hatásos és szelektív közvetlen gyulladáscsökkentő hatású lehet. 40 Ez a megállapítás azt bizonyítja, hogy a sztatin pleiotróp hatás teljes mértékben elválasztható a koleszterinszintézis gátlásától.
Plakkstabilizálás
Számos mechanizmus számolhatott a sztatinok plakkstabilizáló hatásával, amelyet elegánsan demonstráltak az állatmodellekben. Az LDL-koleszterin csökkenése hozzájárulhat a lipidmag csökkentéséhez. A sztatinok gátolják az oxidált LDL felvételét a CD36, a 43 scavenger A, 44 receptor és a lektinszerű oxidált LDL (LOX-1) receptor 45 által, és gátolják a makrofágok oxidatív tulajdonságait. 24 A sztatinok ilyen hatásai elméletileg hozzájárulhatnak a habsejtek képződésének csökkenéséhez.
A gyulladásos kaszkád számos markerének emelkedett plazmaszintje kimutatta, hogy megjósolja a lepedék felszakadásának jövőbeni kockázatát. Ezek a markerek tartalmazzák a P-szelektint, az interleukin-6-at, a tumor nekrózis-faktort, az oldható ICAM-1-et és a CRP-t. 36 A sztatinok gyulladásos folyamatokra gyakorolt jótékony hatását fentebb tárgyaltuk. Az instabil plakkokban lévő rostos kupak gyengülése a mátrix metalloproteinázok (MMP) makrofágok általi megnövekedett termelésével jár. Tenyésztett makrofágokban a fluvasztatin 20–40% -kal csökkentette az MMP-9 aktivitását. Embereken végzett vizsgálat során 47 pravasztatin-kezelés megváltoztatta a nyaki artéria plakkok összetételét a stabilizációt elősegítő módon. A carotis carotis stenosisban szenvedő betegek a carotis endarterectomia előtt 3 hónapig 40 mg/nap pravasztatint kaptak, vagy nem kaptak terápiát. A statinnal kezelt csoportból eltávolított plakkok lényegesen kevesebb lipid- és oxidált LDL-ből, kevesebb makrofágból és kevesebb T-sejtből álltak. Magasabb a kollagéntartalmuk, és kevesebb MMP-2 immunreaktivitást mutattak, mint a kontroll plakkok. Ezenkívül az apoptózis jelentősen csökkent, és a metalloproteinase-1 (az MMP-1 és az MMP-9 erős inhibitora) szöveti inhibitoraival szembeni immunreaktivitás jelentősen megnőtt a pravasztatin csoportban a kontrollokhoz képest. 47
További hatások
Az endoteliális progenitor sejtek utánpótlásának stimulálása
Az endoteliális progenitor sejtek fontos szerepet játszanak az ischaemiás sérülések helyreállításában. 48 In vitro és in vivo vizsgálatokból származó adatok azt mutatják, hogy a sztatinok legalább olyan hatékonyak, mint a vaszkuláris endoteliális növekedési faktor, amely kulcsfontosságú citokin a neovaszkularizáció szabályozásában, az EPC differenciálódásának fokozásában. A bizonyítékok arra utalnak, hogy a sztatinok növelik a keringő EPC-k szintjét, és elősegítik azok mozgását az ischaemiás területekre. 49 Dokumentáltan stabil koszorúér-betegségben szenvedő betegeknél a 4 hétig tartó 40 mg/nap atorvastatin-kezelés az 1. héten a keringő EPC-k számának 1,5-szeres növekedésével járt, amely a 4 hetes időszak alatt 3-szorosára nőtt . Az atorvasztatin-kezelés az endoteliális prekurzor sejtek egy részének differenciálódását serkentette EPC-ként, ahelyett, hogy növelte volna a keringő hematopoietikus őssejtek teljes számát. Ezen túlmenően az atorvasztatin jelentősen fokozta az EPC-k migrációját a vaszkuláris endoteliális növekedési faktorra adott válaszként.
Ezeknek a megfigyeléseknek a gyakorlati jelentősége egyelőre távolinak tűnhet, de ígéretesnek tűnhet, ha a közelmúltban végzett tanulmány 50 kapcsán vettük figyelembe a szívinfarktus egérmodelljét. A kutatók azt találták, hogy az őssejtfaktor és a granulocita kolónia stimuláló tényező által mobilizált EPC-k az infarktusos szívben helyezkednek el és részben javítják meg, 68% -kal csökkentve a mortalitást és javítva a szívizom működését.
Immunmoduláció
A szívizom hipertrófiájának gátlása
A bal kamrai hipertrófia a koszorúér-betegség és a pangásos szívelégtelenség kockázati tényezője. Az angiotenzin II által in vitro kiváltott patkány kardiomiocita hipertrófiát a szimvasztatin megszüntette. A patkányokban akár angiotenzin II infúzióval (magas vérnyomás jelenléte), akár transaorta szűkület (hipertónia hiánya) által kiváltott szív hipertrófiát in vivo a szimvasztatin (2 mg/kg/nap 4 hétig) szintén gátolta. 55 Ezek a megállapítások azt a bizonyítékot adják hozzá, hogy a sztatinok az érfal és a szív mellett védő hatást gyakorolnak a szervekre, köztük a vese 56 és a hasnyálmirigy, 57,58.
Következtetések
Bár a sztatinok pleiotrop hatásának lehetőségét eleinte egészséges szkepticizmussal teljesítették, az elmúlt években felhalmozott hatalmas mennyiségű tudás ezeket a hatásokat a figyelem középpontjába állította. A sztatin pleiotróp hatások közül sok az LDL-koleszterinszint csökkentésétől függetlenül működik, rosszul vagy egyáltalán nem korrelál az LDL-koleszterin változásával, gyorsan végbemegy és gyorsan visszafordítható a gyógyszer abbahagyása után. Közvetlen hatásokat mutattak ki LDL vagy teljes koleszterin-módosítás hiányában in vitro és in vivo egyaránt. A sztatinok és más gyógyszerek pleiotrop hatásait folyamatosan vizsgálják, hogy teljes mértékben megállapítsák szerepüket a kardiovaszkuláris események megelőzésében. Számos folyamatban lévő, konkrétabban a pleiotrop hatásra irányuló klinikai vizsgálat eredményeinek fel kell világosítaniuk minket azok relatív klinikai relevanciájáról és fontosságáról.
- Az almaecet jótékony hatása a testsúly kezelésére, a zsigeri zsírosság indexére és a lipidekre
- Az étrendi fogyás beavatkozásának jótékony hatása az emberi bél mikrobioma sokféleségére és
- A válás és az akut miokardiális infarktus keringésének kockázata közötti összefüggés kardiovaszkuláris
- Az alternatív étrend jótékony hatása a májgyulladásra, az érelmeszesedésre és a vesére
- A banán ugyanolyan előnyös, mint a sportitalok, javasolja a tanulmány - ScienceDaily