A szubkután zsírtömeg összefügg a genetikai kockázati pontszámokkal, amelyek a proinflammatorikus citokinek szignálozásához kapcsolódnak, és kölcsönhatásba lépnek a fizikai aktivitással középkorú, elhízott felnőtteknél
Absztrakt
Háttér és célok
A szubkután zsírtömeg negatívan korrelál az aterogén kockázati tényezőkkel, de feltételezett előnyei továbbra is ellentmondásosak. Feltételeztük, hogy a szubkután zsírtömeget befolyásoló genetikai variánsok modulálják a lipid- és glükóz-anyagcserét, és kölcsönhatásba lépnek az életmóddal koreai, magas viscerális zsírtartalmú középkorú felnőtteknél.
Anyagok és metódusok
A szubkután zsírtömeget úgy osztályoztuk, hogy a subcapularis bőrréteg vastagságának átlagát elosztottuk a BMI-vel, és ennek vágási pontja 1,2 volt. A derék kerületeit használták a zsigeri zsírtömeg ábrázolására ázsiai vágási pontokkal. A magas viszcerális zsírtartalmú 40–65 éves alanyok GWAS-ja (n = 3303) végeztük, és a szubkután zsírral kapcsolatos genetikai variánsok közül kiválasztottuk a legjobb gén-gén kölcsönhatásokat és tártuk fel az általános multifaktoros dimenziós csökkentést. A genetikai kockázati pontszámokat (GRS) súlyozott GRS-rel számoltuk, amelyet alacsony, közepes és magas csoportokra osztottunk.
Eredmények
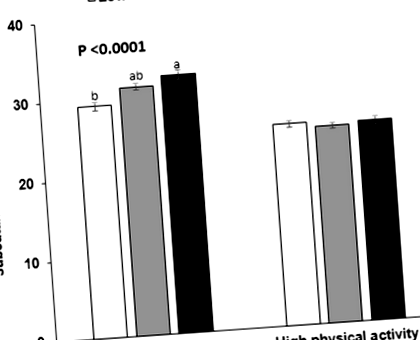
A magas szubkután zsírtartalmú alanyoknak nem volt diszlipidémiája az alacsony szubkután zsírtartalmúakhoz képest, bár mindkét alanycsoport hasonló mennyiségű összes zsírral rendelkezett. A legjobb módszer a szubkután zsír befolyásolására IL17A_rs4711998, ADCY2_rs326149, ESRRG_rs4846514, CYFIP2_rs733730, TCF7L2_rs7917983, ZNF766_rs41497444 és TGFBR3_rs7526590. A subcutan zsír növekedésének esélyaránya (OR) 2,232-szerese volt a magas GRS csoportban, miután a kovariánsokra korrigáltunk. A keringésben lévő teljes és LDL koleszterin, triglicerid és C-reaktív fehérje koncentrációk azonban nem voltak összefüggésben a GRS-szel. A magas GRS-szel rendelkező alanyok szérum HDL-koleszterinszintje magasabb volt, mint az alacsony GRS-értékűeké. A fizikai aktivitás és a GRS kölcsönhatásba léptek a szubkután zsírral. Alacsony fizikai aktivitású alanyokban a magas szubkután zsír esélyaránya 2,232-rel nőtt, de a magas fizikai aktivitású, magas GRS-csoportban a szubkután zsírlerakódást nem befolyásolta.
Következtetés
A magas GRS-ben szenvedő, elhízott felnőtteknél több volt a szubkután zsír, de nem mutattak több dyslipidaemiát és gyulladást az alacsony GRS-hez képest. A magas fizikai aktivitás megakadályozta a szubkután zsírlerakódást azokban az egyénekben, akiknél a szubkután zsír magas GRS volt.
Bevezetés
Mód
Tantárgyak Ansan/Ansung kohorszokban
40–69 éves felnőttek (n = 10 004), akik Ansan (városi közösség) vagy Ansung (vidéki közösség) kohorszokban több mint 6 hónapig tartózkodtak, bekerültek a KoGES-be. 10 004 résztvevőt választottak ki a nagyszabású genom-szintű genotipizáláshoz, és 8842 felnőtt genetikai variánsait engedték el kutatásra.
Antropometriai mérés és kísérleti csoportosítás szubkután és zsigeri elhízás esetén
Életmód
Az alanyok társadalmi-gazdasági információit egy egészségügyi interjú során gyűjtötték össze. Az iskolai végzettséget kevesebb, mint középiskolába, középiskolába és főiskolába sorolták. A dohányzási státust jelenlegi dohányosra, korábbi dohányosra és soha nem dohányzóra osztották. A napi alkoholfogyasztást úgy számoltuk ki, hogy megszoroztuk az alkoholtartalmat a napi ivásmennyiséggel. Az alkoholfogyasztás állapotát az átlagos napi alkoholfogyasztás alapján négy csoportba sorolták: nem ivó, könnyű ital (1–15 g), mérsékelten ivó (16–30 g) és nagyivó (> 30 g) (1. táblázat). A kávéfogyasztást az egy vagy több adag napi kávéfogyasztás gyakoriságával becsültük meg, és az alanyokat 3 csoportra osztottuk, amelyek közül egyet sem (10 csésze/hét).
A rendszeres testmozgást úgy határoztuk meg, hogy megszoroztuk az időtartamot a testmozgás intenzitásával, és az alanyokat 3 csoportba soroltuk, beleértve a kevés (30 perc/nap) aktivitást [8]. A mentális stresszt úgy értékelték, hogy az alanyoknak tíz kérdést tettek fel a munkahelyi izgatottságuk és szorongásuk állapotával, valamint a mindennapi életük családi helyzeteivel kapcsolatban, az előző tanulmányban leírtak szerint [8]. A mentális stressz súlyosságát az összes válasz összegével számoltuk. A mentális stresszt három csoportba sorolták, például enyhe stressz (30%), magas hiányzó genotípus hívási arány (≥4%), nemi elfogultság vagy Hardy-Weinberg egyensúlyi teszt (P 0,05), és nem túl konzervatív (a kötés egyensúlyhiánya, P 8.) Kétirányú varianciaanalízist (ANOVA) végeztek a szubkután zsír- és GRS-kategóriák szerinti statisztikai különbségek feltárására minden egyes állandó változóban, például életkor, szubkután zsír, szérum összes koleszterinszint, HDL-koleszterin, LDL-koleszterin, triglicerid és glükóz, HOMA-IR és HOMA-B.
A GRS összefüggését a szubkután zsír kockázatával és a szubkután zsírral kapcsolatos paraméterekkel logisztikus regressziós elemzéssel vizsgáltuk, miután két különböző kovariát-halmazra állítottunk be, mint az 1. és a 2. modell. Az 1. modell a tartózkodási területet, a nemet, az életkort és a BMI-t tartalmazta. kovariánsok. A 2. modell tartalmazta az 1. modellt, plusz a dohányzási állapotot, az ivási állapotot, a kávéfogyasztást, a fizikai aktivitást, az energiafogyasztást és a zsírbevitelt energia százalékban. Az odds arányokat (OR) és a 95% konfidencia intervallumokat (CI) az alacsony GRS-re alapozva számítottuk ki.
A GRS és az életmód közötti kölcsönhatás meghatározása érdekében, ideértve az étrendi bevitelt is, többváltozós általános lineáris modell (GLM) elemzést és interakciót végeztek a szubkután zsírtömeg fő hatásainak és az életmóddal való kölcsönhatásának értékelésére a kovariánsok kiigazítása után. Mivel interakció volt a többváltozós GLM-ben, a logisztikus regressziós elemzést két csoportban végeztük, az életmód minden paraméteréhez hozzárendelt cutoff-ot használva. Az egyes paraméterek határértékeit a táblázat jelmagyarázata tartalmazza. Az alanyokat magasabb és alacsonyabb beviteli csoportokba soroltuk az osztályozási kritériummal. P-a ≤0,05 értéket statisztikailag szignifikánsnak tekintettük.
Eredmények
Kohort jellemzői
Az alanyok és a tápanyagbevitel jellemzőit a szubkután és a zsigeri zsírtömeg szerint összegeztük (1. táblázat). A HS-LV és az LS-LV csoportok fiatalabbak voltak, mint a HS-HV és az LS-HV csoportok (P 2. táblázat Az antropometriai és metabolikus paraméterek kiigazított átlaga és szórása a szubkután és a zsigeri zsírtömegek szerint 1
A szubkután zsírtömeghez kapcsolódó genetikai variánsok kiválasztása.
Mivel a zsírtömegről ismert, hogy gyulladással és ösztrogénjelzéssel társul, a gyulladásos és az ösztrogénjelzésben részt vevő géneket választották ki a GMDR számára (3. táblázat). A végső GMDR elemzés 10 SNP-t tartalmazott, mint például az interleukin 17A (IL17A) rs4711998, interleukin 5 receptor alfa alegység (IL5RA) rs2290610, IL5RA rs2290610, ösztrogénnel kapcsolatos gamma receptor (ESRRG) rs4846514, a citoplazmatikus FMR1 kölcsönhatásba lépő fehérje 2 (CYFIP2) rs733730, 7. transzkripciós faktor, mint 2 (TCF7L2) rs7917983, cinkujjfehérje 766 (ZNF766) rs41497444, kontaktin 4 (CNTN4) rs17024684, transzformáló növekedési faktor béta receptor 3 (TGFBR3) rs7526590 és adenilát-cikláz 2 (ADCY2) rs326149 (3. táblázat). Az SNP-k OR-jai jelezték, hogy az SNP-k kisebb alléljai nőttek (OR> 1) vagy csökkentek (0 3. táblázat: Az általánosított multifaktoros dimenziós redukció elemzéséhez használt tíz genetikai variáns jellemzői
A szubkután zsírtömeghez kapcsolódó gén-gén kölcsönhatások legjobb modellje
A legjobb modellt jelvizsgálattal választották ki a GMDR modell és a CVC számára. A legjobb modell 7 SNP-t tartalmazott: IL17A rs4711998, IL5RA rs2290610, ESRRG rs4846514, CYFIP2 rs733730, TCF7L2 rs7917983, ZNF766 rs41497444 és TGFBR3 rs7526590 (4. táblázat). Ez a modell ezt mutatta ki P = 0,001 a jelvizsgálatnál és a CVC = 10 (P = 0,001) az életkor, nem, terület, BMI kiigazításával és anélkül. A legjobb modell TRBA és TEBA értéke 0,7216 és 0,5605 volt a modellben, az életkor, nem, terület és BMI alapján történő kiigazítás után (4. táblázat).
A szubkután zsírra beállított OR-ok a legjobb modell GRS-jével
A szubkután zsírtömeggel és a dislipidémiával kapcsolatos paraméterek logisztikai regressziós elemzését az 1. modell lakóterületének, nemének, életkorának és BMI-jének, valamint az 1. modell zavaró tényezőinek, valamint a derékkörfogatnak, a csípőkörfogatnak, a testzsírnak, az alkoholnak az alkalmazását követően végeztük és a kávéfogyasztás, a fizikai aktivitás, a dohányzás állapota és az energiafogyasztás a 2. modell esetében. A magas GRS csoportba tartozó alanyok szubkután zsírtömege 2,317, illetve 2,232-szerese volt az 1. és a 2. modellben (P 5. táblázat: A metabolikus betegség kockázati tényezőinek korrigált esélyhányadosa a szubkután zsírlerakódás 7. modelljének genetikai kockázati pontszámai (GRS) szerint
A GRS és az életmód kölcsönhatása, beleértve a tápanyag bevitelt
A GRS-nek nem volt interakciója a napi energia-, szénhidrát-, zsír- vagy fehérjebevitelekkel a szubkután zsírtömeg modulálásához (6. táblázat). A telített, egyszeresen és többszörösen telítetlen zsírsavbevitel nem lépett kölcsönhatásba a GRS-szel a szubkután zsírtömeg befolyásolására. A tápanyagbevitel mellett az alkohol és a kávé bevitele nem volt kölcsönhatásban a GRS-szel, hogy befolyásolja a szubkután zsírt (6. táblázat). A fizikai aktivitás azonban kölcsönhatásba lépett a GRS-szel a szubkután zsír modulálására (P = 0,002). Alacsony fizikai aktivitás esetén a magas GRS-t mutató alanyoknál a szubkután zsír 2,589-rel növekedett az alacsony GRS-hez képest (P 6. táblázat Az étrendi és életmódbeli tényezők és a genetikai kockázati pontszámok (GRS) kölcsönhatása a 7 1 modellben a szubkután zsírtartalom kockázatában
Vita
Ez a tanulmány értékelte a szubkután zsír magas genetikai kockázati pontszámának (GRS) a zsírmegosztásra és az anyagcsere-betegségek kockázatára gyakorolt hatását emberi populációban, valamint a viscerális és a bőr alatti zsír hatását az anyagcsere betegségre. Eredményeink megerősítették, hogy a magas GRS több mint kétszeresére növeli annak valószínűségét, hogy nagyobb a szubkután zsírtömeg. Megerősítettük azt is, hogy a magas viszcerális zsírtömeg, nem a szubkután zsírtömeg, a metabolikus szindróma kockázati tényezője. Azonban a szubkután zsír magas GRS-je nem bizonyítható, hogy megvéd a metabolikus betegségektől, annak ellenére, hogy növelte a szubkután zsírt. Ez részt vehet a GRS-sel végzett vizsgálatok tantárgyainak kiválasztásában. Kizártuk az alacsony viscerális zsírtömegű alanyokat, amikor az 1-es és 2-es modellekben a BMI-t módosítottuk, mivel nagy különbséget mutattak a teljes zsírban és a BMI-ben a magas és az alacsony szubkután zsírcsoportok között. A GWAS és genetikai variánsokkal kapcsolatos vizsgálatokat hasonló teljes zsírtömegű HS-HV és LS-HV csoportokkal végeztük.
A zsigeri és a szubkután zsírszövet közötti különböző hatások okai nem teljesen tisztázottak. Ennek oka részben a zsigeri zsírtól származó önkorlátozó visszacsatolás hiánya lehet, amely megakadályozná annak korlátlan tágulását. Az adiponektin és a leptin szekréciója egyaránt szerepet játszik a testzsír és az anyagcsere szabályozásában. A leptin termelése azonban elsősorban a bőr alatti zsírból származik, és nem a zsigeri zsírszövetből [26]. Hasonlóképpen, a növekvő BMI csökkenti az általános adiponectin szekréciót, de szövetspecifikus a zsigeri zsírszövet csökkenésével, de nem a szubkután zsírszövetben [4]. Ezért ennek a két fontos adipokinnak a termelése, amelyek korlátozhatják a tágulását és megakadályozhatják a zsír okozta diszlipidémiát, úgy tűnik, hogy a zsigeri zsírszövetben szövetspecifikusan korlátozottak, a szubkután zsírszövetben azonban nem.
Ennek a tanulmánynak fontos korlátai vannak. Keresztmetszeti jellegű, ezért az ok-okozati összefüggéseket nem lehet értékelni. A bőrredő mérése a szubkután zsírtömeg meghatározásához nagyon pontos, bár általában használják nagyszabású vizsgálatokban [11]. Ebben a tanulmányban szakképzett technikusok jó minőségellenőrzéssel mérték meg, és megbízhatónak bizonyították. Ezenkívül a genetikai és életmód-kölcsönhatások bonyolultsága a zsírmegosztással nem teljesen ismert, és néhány fontos tényezőt nem biztos, hogy megfelelően kontrolláltak a GRS-modellekben. Ezenkívül a fruktózfogyasztás ismert módon hozzájárul a zsigeri zsír felhalmozódásához, de az adatok nem foglalkoztak kifejezetten az étrendi fruktózzal, csak a szénhidrát egészével.
Következtetés
Kimutattuk, hogy a magas viszcerális zsír diszlipidémiához és vércukorszint-szabályozáshoz vezetett a koreai felnőtt populációban ebben a vizsgálatban. Noha a zsigeri zsír káros anyagcsere-hatása kifejezettebb volt, mint a szubkután zsír esetében, és a szubkután rekeszbe osztódás előnyös lenne, az alacsony viscerális és szubkután zsírral rendelkező alanyok mutatják a legjobb anyagcsere-profilt. A tanulmány fő új megállapításai az voltak, hogy a magasabb szubkután zsírlerakódás GRS-je genetikai variánsokból állt, amelyek befolyásolták a proinflammatorikus citokin jelátvitelt, és a GRS a koreai populáció, és esetleg az ázsiai populációk egyik fő genetikai előrejelzője lehet a bőr alatti zsírnak. A szubkután zsírtartalom csak a fizikai aktivitással lépett kölcsönhatásba, és a genetikai hatás magas fizikai aktivitással elkerülhető, ha magas GRS-sel rendelkező hordozókat akarnak.
Az adatok és anyagok rendelkezésre állása
A jelen vizsgálat során felhasznált adatkészletek ésszerű kérésre a megfelelő szerzőtől kaphatók.
- Az elhízással kapcsolatos egészségügyi kockázat és a fitnesz teszt eredményei közötti összefüggés a brit hadseregben
- A közelmúltban kialakuló cukorbetegség, a hasnyálmirigy-rák fokozott súlycsökkenése az ACP-cukorbetegséget veszélyezteti
- Az elhízás a hasmenés szignifikánsan megnövekedett kockázatával jár az ellenőrzés után
- Növényi étrend egészséges tesztoszteronszinttel társítva; News-Medical
- Elhízás és krónikus veseelégtelenség kockázata American Society of Nephrology