A terhesség helyreállítja a hasnyálmirigy-szigetek inzulinszekrécióját a cafeteria étrend által kiváltott elhízott patkányokban
Anatómiai, Sejtbiológiai, Élettani és Biofizikai Tanszék, Biológiai Intézet, Campinas Állami Egyetem, Campinas, Brazília
Anatómiai, Sejtbiológiai, Élettani és Biofizikai Tanszék, Biológiai Intézet, Campinas Állami Egyetem, Campinas, Brazília
Anatómiai, Sejtbiológiai, Élettani és Biofizikai Tanszék, Biológiai Intézet, Campinas Állami Egyetem, Campinas, Brazília
Anatómiai, Sejtbiológiai, Élettani és Biofizikai Tanszék, Biológiai Intézet, Campinas Állami Egyetem, Campinas, Brazília
Anatómiai, Sejtbiológiai, Élettani és Biofizikai Tanszék, Biológiai Intézet, Campinas Állami Egyetem, Campinas, Brazília
Anatómiai, Sejtbiológiai, Élettani és Biofizikai Tanszék, Biológiai Intézet, Campinas Állami Egyetem, Campinas, Brazília
Anatómiai, Sejtbiológiai, Élettani és Biofizikai Tanszék, Biológiai Intézet, Campinas Állami Egyetem, Campinas, Brazília
Anatómiai, Sejtbiológiai, Élettani és Biofizikai Tanszék, Biológiai Intézet, Campinas Állami Egyetem, Campinas, Brazília
Az újranyomtatási kérelmek és egyéb levelezések címe: A. C. Boschero, Anatómiai, Sejtbiológiai, Élettani és Biofizikai Tanszék, Biológiai Intézet, State Univ. (Unicamp), Campinas, SP (e-mail: [e-mail védett]).
Absztrakt
a terhesség perifériás inzulinrezisztenciával jár, amelyet normális körülmények között az inzulinszekréció fokozódása kompenzál (3, 19, 30). A hasnyálmirigy-szigetek a terhesség alatt jelentős strukturális és funkcionális változásokon mennek keresztül, hogy kielégítsék ezt a megnövekedett inzulinigényt (1, 30, 34). Ezek a változások patkányokban kb nap 14–16 terhesség alatt, és a placenta laktogének és/vagy prolaktin hormonok fontos szerepet játszanak ebben a folyamatban (6, 8, 23, 33).
Azok a mechanizmusok, amelyek a β-sejtek terhesség alatti nagyobb inzulinigényre reagálni képes képességének növeléséért felelősek, nagyon relevánsak a 2-es típusú cukorbetegséggel kapcsolatos tanulmányok összefüggésében, mivel nyomokat adhatnak a lehetséges terápiákra. Az anyai β-sejtek képtelenség reagálni a megnövekedett inzulinigényre glükóz intolerancia és terhességi diabetes mellitus kialakulásához vezethet (10, 11).
A kísérleti elhízás számos modelljét alkalmazták eddig. Közülük a zsírban gazdag étrend alkalmazása érdekes megközelítés, mivel szorosan hasonlít az emberek túlzott táplálékfelvételére, hatással van az energiafelhasználás szabályozásában részt vevő specifikus szövetekre (9, 36). Ennek a modellnek a javulása a cafeteria étrend használata, amely még közelebb áll az emberi táplálékfelvételhez, mivel ízletesebb, erősen növeli az adipozitást, és javasolták az emberi elhízáshoz legjobban illeszkedő rágcsáló modellnek (25, 27, 28).
Ebben a tanulmányban glükóz homeosztázist és hasnyálmirigy-szigetek funkcionalitását vizsgáltuk nem vemhes és vemhes cafeteria étrend okozta elhízott patkányokban. Megállapítottuk, hogy az elhízott cafeteria által táplált vemhes és nem vemhes patkányokban a glükóz tolerancia romlik. A cafeteria diéta által kiváltott elhízás rontja a glükóz, tolbutamid és KCl által kiváltott inzulinszekréciót a frissen izolált szigeteken. Ezt a gátló hatást azonban a vemhes patkányok szigetein legyőzik, valószínűleg a metabolikus aktivitás növekedésének eredményeként, amely a jobb intracelluláris Ca 2+ kezeléshez kapcsolódik, különös Ca 2+ beáramlás esetén.
A kutatások során az állatok etikus használatára vonatkozó összes alkalmazandó intézményi és kormányzati előírást betartották. A kísérleti eljárásokat az egyetem állatkísérleti etikai bizottsága hagyta jóvá a Campinasi Állami Egyetemen (1198-1 protokollszám).
Vegyszerek.
d - [U-14 C] glükózt és 125 I-humán rekombináns inzulint a G. E. Health Care-től (Little Chalfont, Buckinghamshire, Egyesült Királyság) vásároltunk. Az MTS/PMS előállítása CellTiter96 vizes vizsgálati eljárásból származik (Promega, Madison, WI). A plazma összkoleszterin (CHOL), trigliceridek (TG) (mindkettő a Roche Diagnostics; Mannheim, Németország) szabad zsírsavak (FFA; Wako Chemicals, Neuss, Németország), valamint az albumin és az összes fehérje (Laborlab) mérésére standard kereskedelmi készleteket használtak.; Guarulhos, SP, Brazília). A Fura-2 AM-t az Invitrogen-től (Carlsbad, Kalifornia) szereztük be. A szokásos reagenseket a Sigma-Aldrich-től (St. Louis, MO) szereztük be.
Állatok, étrend és étrend összetétele.
Állati jellemzők.
Az etetési periódus végén és a vemhesség 15.-16. Napján a patkányokat lefejezéssel leöltük, és megmérettük a perigonadal és a retroperitoneális zsírpárna súlyát. A vércukorszintet glükózanalizátorral (Accu-Check Advantage II, Roche, Basel, Svájc) mértük. A plazma CHOL-, TG-, FFA-, albumin- és teljes fehérjéket standard kereskedelmi készletekkel mértük a gyártó utasításainak megfelelően. Az inzulint RIA-val mértük standard patkány inzulin alkalmazásával.
Intraperitoneális glükóz tolerancia teszt.
A vemhesség kezdete után 14–15 nappal az összes patkánycsoportot intraperitoneális glükóz tolerancia tesztnek vetették alá (ipGTT). Az ételt 12 órával a kísérlet előtt kivontuk, majd a patkányokat lemértük, és a farok hegyéből vettünk egy bazális vérmintát (t = 0 perc). Ezt követően mindegyik patkány glükózoldat-terhelést kapott (2 g/ttkg testtömeg-kg), és további vérmintákat gyűjtöttek az injekció beadása után 15, 30, 60 és 120 perccel. A teszt során a glükózszintet azonnal megmértük. A görbe alatti területet az egyes patkányok értékei alapján számoltuk ki.
Sziget szigetelés, inzulin szekréció és inzulin tartalom.
Szigeteket etettek patkányokból (vemhes vagy nem; 14 hetes kezelés, vemhesség 15./16. Napja) hasnyálmirigy kollagenázos emésztésével izoláltuk, majd mikroszkóp alatt mikropipettával szelektáltuk a szennyező szövetek kizárására. A négy szigetecske csoportjait először 45 percig inkubáltuk 37 ° C-on 5,6 mmol/l glükózt tartalmazó Krebs-Ringer-hidrogén-karbonát-pufferben (KRB), amelyet 95% O2-5% CO2-val (pH 7,4) egyensúlyoztunk. Az oldatot ezután friss KRB-re cseréltük, és a szigeteket további 90 percig inkubáltuk 2,8, 5,6, 8,3, 11,1, 16,7 vagy 27,7 mmol/l glükózt tartalmazó táptalajjal; 2,8 mmol/l glükóz plusz 40 mmol/l KCl; vagy 2,8 mmol/l glükóz plusz 100 μmol/l tolbutamid. Az inkubációs közeg (mmol/l): 115 NaCl, 5 KCl, 24 NaHCO3, 2,6 CaCl2, 1 MgCl2 és 25 HEPES-t tartalmazott; pH 7,4, BSA-val kiegészítve (0,3 tömeg/térfogat%; Sigma). A teljes inzulintartalom méréséhez 10 szigetből álló csoportokat gyűjtöttünk és 1,5 ml-es csövekbe helyeztünk. Alkohol-savas oldatot (1 ml; 20% etanol és 0,2 mmol/l HCl végső koncentrációja) adtunk a mintákhoz, majd a hasnyálmirigy-szigeteket ultrahanggal kezeltük (háromszor, 10 másodperces impulzusok). A táptalajban lévő inzulint RIA-val mértük.
DNS-vizsgálat.
A hasnyálmirigy-szigeteket rövid ultrahangos szünetekkel 500 μl 50 mmol/l Tris-HCl, 10 mM EDTA, 1% SDS (pH 8,1) tartalmú pufferben homogenizáltuk. A DNS-t fenol/kloroform eleggyel extraháltuk, etanolban kicsaptuk és alacsony Tris-EDTA pufferben szuszpendáltuk. Az RNS-t ezt követően emésztéssel eltávolítottuk 1 μg RNáz A-val (Sigma) 30 percig, 37 ° C-on. Így a DNS-t kereskedelmi készlet (Quant-iT PicoGreen, Invitrogen) segítségével számszerűsítettük, a kézikönyv utasításainak megfelelően.
Glükóz oxidáció.
A 25 szigetecske csoportjait 2 órán át 37 ° C-on inkubáltuk KRB-ben, 11,1 mmol/l glükózzal kiegészítve nyomokban d - [U-14 C] glükózzal (20 μCi/ml) 14 CO2 képződéshez. A szigeti glükóz metabolizmust HCl-lel (1 N) állítottuk le, ennek következtében a sejtek hasadtak. A felszabadult 14 CO2-ot NaOH-val (1 mol/l) 1 órán át 4 ° C-on abszorbeáljuk, így NaH 14 CO 3 -ot kapunk. Szcintillációs folyadékot adunk hozzá, és a radioaktivitást folyadék szcintillációs számlálóval számláljuk.
Metabolikus aktivitás.
A szigetek metabolikus aktivitását redukciós ekvivalensek, nevezetesen a NAD (P) H mérésével értékeltük, egy vízoldható tetrazóliumsó, MTS (3- [4,5, dimetil-tiazol-2-il] -5- [3-karboxi-metoxi) redukciójával. -fenil] -2- [4-szulfofenil] -2H-tetrazolium, belső só) a megfelelő formazán-termékhez egy élő szövetrendszerben (29., 33.). Erre a célra 100 frissen izolált szigetcsoportot inkubáltunk 150 percig Krebs/HEPES steril pufferben, amely 11,1 mmol/l glükózt, 15% MTS-t és 1% fenazin-metoszulfátot (PMS) tartalmazott. Az abszorbancia 490 nm-en, 10 percenként a reagensoldat hozzáadása után, a gyártó utasításainak megfelelően történt.
Az intracelluláris Ca 2 mérése+ .
Valós idejű PCR.
A teljes sejtes RNS-t 500 szigetből álló csoportokból extraháltuk TRIzol-reagenssel. Két mikrogramm teljes RNS-t fordítottunk át reverz transzkriptáz és véletlenszerű hexamer primerek alkalmazásával. A valós idejű PCR reakciókat 15 μl teljes térfogatban hajtottuk végre a Fast SYBR Green technológiával (Applied Biosystems, Foster City, CA). A mintákat 10 percig 94 ° C-on denaturáltuk, majd 40 PCR-ciklust folytattunk 95 ° C/60 ° C-on. A PCR-amplifikációkat két példányban hajtottuk végre. Az amplifikált PCR-termékek tisztaságát olvadási görbékkel igazoltuk. A célgének expresszióját a háztartási GAPDH expressziós szintjéhez viszonyítva normalizáltuk. Az alkalmazott láncindítók szekvenciája (5′-3 ’) volt: szarkoplazmatikus/endoplazmatikus retikulum Ca 2+ ATPáz 2a (SERCA2a) előre: TGGTACTGGCTGATGATAACTTCTCC, fordított: TGTTGTTGTAGATGGCACGGC; L-típusú-α1.2 alegység feszültségérzékeny Ca 2+ csatorna (CaVα1.2) előre: GACACAGAGAGGAGATTTCAAGGG, hátra: GCGTGGGCTCCCATAGTTG; L-típusú-β2 alegység feszültségérzékeny Ca 2+ csatorna (CaVβ2) előre: TGCACTGGAGTATCCAAGCG, hátra: CCACTTCGTCTCAGCCACTC.
Statisztikai analízis.
Az adatokat átlagként ± SE-ben fejeztük ki a patkányok és a minták számára (n) jelzett. A statisztikai elemzést a Student's végezte t-teszt vagy kétirányú ANOVA, majd a Newman-Keuls utóteszt. P 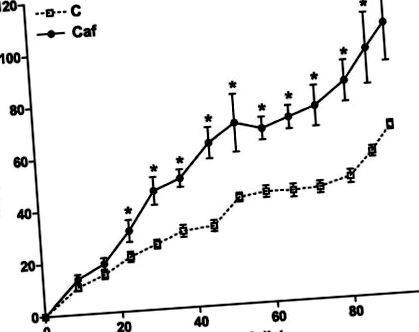
1. ábra.A táplálkozási periódus alatt a súlygyarapodást hetente mértük patkányokkal, akiket chow (szaggatott vonalak; C) vagy cafeteria (folytonos vonalak, Caf) táplálékkal etettek. A kezdeti testtömeg 218 ± 3 g és 215 ± 4 g volt C és Caf esetében (nem szignifikáns). Az értékeket átlag ± se-ként fejezzük ki; n = 10–20 patkány minden csoportnál. *P
1. táblázat Testsúly és zsírpárna súlya a diétás kezelés végén
Az értékeket átlag ± SE-ként fejezzük ki. C, nem terhes; CP, terhes; Caf, cafeteria diéta nem terhes; és a CafP, a cafeteria diéta terhes.
2. táblázat Vemcukor, plazma inzulin, CHOL, TG, FFA, albumin és összes fehérje szint, valamint inzulin/glükóz index a nem vemhes és vemhes patkányoknál, akik chow vagy cafeteria étrendet fogyasztottak
Az értékeket átlag ± SE-ként fejezzük ki. Ins/Glu, inzulin/glükóz; CHOL, koleszterin; TG, trigliceridek; FFA, szabad zsírsavak.
* P † P ‡ P § P −1 · min −1] (P
2. ábra.Vércukorszint (A) és a plazma inzulin (B) nem vemhes (szilárd szimbólumok) és vemhes (nyitott szimbólumok) patkányok intraperitoneális glükóz tolerancia tesztjén (ipGTT) 14. nap és 15 patkányokon, akiket chow (szaggatott vonalak) vagy cafeteria (folytonos vonalak) táplálékkal tápláltak. Az értékeket átlag ± se-ként fejezzük ki; n = 6–20 patkány három különböző kezelt csoportból. A szimbólumok a csoportok közötti statisztikai különbségeket ábrázolják: *P
Sziget-inzulin-tartalom és inzulinszekréció, amelyet glükóz, KCl és tolbutamid indukál.
A terhesség növelte a teljes inzulintartalmat a CafP patkányok szigeteiben a többi csoporthoz képest (43,7 ± 3,7 vs. C 15,6 ± 1,2; CP 19,1 ± 1,5; Caf 12,6 ± 1,1, ng/ng DNS P
3. ábra.Összehasonlító glükóz-dózis-válasz görbék nem vemhes (szilárd szimbólumok) és vemhes (nyitott szimbólumok) patkányok izolált szigeteihez, amelyeket chow (szaggatott vonalak) vagy cafeteria (folytonos vonalak) étrenden táplálnak. A szigeteket 90 percig inkubáltuk növekvő glükózkoncentrációval, és a felszabaduló inzulint a megfelelő szigetecske DNS-tartalma normalizálta. Az értékeket átlag ± se-ként fejezzük ki; n = 8-15 szigetcsoport három különböző patkányból. A szimbólumok a csoportok közötti statisztikai különbségeket mutatják a glükóz egyes koncentrációiban: #P
4. ábra.KCl és tolbutamid által indukált inzulinszekréció, 2,8 mmol/l glükóz koncentrációban, C, CP, Caf és CafP patkányok izolált szigeteiben. Az inzulin értékeket a megfelelő szigetecske DNS-tartalommal normalizáltuk. Az értékek átlag ± se; n = 8-10 szigetcsoport három különböző patkányból. Az egyes oszlopok tetején található szimbólumok a csoportok közötti statisztikai különbségeket jelölik, *P
Glükóz oxidáció és metabolikus aktivitás.
Mivel a β-sejtek inzulinszekréciója szorosan kapcsolódik a glükóz metabolizmusához, elemeztünk néhány metabolikus indikátort elhízott és vemhes patkányok szigetein. 11,1 mmol/l glükóznál a d - [U-14 C] glükóz konverzió 14 CO2-ra (glükóz oxidáció) magasabb volt a CafP patkányok szigeteinél, összehasonlítva a többi csoporttal (CafP 2,9 ± 0,1 vs. C 2,1 ± 0,2; CP 2,0 ± 0,1 és Caf 1,9 ± 0,1 pmol/ng DNS · 2 óra; P
5. ábra.A szigetek 11,1 mmol/l glükózzal stimulált metabolikus aktivitása, amelyet a szigetek DNS-tartalma normalizál. Az értékek átlag ± se; n = 12 tétel szigetecske három különböző patkányból. Az egyes oszlopok tetején található szimbólumok statisztikai különbségeket mutatnak a csoportok között az egyes időpontokban, #P
Glükóz- és tolbutamid-indukált citoplazmatikus Ca 2+ változások.
A hasnyálmirigy-szigetek 11,1 mmol/l glükóznak való kitétele után a citoszolos Ca 2+ koncentráció minden csoportban megnőtt (6. ábra, A-D). A Ca 2+ -változások amplitúdója 3–6 perc glükóz-expozíció után mérten szignifikánsan alacsonyabb volt a Caf-szigeteken, összehasonlítva a másik három csoporttal (6. ábraE) (P A 2+ koncentrációt a tolbutamid (100 μmol/l) is növelte minden csoportban, és a görbe alatti terület kisebb volt a Caf-ban a C-szigetekhez képest (0,72 ± 0,14 vs. 1,20 ± 0,10 F340/F380 · perc; P
6. ábra.Az intracelluláris Ca 2+ koncentráció változásainak reprezentatív görbéi a C (A), CP (B), Caf (C) és a CafP (D) patkányok. Az átlag ± se képviseli az amplitúdót arányegységekben (E), gyakorisága (F) és az oszcillációk amplitúdója arányegységekben (G) [Ca 2+] i koncentrációja 11,1 mmol/l glükózban. n = 6–10 szigetecske három különböző patkánytól; az oszlopok fölötti azonos betűk a csoportok közötti hasonlóságot jelzik, P
Cavα1.2, Cavβ2 és SERCA2a génexpresszió.
Mindkét Cavα1,2 csökkenése (64% vs. C; P
7. ábra.A Cavα1.2 valós idejű PCR-meghatározása (A), Cavβ2 (B) és a SERCA2a (C) mRNS-expressziók C, CP, Caf és CafP patkányok izolált szigeteiben. Az adatokat korrigáltuk a GAPDH expresszió szempontjából, és a C százalékában vannak feltüntetve; jelentése ± se; n = 5–8. Az egyes oszlopok tetején található szimbólumok a csoportok közötti statisztikai különbségeket jelölik, *P
Az elhízott, vemhes és nem vemhes patkányokban megfigyelt csökkent glükóz tolerancia összhangban áll számos megfigyeléssel, amelyek azt mutatják, hogy az elhízás inzulinrezisztenciát vált ki (4, 16, 22, 25). Érdekes módon az éheztetett és táplált plazma glükóz normális az inzulinrezisztens patkányokban, különösen a terhes csoportokban, ami azt jelzi, hogy a magasabb plazma inzulinszint elegendő a normoglikémia fenntartásához. Között az endogén inzulinnal szembeni rezisztencia alakul ki 16. nap és 19. terhesség (18), igazolva a vemhes chow-diéta patkányokban megfigyelt normális inzulinszintet az ipGTT során a vemhesség 14. és 15. napján.
Korábban megfigyelték a magas szénhidráttartalmú, magas fehérjetartalmú vagy magas lipidtartalmú táplálékkal táplált patkányok szigeteiben a glükóz által stimulált inzulinszekréció csökkenését (31). Így várható, hogy az elhízott cafeteria patkányok is alacsonyabb inzulin felszabadító képességet mutatnak. Ennek ellenére ennek a képességnek a helyreállítása terhesség alatt alapvető fontosságú, és az intenzívebb inzulinszekrécióhoz vezető intracelluláris eseményekkel kapcsolatos információk még nem ismertek. Ezért az elhízott patkányok hasnyálmirigy-β-sejtjeiben a terhesség alatt fokozott metabolikus aktivitást, javult Ca 2+ -kezelést és az inzulin szekréció helyreállítását mutató eredményeink tudomásunk szerint az első adatok, amelyek hozzájárulnak ennek molekuláris mechanizmusának tisztázásához. jelenség. Másrészről eltér a csökkent telített zsírtartalmú vemhes elhízott patkányoknál megfigyelt csökkent inzulinszekréciótól (15). Megértjük, hogy a különböző megállapítások különböző tudományos stratégiák eredményei lehetnek (a diéta típusa és ideje, valamint a terhesség ideje), de nyilvánvaló, hogy a cafeteria étrend sokkal közelebb áll az emberi táplálkozáshoz, mint más kísérleti modellek.
Perspektívák és jelentőség
Jelen megfigyelések azt mutatják, hogy a cafeteria diéta elhízást és inzulinrezisztenciát vált ki, valamint csökkenti a glükóz és más depolarizáló szerek által stimulált inzulin szekréciót. Az elhízás gátló hatása az inzulin szekréciójára a szigetek Ca2 + -mobilizációjának hibájából adódik, függetlenül a szigetek anyagcseréjétől. A terhesség helyreállítja az elhízott patkányok szigeteinek szekréciós képességét, amely a Ca 2+ kezelésére szolgáló β-sejtek helyreállításához kapcsolódik, különösen a Ca 2+ felvételi kapacitás növelésével. Úgy tűnik, hogy ez a jelenség - legalábbis részben - az L-típusú Ca 2+ csatornák α1.2 alegységének expressziójának növekedésétől függ. Ezenkívül a terhesség alatt a hasnyálmirigy-szigetek metabolikus aktivitása fokozódik elhízott patkányokban, ami növelheti a hasnyálmirigy β-sejtjeinek glükózreakcióját. További tanulmányok, amelyek célja az elhízás káros hatásainak tisztázása a Ca 2+ mozgásokra és az inzulin szekréciójára, valamint olyan szerek felfedezése, amelyek segítik a szigetecske sejtjeit ilyen képesség helyreállításában a terhes állapotban, segíthetnek a normoglikémia fenntartásának stratégiáiban 2. típusú cukorbeteg elhízott betegek.
A szerzők nem jelentenek be összeférhetetlenséget.
- A splenectomia gyengíti az elhízást és csökkenti az inzulin hiperszekrécióját a hipotalamusz elhízott patkányaiban -
- Multiorganikus inzulinérzékenység sovány és elhízott alanyok cukorbetegségének kezelésében
- Osteopontin szükséges a magas zsírtartalmú étrend okozta inzulinrezisztencia korai megjelenéséhez egerekben
- A világ népességének csaknem egyharmada elhízott vagy túlsúlyos, az új adatok szerint az Institute for
- Tűhossz elhízott inzulint használó cukorbetegeknél - Teljes szöveg nézet