A tRNS 37. pozíciójában lévő purinbázisok egymással és Mg 2+ -függő kölcsönhatásokkal stabilizálják a kodon – antikodon kölcsönhatást a riboszomális A helyen.
ANDREY L. KONEVEGA
1 Petersburg Nuclear Physics Institute, Orosz Tudományos Akadémia, 188300 Gatchina, Oroszország
NATALIA G. SOBOLEVA
1 Petersburg Nuclear Physics Institute, Orosz Tudományos Akadémia, 188300 Gatchina, Oroszország
VALENTIN I. MAKHNO
1 Petersburg Nuclear Physics Institute, Orosz Tudományos Akadémia, 188300 Gatchina, Oroszország
YURI P. SEMENKOV
1 Petersburg Nuclear Physics Institute, Orosz Tudományos Akadémia, 188300 Gatchina, Oroszország
WOLFGANG WINTERMEYER
2 Molekuláris Biológiai Intézet és
MARINA V. RODNINA
3 Fizikai Biokémiai Intézet, Witten Egyetem/Herdecke, 58448 Witten, Németország
VLADIMIR I. KATUNIN
1 Petersburg Nuclear Physics Institute, Orosz Tudományos Akadémia, 188300 Gatchina, Oroszország
Absztrakt
BEVEZETÉS
A kodon és az antikodon közötti kölcsönhatás központi szerepet játszik a riboszómán dekódoló mRNS-ben. Az antikodon hurok kanonikus szerkezete elengedhetetlen mind az A, mind a P hellyel való kölcsönhatáshoz (Yusupov és mtsai 2001), és evolúciós szempontból konzervált. Az antikodonhurkot számos konzervált és félkonzervált nukleotid jelenléte határozza meg, amelyek kiterjesztett szerkezeti aláírást alkotnak (Auffinger és Westhof 2001). A hurok 5 ′ végén egy pirimidinbázis található a 32. pozícióban, amelyet egy invariáns U követ a 33. pozícióban. A 34. pozícióban különféle módosított nukleotidok találhatók, amelyek bázispárosodnak a kodon 3. pozíciójáig, míg a 35 nt. és a kodon 2. és 1. pozíciójával kölcsönhatásba lépő, és csak korlátozott számú módosítást mutat be. A 37. és 38. helyzetben lévő bázisok többnyire purinok, amelyek a 37. helyzetben gyakran hipermodifikálódnak. A különböző organizmusokból származó> 3000 tRNS-gének szekvencia-analízise azt mutatja, hogy A a 37-es pozícióban található
80% és G az összes tRNS 20% -ában (Sprinzl és mtsai 1998). Ban ben
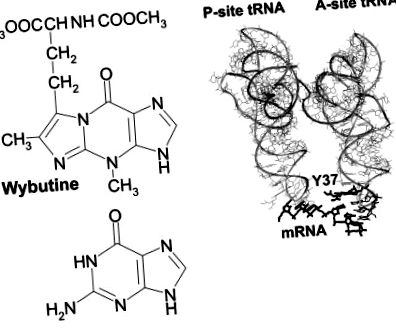
A tRNS-ek 26% -ában módosítatlan A található; a 37-es helyzetben a leggyakoribb módosítások a t 6 A és m 1 G. A módosítás típusa a kódolási specifitástól függ. Általánosságban azoknak a tRNS-eknek, amelyek antikodonjaiban csak G és C bázis van, soha nincs módosított purin az antikodon 3'-oldala mellett, míg az összes legalább két A vagy U bázissal rendelkező tRNS-ben hipermodifikált purin van ebben a helyzetben. Például szinte az összes fenilalanin-specifikus tRNS (anticodon GAA) rendelkezik ilyen módosítással, leggyakrabban a wybutinnal (1. ábra ▶), a peroxivibutinnal vagy a 2-metiltio-N6-izopenteniladeninnel.
(A) Az Y-bázis felépítése (a wybutinnál általánosan használt szimbólum, a szisztematikus yW szimbólum; Az RNS módosítási adatbázis, http://medlib.med.utah.edu/RNAmods) G.-hez képest. (B) Az Y-bázis elrendezése (Y37) az élesztő tRNS Phe és U6-mRNS komplexében a Thermus thermophilus riboszómák A helyén (Yusupov és mtsai 2001); A P-hely tRNS-t is bemutatjuk. Az Y37 és az U6-mRNS kiemelésre kerül.
Modellrendszerekben végzett vizsgálatok azt mutatják, hogy a 37-es helyzetben lévő bázismodifikációk stabilizálják a tRNS • mRNS-kölcsönhatásokat azáltal, hogy javítják az antikodon hurokban belüli intrasztrand halmozódást, valamint a kodon és antikodon bázisok közötti intertrand szálakat (Grosjean és mtsai 1998). Két tRNS komplementer antikodonokkal rendelkező modellrendszerének felhasználásával kimutatták, hogy a tRNS • tRNS komplex hat nagyságrenddel stabilabb, mint azt a trinukleotidok közötti összehasonlítható három bázispár kettős spirál esetében várták (Grosjean és mtsai. 1976, 1978). Három strukturális jellemzőt azonosítottak a stabilitás fokozásának forrásaiként: a hurok kényszerét, a lógó végek általános hatását és a módosított nukleotidok sajátos hatását, amelyek utóbbi nagyságrendileg hozzájárul a komplex stabilitásához. A 37-es pozícióban módosított nukleotiddal rendelkező tRNS-eket tartalmazó komplexek képződése nagyobb entalpia-változással járt, összehasonlítva a módosítás nélküli vagy az Y-bázis nélküliakkal, ami a módosítás halmozásra gyakorolt hatására utal (Grosjean és mtsai. 1976).
EREDMÉNYEK
A 37-es helyzetben lévő bázisszubsztitúciók befolyásolják a pept-tRNS-kötés stabilitását az A-helyen
Amikor a riboszomális komplexeket wt pept-tRNS Phe-vel 37 ° C-on és 10 mM Mg 2+ -on inkubáltuk, ▶). Ezzel szemben az összes módosítatlan pept-tRNS-transzkriptum disszociációja sokkal gyorsabb volt, és az A-hely stabilitása szignifikáns különbségeket mutatott, a bázis jellegétől függően a 37-es helyzetben, a komplexek felezési ideje 1 óra ( Y37A) néhány percig (Y37U, Y37C). Ez azt mutatja, hogy az A-hely kötődését erősen befolyásolja az antikodon hurokban lévő 37 nt jellege. A következőkben ezen hatások termodinamikai alapjait tanulmányozzuk.
- Karcsúsítja Hugo statikus webhelyét, Allison Letson
- Scarlett Johansson rajongó - a legjobb és leghosszabb ideig futó Scarlett webhely az interneten
- Faj profil Sárga sügér, Perca flavescens A halak helye
- Phytodren ™ hivatalos webhely - A maximális erőfogyás formula
- Társadalmi-gazdasági helyzet és adipozitás a gyermekek és szüleik körében a Belarusz Köztársaságban