A zsírtartalmú étrend által kiváltott atrófiás gyomorhurut esetén egereknél a leptin receptor jelátvitel szükséges
Kyoko Inagaki-Ohara
Kutatóintézet, Nemzeti Globális Egészségügyi és Orvostudományi Központ (NCGM), 1-21-1, Toyama Shinjuku, Tokió, 162-0052 Japán
Endokrinológiai és Metabolizmus Osztály, Fejlesztési Élettani Tanszék, Országos Fiziológiai Tudományok Intézete (NIPS), 38 Nishigonaka Myodaiji, Okazaki, Aichi 444-8585 Japán
A fogadó védelem osztálya, Hirosimai prefektúra Egyetem, Élettudományi Tanszék, Élettudományi Kar, 562 Nanatsuka, Shobara, Hirosima 727-0023 Japán
Shiki Okamoto
Endokrinológiai és Metabolizmus Osztály, Fejlesztési Élettani Tanszék, Országos Fiziológiai Tudományok Intézete (NIPS), 38 Nishigonaka Myodaiji, Okazaki, Aichi 444-8585 Japán
Kazuyo Takagi
Endokrinológiai és Metabolizmus Osztály, Fejlesztési Élettani Tanszék, Országos Fiziológiai Tudományok Intézete (NIPS), 38 Nishigonaka Myodaiji, Okazaki, Aichi 444-8585 Japán
Kumiko Saito
Endokrinológiai és Metabolizmus osztály, Fejlesztési Élettani Tanszék, Országos Fiziológiai Tudományok Intézete (NIPS), 38 Nishigonaka Myodaiji, Okazaki, Aichi 444-8585 Japán
Seiya Arita
A fogadó védelem osztálya, Hirosimai prefektúra Egyetem Élettudományi Tanszék Élettudományi Tanszék, 562 Nanatsuka, Shobara, Hirosima 727-0023 Japán
Lijun Tang
Endokrinológiai és Metabolizmus Osztály, Fejlesztési Élettani Tanszék, Országos Fiziológiai Tudományok Intézete (NIPS), 38 Nishigonaka Myodaiji, Okazaki, Aichi 444-8585 Japán
Tetsuji Hori
Yakult Központi Mikrobiológiai Kutatóintézet, Izumi 5-11, Kunitachi, Tokió, 186-8650 Japán
Hiroaki Kataoka
Miyazaki Egyetem Orvostudományi Karának Onkopatológiai és Regeneratív Biológiai Szakosztálya, 5200 Kihara, Kiyotake, Miyazaki, 889-1692 Japán
Satoshi Matsumoto
Yakult Központi Mikrobiológiai Kutatóintézet, Izumi 5-11, Kunitachi, Tokió, 186-8650 Japán
Yasuhiko Minokoshi
Endokrinológiai és Metabolizmus Osztály, Fejlesztési Élettani Tanszék, Országos Fiziológiai Tudományok Intézete (NIPS), 38 Nishigonaka Myodaiji, Okazaki, Aichi 444-8585 Japán
Absztrakt
Háttér
Az elhízás növeli a rosszindulatú daganatok kockázatát a különböző szövetekben, beleértve a gyomrot is. A rákmegelőző elváltozásokkal járó atrófiás gasztritisz elhízással összefüggő betegség; az elhízással összefüggő atrófiás gastritis kialakulásának hátterében álló mechanizmusok azonban nem ismertek. A leptin a gyomorból, valamint a zsírszövetből származó hormon, a gyomor leptin pedig részt vesz a gyomorrák kialakulásában. A jelenlegi tanulmány célja a leptin receptor szignalizáció részvételének vizsgálata az atrófiás gastritis kialakulásában az étrend okozta elhízás során.
Mód
A hím C57BL/6, ob/ob és db/db egereket magas zsírtartalmú étrenddel (HFD) vagy kontroll diétával (CD) táplálták 1 hét és 5 hónap között. Ezekben az egerekben értékelték a gyomornyálkahártya patológiás változásait és az atrófiás gyomorhuruthoz kapcsolódó molekulák expresszióját.
Eredmények
A HFD-táplálás gyomor nyálkahártya hiperpláziát váltott ki, fokozott gyomor leptin expresszióval. A nyálkahártya hiperpláziát a Ki67-pozitív proliferáló sejtek nagyobb gyakorisága és a gyomormirigyek sorvadása kísérte gyulladás jelenlétében, amely a HFD-etetés után fokozódott. Az 1 hétig a HFD-vel táplált egerek gyomornyálkahártyájában kimutatták az ObR szignálhoz kapcsolódó molekulák, például az ObR, a STAT3, az Akt és az ERK aktiválódását. A gyomornyálkahártya atrófiájához kapcsolódó morfológiai változások, valamint a Muc2 és Cdx2 expressziója hasonlít az emberi bél metapláziájához. A vad típusú egerekkel ellentétben a leptinhiányos ob/ob egerek és a leptinreceptorral mutált db/db egerek nem mutattak megnövekedett Cdx2 expressziót a HFD etetésére válaszul.
Következtetés
Ezek az eredmények együtt azt sugallják, hogy az elhízáshoz társuló atrófiás gastritis kialakulásához a leptin jelátviteli útjának aktiválása szükséges a gyomorban.
Elektronikus kiegészítő anyag
A cikk online verziója (doi: 10.1186/s12986-016-0066-1) kiegészítő anyagot tartalmaz, amely az engedélyezett felhasználók számára elérhető.
Háttér
A gyomor-karcinóma (GC) általában atrófiás gyomorhurut, bélmetaplazia és a gyomornyálkahártya diszpláziájának hátterében keletkezik, és világszerte a rákhoz kapcsolódó halálozások második vezető oka [1]. Az elhízás növeli a gasztritisz [2, 3], az atrófiás gasztritisz [4–6] és a gyomor-kardia adenokarcinóma [7–9] nagyobb előfordulásának kockázatát. Az embert megfertőző és a gyomrot kolonizáló baktérium, a Helicobacter pylori fertőzés az elsődleges oka a gyomor nyálkahártyáján lévő rák előtti elváltozásoknak [10]. Bár a H. pylori-fertőzés nem korlátozódik a kórosan elhízott betegekre, az elhízás növeli a krónikus gyomorhurut és a GC prevalenciáját [2]. Ezenkívül az elhízás nemcsak bizonyos daganatok kockázati tényezője, hanem a megnövekedett halálozási arányhoz is kapcsolódik [11]. Így az elhízás potenciálisan befolyásolja a gasztritisz gyomor tumorigenesisé fejlődését. Ezért elengedhetetlen az elhízáshoz és a rák előtti elváltozásokhoz társuló jelző molekulák azonosítása a nagy kockázatú egyének kezelésében.
Mód
Állatok és diéták
A hím C57BL/6J (vad típusú: WT), ob/ob és db/db egereket (CLEA Japan, Tokió, Japán) 7 hetes korban vizsgálták. Az állatokat egyenként műanyag ketrecekben helyeztük el 24 ° C ± 1 ° C hőmérsékleten, 0600 és 1800 óra közötti világítással. Az egereket vagy kontroll-étrenddel (CD, zsírból származó kalória 10% -a, D12450J) vagy magas zsírtartalmú étrendet (HFD, zsírból származó kalória 60% -a, D12492) kaptuk (Research Diets Inc., New Brunswick, NJ ) és a víz ad libitum. Az Országos Fiziológiai Tudományok Intézetének állatkísérletekkel foglalkozó etikai bizottsága minden állatkísérletet jóváhagyott.
A gyomor nyálkahártyájának hisztopatológiai elemzése
A HFD- és CD-vel táplált egerekből 10% -os formalinnal fixált szövetek paraffinba ágyazott gyomorszelvényeit nyertük, és hematoxilinnel és eozinnal (H&E) festettük, és megvizsgáltuk a gyomor nyálkahártyájának változásait. A gyomor nyálkahártya-változásainak értékelése a hiperplázia (0, nem lényegi változás; 1, alacsony; 2, mérsékelt; 3, magas), a sejtek beszivárgása (0, nem lényegi változás; 1, alacsony, 2, mérsékelt, 3, magas), a gyomor mirigysejtjeinek elvesztése (0, nem lényeges változás; 4, alacsony; 5, mérsékelt; 6, magas), Alcian blue festés (0, nem lényegi változás; 4, fokális; 5, diffúz; 6, nagyon erős diffúz) és dysplasia (0, nem lényeges változás; 7, alacsony). Mindegyik kritériumot két egyén egymástól függetlenül vak pontozással értékelte, korábban meghatározott kritériumok alkalmazásával [19].
Intragasztrikus pH-mérések
A gyomor pH-ját publikált módszerrel mértük [21]. Röviden, az egereket szén-dioxid inhalációval végzett altatás után feláldoztuk. A gyomor eltávolítását követően a gyomor lumenét eltávolítottuk és 0,5 ml sóoldattal (150 mM, pH 7,0) mostuk, és az összegyűjtött gyomor folyadék pH-ját pH-mérővel (Mettler, Toledo, OH) mértük.
Immunhisztokémiai elemzés
Western blot elemzés
A gyomor hámsejtjeit elkülönítettük és egy korábban publikált módszer módosításával készítettük [22]. A gyomor boncolt kis szegmenseit szobahőmérsékleten 10 percig kevertük 1 mM DTT-t tartalmazó Hank kiegyensúlyozott sóoldatában (HBSS) (Thermo Fisher Scientific Inc., Waltham, MA). A felülúszó eltávolítása után a szöveteket 37 ° C-on 10 percig keverjük 10 mM EDTA-t tartalmazó HBSS-ben. A felülúszó eltávolítása után a szövetszuszpenziót nejlonhálón vezetjük át a törmelék eltávolítása céljából, és 25/40% -os szakaszos Percoll (Sigma-Aldrich, St. Louis, MO) gradiensen át centrifugáljuk 600 × g hőmérsékleten 20 ° C-on 20 percig. min. A 25/40% határfelületről gyűjtött sejtek a hámsejtek voltak. Lizátumokat állítottunk elő szövetekből és sejtekből, és Western-blot-analízissel elemeztük egy korábban publikált módszer szerint [23]. A Western blotolásnál használt Abs-t az 1. kiegészítő fájl foglalja össze: S1. Táblázat.
Lézerrel befogható mikrodisszekció
A fent leírt paraffinba ágyazott gyomorszöveteket 6 μm vastag szakaszokra vágtuk és membrán tárgylemezekre szereltük (MembraneSlide 1.0 PEN, Carl Zeiss Microscopy, LLC, Thornwood, NY). A paraffint a metszetek xilollal történő öblítésével távolítottuk el, majd a metszeteket 100-70% etanolos fürdők sorozatába merítettük és levegőn szárítottuk. A gyomorhám nyálkahártya metszeteit levágtuk és az AdhesiveCaps-ra (PALM, Microlaser Technologies, Bernried, Németország) gyűjtöttük egy lézer-befogó mikrodisszekciós (LMD) rendszerrel (PALM MB-III, Microlaser Technologies).
Kvantitatív reverz transzkripció-polimeráz láncreakció (qRT-PCR)
Az LMD mintákból és az egér gyomornyálkahártyájából származó teljes RNS-t AllPrep FFPE DNS/RNS és RNeasy Mini készletek (Qiagen, Valencia, CA) felhasználásával extraháltuk a gyártó protokolljainak megfelelően. A cDNS-t szintetizálták kb. 100–200 ng LMD metszetekből vagy 1-2 μg RNS gyomornyálkahártya sejtekből a ReverTra Ace® qPCR RT Kit (TOYOBO, Co., Ltd., Osaka, Japán) segítségével a gyártó protokollja szerint. . A qRT-PCR-t a Power SYBR Green PCR Master Mix (Life Technologies, Carlsbad, CA) felhasználásával végeztük specifikus alapozó készletekkel (400 nM a végső koncentrációnál, 2. kiegészítő fájl: S2 táblázat) a gyártók protokollja szerint. A génexpresszió relatív változásait ΔΔCt módszerrel számoltuk, és a normalizáláshoz a 18S rRNS gént használtuk.
Az immunhisztokémiai festés kvantitatív elemzése
A mikroszkópos mérésekhez a leptinnel festett gyomornyálkahártya-mintákat mikroszkóppal (Olympus) fényképeztük, és kvantitatív elemzést végeztünk ImageJ szoftver segítségével (http://rsb.info.nih.gov/ij/index.html). A nyálkahártya magasságát a gyomormirigyek töve és a nyaki zóna között mértük.
Plazma assay
A szérumot érzéstelenítéssel kardiocentézissel nyert vérből gyűjtötték és -80 ° C-on tárolták. Inzulin (egér inzulin ELISA készlet, Shibayagi, Gunma, Japán), leptin (Leptin ELISA, Millipore, St. Charles, MO), glükóz (glükóz CII-teszt, Wako, Osaka, Japán) és nem észterezett zsírsav (NEFA ) (NEFA C-teszt, Wako) a szérum szintjét a gyártó protokolljai szerint mértük.
Statisztikai analízis
A szignifikáns különbségek meghatározásához a Mann – Whitney U tesztet és a Kruskal-Wallis tesztet használtuk. A 0,05 alatti p-értéket szignifikánsnak tekintették. A statisztikai elemzéseket a Prism szoftver 6-os verziójával végeztük (GraphPad, San Diego, CA, USA).
Eredmények
A HFD-vel táplált egereknél atrófiás gastritis alakul ki
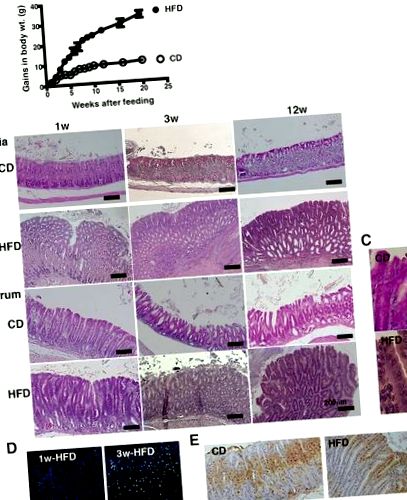
A gyomornyálkahártya patológiás változásai a HFD-táplálás következtében. a CD (n = 10) vagy HFD (n = 10) táplált C57BL/6 J egerek testtömegének növekedése 20 hét alatt. b A gyomor cardia és az antrum reprezentatív H & E szakaszai CD-vel vagy HFD-vel etetett egerekből 1, 3 és 12 hétig. c A gyomor antrumának nagyított képe CD-vel és HFD-vel táplált egerekben az 1b. Ábrán az etetés után 12 héttel (nagyítás, × 400). Megfigyelték a sejtmagot, a mag hipertrófiáját, a diszpolaritást és az álstratifikációt. d 1. és 3. héten HFD-vel táplált egerek gyomornyálkahártyájának CD45 festése. e Ki67-festés CD-vel vagy HFD-vel táplált egerek gyomornyálkahártyájában 3 hétig. Minden elemzéshez 5–10 egeret használtunk, és reprezentatív adatokat mutatunk be
Késleltetett proinflammatorikus citokinek indukciója a gyomor nyálkahártyájában HFD-etetés után. a A leptin, az Il6 és az Il11 génexpressziója a CD- és HFD-vel táplált egerek gyomornyálkahártyájában 1, 3 és 12 hét elteltével. Az értékek 4 egér átlag ± SD értékét jelentik. Az eredményeket Kruskal-Wallis teszttel elemeztük. * p 7a). A nyálkahártya magasságának elemzése összhangban volt a szövettani eredményekkel (7c. Ábra). Ezenkívül az immunhisztokémiai elemzés a Cdx2 és a leptin fokozott kolokalizációját mutatta ki a HFD-t 1 hétig tápláló WT egerek gyomornyálkahártyájában (8a. Ábra), míg a db/db egerek nem mutattak Cdx2 expressziót a leptin-pozitív sejtekben. Ezzel szemben az ob/ob egereknél kevés Cdx2 volt, és nem volt leptin expresszió. Hasonlóképpen, a foszforilezett ObRb és Cdx2 ko-lokalizációját detektáltuk HFD-vel táplált WT egerekben, de nem HFD-vel táplált ob/ob vagy db/db egerekben, amelyek csak némi ObRb vagy Cdx2 foszforilációját mutatták. A CD-vel táplált ob/ob és db/db egerek a testtömeg drasztikus növekedését mutatták, de a gyomornyálkahártyában csak enyhe hiperpláziát mutattak a WT egerekhez képest a 3. héten (7b. És 7c. Ábra). 7c. Annak ellenére, hogy nagyobb a testtömege, az ob/ob és a db/db egerek, amelyek 3 hétig táplálták a HFD-t, kevésbé mutattak hiperpláziát, mint a WT egerek, akik 20 hétig táplálták a HFD-t. 20 hetes HFD-etetés után a WT egerek szabálytalan és összeolvadt szerkezettel rendelkeztek a szívben (7b. Ábra). A HFD-etetés nem növelte a Cdx2 és Muc2 expresszióját ob/ob és db/db egerek gyomornyálkahártyájában (8b. Ábra). Ezek az eredmények arra utalnak, hogy a gyomorban lévő leptin jelátvitel fontos tényező, amely metaplasztikus patológiához vezet az elhízással kapcsolatos gastritisben.
A gyomor morfológiájának elnyomott változása HFD-vel táplált egerekben, amelyekben nincs leptin szignál. A gyomornyálkahártya reprezentatív H & E szakaszai WT, ob/ob és db/db egerekből CD-vel vagy HFD-vel táplálták 1 (a) és 3 hét (b). A képeken szereplő minden érték azt az egér testtömegét jelzi, amelyből a gyomornyálkahártyát nyerték, és amelyet H & E-folttal festettek. c A nyálkahártya magasságának mérése a WT, ob/ob és db/db egerek gyomor fundusában az 1. és 3. héten, a WT egerek pedig az etetés után 20 héttel. Az értékek 4 egér átlag ± SD értékét jelentik. Az eredményeket Kruskal-Wallis teszttel elemeztük. * p 5a), és a gyomor hiperpláziája kevésbé progrediál, annak ellenére, hogy ezek az egerek elhízottabbak, mint a HFD-vel táplált WT egerek (7. ábra). Ezenkívül az ob/ob és a db/db egereknél spontán nem alakul ki gyomortumor, bár ezek az egerek rendkívüli elhízást mutatnak. Vizsgálatunk eredményei és az előző jelentések eredményei együttesen azt sugallják, hogy a leptin szignalizáció kritikusan részt vesz a hám fejlődésének szabályozásában számos szövetben. Bár a leptin expressziójának és a gyomorban történő jelzésének jelentősége továbbra is bizonytalan, figyelembe véve a leptin és az ObRb gyomorban való konstitutív expresszióját [45, 46], a leptinre szükség lehet a gyomornyálkahártya homeosztázisának fenntartásához.
Összefoglalva, bemutattuk az atrófiás gyomorhurut kialakulását az étrend által kiváltott elhízás egérmodelljének felhasználásával, fokozott leptin-ObRb jelátviteli útvonallal. A leptin-ObR jelátviteli út expressziója és egyedi lokalizációja túlnyomórészt szerepet játszik a humán GC korai szakaszában betöltött szerepben. A tanulmány jelentősége abban rejlik, hogy a leptin és az ObR biomarkerként vagy új terápiás célpontként használható az atrófiás gyomorhurut diagnosztizálásában és kezelésében.
Következtetés
Ebben a tanulmányban azt mutatjuk be, hogy az étrend által kiváltott elhízott WT egerek túlzottan expresszálják a leptint és aktiválják a leptin receptor jelátvitelt a gyomor nyálkahártyájában, ami atrófiás gyomorhuruthoz vezet a gyomornyálkahártya bél metaplaziajával. Ezek a kóros tulajdonságok kevésbé súlyosak az ob/ob és a db/db egereknél, amelyeknél nincs leptin receptor jelátvitel, mint a WT egereknél. Ezért a gyomorban lévő leptin receptor szignalizáció kritikus ellenőrzési pont a gyomor neoplazia kialakulásához, és a gyomor leptin receptor szignalizációt célzó megelőző terápiákat lehet fejleszteni a GC ellen.
Köszönetnyilvánítás
Ezt a munkát a Japán Oktatási, Kulturális, Sport-, Tudományos és Technológiai Minisztérium tudományos kutatási támogatásai (C) támogatták (23590272 és 26461391), valamint egy PUH kutatási ösztöndíjprogram (A) (Hiroshima prefekturális egyetem) ) K. IO-nak ítélték. Köszönetet mondunk Takao Shimizu professzornak, Masashi Mizokami (NCGM) professzornak, Dr. Masanobu Nanno (Yakult Honsha Co. Ltd.) és Masao Mitsuyama professzornak (Kiotói Egyetem) folyamatos bátorításukért és támogatásukért.
Rövidítések
| CD | Kontroll étrend |
| DTT | Ditiotreitol |
| EDTA | Etilén-diamin-tetraecetsav |
| ELISA | Enzimhez kapcsolt immunszorbens vizsgálat |
| GC | Gyomor karcinóma |
| HFD | Magas zsírtartalmú étrend |
| LMD | Lézerrel befogható mikrodisszekció |
| NEFA | Nem észterezett zsírsav |
| WT | Vad típus |
További fájlok
Antitestek listája: Western-blotoláshoz és immunhisztokémiához használt antitestek. (DOCX 127 kb)
A kvantitatív PCR-hez használt primerek. (DOCX 100 kb)
Az elhízással járó index megváltozása. A testsúlyt (A), az inzulint, a leptint, a glükózt és a NEFA-t a szérumokban (B) CD- és HFD-vel táplált WT, ob/ob és db/db egerekben mértük az etetés után 1 héttel. Az eredményeket Kruskal Wallis teszttel elemeztük. * o
Lábjegyzetek
Versenyző érdekek
A szerzők kijelentik, hogy nincsenek versengő érdekeik.
A szerzők hozzájárulása
A K I-O megtervezte és megtervezte a projektet, elvégezte a kísérleteket és megírta a kéziratot. KT, LT, KS és SA segítették az állatgondozási és plazma vizsgálati kísérleteket, TH és SM felállították az LMD-t. SO és YM elemezte az adatokat és konstruktív vitát folytatott. Minden szerző elolvasta és jóváhagyta a végleges kéziratot.
- A magas zsírtartalmú, magas koleszterinszintű étrend növeli a gyomorhurut előfordulását az LDL-receptor-negatív egerekben
- Inzulin- és leptinrezisztencia hiperleptinémiával az egerekben, amelyekben nincs androgénreceptor-cukorbetegség
- A magas zsírtartalmú étrend által kiváltott zsírbetegség, zsírgyulladás, máj steatosis és hiperinsulinémia
- A feszültség által vezérelt Hv1 protoncsatorna elvesztése diéta okozta elhízáshoz vezet egerekben BMJ Open Diabetes
- A magas zsírtartalmú étrend hajlandóvá teszi az egereket a máj károsodására - ScienceDaily