Alacsony fehérjetartalmú étrend diabéteszes vesebetegség esetén: hatása és molekuláris mechanizmusa, az állatkísérletek megközelítése
Munehiro Kitada
1 Diabetológiai és endokrinológiai tanszék, Kanazawa Orvostudományi Egyetem, Uchinada, Ishikawa 920-0293, Japán; moc.liamg@2911nasuman (Y.O.); pj.ca.dem-awazanak@onnomi (I.M.); pj.ca.dem-awazanak@6150ayok (D.K.)
2 Az előzetes molekuláris élelmiszer-tudomány és technológia osztálya, Orvosi Kutatóintézet, Kanazawa Orvostudományi Egyetem, Uchinada, Ishikawa 920-0293, Japán
Yoshio Ogura
1 Diabetológiai és endokrinológiai tanszék, Kanazawa Orvostudományi Egyetem, Uchinada, Ishikawa 920-0293, Japán; moc.liamg@2911nasuman (Y.O.); pj.ca.dem-awazanak@onnomi (I.M.); pj.ca.dem-awazanak@6150ayok (D.K.)
Itaru Monno
1 Diabetológiai és endokrinológiai tanszék, Kanazawa Orvostudományi Egyetem, Uchinada, Ishikawa 920-0293, Japán; moc.liamg@2911nasuman (Y.O.); pj.ca.dem-awazanak@onnomi (I.M.); pj.ca.dem-awazanak@6150ayok (D.K.)
Daisuke Koya
1 Diabetológiai és Endokrinológiai Tanszék, Kanazawa Orvostudományi Egyetem, Uchinada, Ishikawa 920-0293, Japán; moc.liamg@2911nasuman (Y.O.); pj.ca.dem-awazanak@onnomi (I.M.); pj.ca.dem-awazanak@6150ayok (D.K.)
2 Az előzetes molekuláris élelmiszer-tudomány és technológia osztálya, Orvosi Kutatóintézet, Kanazawa Orvostudományi Egyetem, Uchinada, Ishikawa 920-0293, Japán
Absztrakt
1. Bemutatkozás
Az utóbbi években világszerte növekszik a diabetes mellitus prevalenciája. A hosszú távú cukorbetegség érrendszeri változásokat és diszfunkciókat eredményez. A cukorbetegség szövődményei a morbiditás és a halálozás fő okai a cukorbetegeknél. A diabéteszes érrendszeri szövődmények közül a diabéteszes vesebetegséget (DKD) a végstádiumú vesebetegség (ESRD) egyik vezető okaként és a szív- és érrendszeri betegségek (CVD) független rizikófaktoraként is elismerték [1,2]. A DKD progressziójának elnyomására ajánlott multifaktoriális kezelés, ideértve a diétaterápiát, az optimális glikémiás kontrollt, a vérnyomás (BP) renin-angiotenzin rendszer (RAS) gátlókkal történő szabályozását és a statin vagy fibrát segítségével történő lipidkontrollt [3,4,5, 6]. A közelmúltban új antidiabetikus szerek, beleértve az inkretinnel rokon gyógyszereket, például a dipeptidil-peptidáz-4 (DPP-4) gátlót, a glukagonszerű peptid-1 (GLP-1) receptor agonistát és a nátrium-glükóz kotransporter 2-t ( Az SGLT2) inhibitor reno-védő hatást mutatott a DKD ellen [7,8,9,10,11]. Néhány, különösen előrehaladott DKD-s beteg azonban gyorsan átjut az ESRD-be annak ellenére, hogy megfelelő multifaktoriális kezelést kapott.
A diétaterápia alapvetően fontos mind a cukorbetegség, mind a DKD számára a glükózkontroll fenntartása és a vesekárosodás progressziójának elnyomása szempontjából [12]. A diétaterápiát illetően, különösen előrehaladott vese-stádiumokban, az alacsony fehérjetartalmú étrendet (LPD) úgy ítélték meg, hogy megőrzi a vesefunkciót krónikus vesebetegségben (CKD), beleértve a DKD-t is [13,14,15,16]. Az LPD reno-protektív hatása a DKD-re azonban ellentmondásos, mert a korábbi klinikai vizsgálatok nem mutattak meggyőző eredményeket. Ennek oka volt a napi LPD betartásának nehézségei és a korlátozott fehérjebevitel optimális mennyiségével kapcsolatos klinikai adatok elégtelensége [17,18,19,20,21]. Számos korábbi klinikai jelentés kimutatta, hogy a nagyon LPD (VLPD) jóval kedvezőbb hatást eredményezhet a reno-védelemben, mint egy hagyományos LPD a nem DKD-s betegeknél [22,23]. Nincsenek azonban olyan nagy klinikai vizsgálatok, amelyek azt mutatnák, hogy a VLPD kedvezőbb hatással lenne a vesefunkció megőrzésére DKD-s betegeknél, mint egy hagyományos LPD. Ezenkívül az LPD, különösen a VLPD tényleges teljesítménye klinikai körülmények között számos táplálkozási kockázattal jár, nem pedig a reno-védelem előnyeivel, ha nem végeznek megfelelő étrend-terápiát, beleértve az elegendő energiafogyasztást is.
Másrészt az LPD, különösen a VLPD reno-protektív hatásának DKD-vel szembeni molekuláris mechanizmusait számos korábbi állatkísérlet bizonyította, köztük a miénk is. Részletes mechanizmusait azonban még nem kell teljesen tisztázni. A mechanizmusok tisztázása egy új terápiás lehetőség kidolgozásához vezet a DKD számára, mint a VLPD helyettesítő terápiája.
Ebben az áttekintésben (1) az LPD, különösen a VLPD molekuláris mechanizmusait és annak hatását fejlett cukorbetegség által kiváltott vesekárosodás ellen állati vizsgálatokból nyert adatok alapján vizsgáljuk; (2) az LPD reno-protektív hatásának jelenlegi ismerete klinikai körülmények között a DKD progressziója ellen; (3) táplálkozási problémák CKD-s betegeknél és kapcsolatuk az LPD-vel; (4) egy új terápia várható jövőbeli kilátásai a VLPD helyettesítésére.
2. Molekuláris mechanizmusok, amelyekkel az LPD reno-védelmet fejt ki a DKD ellen
2.1. Az állatkísérletek tanulságai
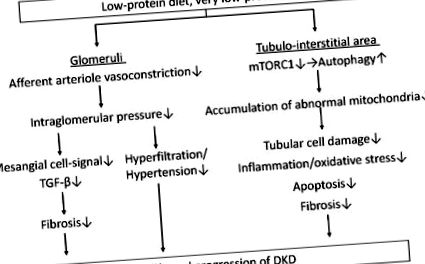
Védőhatások a glomerulusokra
Az alacsony fehérjetartalmú étrend (LPD) csökkenti az intraglomeruláris nyomást az afferens arteriol vazokonstrikciójának csökkentése révén, ami javítja a glomeruláris hiperfiltrációt és a magas vérnyomást, valamint csökkenti a fibrózist a mesangialis sejtekben a növekedési faktor-β (TGF-β) jelek révén. Ezenkívül az LPD, különösen egy nagyon LPD (VLPD), csökkenti a tubuláris sejtkárosodást, a gyulladást/oxidatív stresszt, az apoptózist és a fibrózist a tubulus-interstitialis területen azáltal, hogy csökkenti a kóros mitokondriumok felhalmozódását, amelyet az emlősök rapamicin-komplex 1 (mTORC1) aktivitás és az autofágia helyreállítása. Az LPD lassíthatja a diabéteszes vesebetegség progresszióját a glomerulusokban és a tubulus-interstitialis területen egyaránt kedvező hatások révén. DKD: diabéteszes vesebetegség.
3. Védőhatások a tubulo-interstitialis területre
Továbbá beszámoltunk arról, hogy egy ciklusos és szakaszos VLPD (amely 3 napig szokásos étrendből és heti 4 nap VLPD-ből áll), és nem napi VLPD, javíthatja a cukorbetegség által kiváltott vesekárosodásokat, beleértve a tubuláris károsodást, a gyulladást és a tubulust intersticiális fibrózis, Wistar zsíros patkányokban [40]. Ezért a ciklikus és szakaszos VLPD olyan étrend lehet, amelyet pszichológiailag könnyen lehet folytatni, és kisebb az alultápláltság kockázata, mint előrehaladott diabéteszes nephropathiában szenvedő betegeknél a mindennapi hosszú távú VLPD. Ugyanakkor további klinikai vizsgálatra van szükség a ciklikus és intermittáló VLPD, mint az előrehaladott DKD hosszú távú kezelésének hatásának felderítéséhez.
4. Az LPD hatékonyságának jelenlegi megértése DKD-s betegek reno-védelme szempontjából
A jelenlegi klinikai körülmények között az LPD hatékonysága az előrehaladott DKD szempontjából továbbra is ellentmondásos, mivel a klinikai vizsgálatok bizonyítékai nem tudják kellőképpen megmagyarázni az LPD reno-protektív hatását. A klinikai vizsgálatok nem következetesen mutatták ki az LPD jótékony hatásait a vesefunkció megőrzésére DKD-ben [17,18,19], míg más vizsgálatok kimutatták, hogy az LPD jótékony hatással van a vesefunkció progresszív csökkenésének lassítására [20,21] . 13 randomizált kontrollvizsgálat (RCT) metaanalízisében az LPD DKD-re kifejtett reno-protektív hatásáról Nezu és mtsai. kimutatta, hogy az LPD (előírt fehérjebevitel: 0,6–0,8/kg/nap) javította a becsült glomeruláris szűrési sebességet (eGFR), összehasonlítva egy szokásos étrenddel (előírt fehérjebevitel: 1,0–1,6 g/kg/nap), ahol a betegek betartották fehérje-korlátozott étrendhez [41]. Ezért az LPD betartásának nehézségei hozzájárultak a korábbi klinikai vizsgálatok vitatott eredményeihez.
Az aminosav-terhelés csökkentése mellett a nitrogén-, foszfát- és savterhelés csökkentésének összefüggésben kell állnia az ESRD progressziójának késleltetésével és a dialízis megkezdésével az urémiás tünetek vagy azotemia csökkenése révén [47,48] (ábra 2). Ezért a CKD étrend-terápiájára vonatkozó számos irányelv, beleértve a DKD-t is, korlátozott fehérjebevitelt és a túlzott fehérjebevitel elkerülését javasolja (2. ábra). A DKD diétás terápiájának irányelveinek összehasonlítását az étrendi fehérjebevitel tekintetében az 1. táblázat mutatja. A jelenlegi klinikai körülmények között a VLPD nem ajánlott a DKD diétás terápiájaként. Mindazonáltal a VLPD klinikailag releváns eszköznek tekinthető a vesefunkció csökkenésének elnyomásában a DKD előrehaladott stádiumai alatt, megfelelő energiafogyasztás vagy keto-savak (KA) kiegészítése mellett (az alábbiakban leírtak szerint) (2. ábra).
Az alacsony fehérjetartalmú étrend (LPD) előnyei krónikus vesebetegségben (CKD) szenvedőknél a vesefunkció csökkenésének előrehaladásának lassulását, az urémiás tünetek és azotemia csökkenését, valamint a foszfát- és savterhelés csökkenését eredményezik, ami az idő meghosszabbodását eredményezi. dialízis megkezdésére és esetleg csökkent mortalitásra, különösen szív- és érrendszeri betegségek (CVD) esetén. Az LPD kockázatai közé tartoznak a táplálkozási problémák, ideértve a fehérje-energiapazarlást (PEW), a szarkopéniát és a gyengeséget. Ez az életminőség (QOL) csökkenését és a megnövekedett CVD miatti halálozást eredményezi. Ezért LPD-t kell előírni a CKD-ben szenvedő betegek számára, beleértve a diabéteszes vesebetegséget (DKD), figyelembe véve a beteg betartását, életkorát és táplálkozási állapotát. A megfelelő étrendterápiát egyedileg kell értékelni (LPD, VLPD megfelelő energiafogyasztással és/vagy keto savakkal kiegészítve, vagy a túlzott fehérjebevitel vagy a korlátozott vörös hús elkerülése).
Asztal 1
A diabéteszes vesebetegség diétaterápiájára vonatkozó irányelvek összehasonlítása, különös tekintettel a fehérjebevitel korlátozására.
| Az orvosi ellátás normái a cukorbetegségben – 2018: A felülvizsgálatok összefoglalása Cukorbetegség ellátása. 2018, 41 (1. kiegészítés) | Mikrovaszkuláris szövődmények és lábápolás | 2018 | 0,8 g/kg/nap Kerülendő: > A kalória 20% -a,> 1,3 g/kg/nap |
| A cukorbetegség kezelése iránymutatás (2016–2017) | A cukorbetegség szövődményeinek kezelése | 2016 | GFR 2: 0,6–0,8 g/kg/nap (GFR 2: 0,6–0,8 g/kg/nap figyelembe vétele) Makroalbuminuria: 0,8–1,0 g/kg/nap |
| KDIGO 2012 klinikai gyakorlati útmutató a krónikus vesebetegségek értékeléséhez és kezeléséhez | A CKD progressziójának és szövődményeinek kezelése | 2013 | GFR 2: 0,8 g/kg/nap. A CKD progressziójának kockázata: kerülve> 1,3 g/kg/nap. |
| Táplálkozási és Dietetikai Akadémia/Bizonyítékelemző Könyvtár | Krónikus vesebetegség bizonyítékokon alapuló táplálkozási gyakorlati útmutató | 2011 | GFR 2: 0,6–0,8 g/kg/nap (CKD); 0,8–0,9 g/kg/nap (DKD) |
| Veseelégtelenséggel foglalkozó ausztrálok gondozása | 2. típusú cukorbetegség: vesebetegség | 2010 | Nincs ajánlás |
| K/DOQI klinikai gyakorlati útmutató és klinikai gyakorlat ajánlás | Cukorbetegség és krónikus vesebetegség | 2007 | 1–4. Szakasz: 0,8 g/kg/nap |
GFR: glomeruláris szűrési sebesség; CKD: krónikus vesebetegség; DKD: diabéteszes vesebetegség; KDIGO: Vesebetegség: a globális eredmények javítása; K/DOQI: A vesebetegség kimenetelére vonatkozó minőségi kezdeményezés.
5. A CKD táplálkozási kérdései és az LPD-vel való kapcsolat
A KA-kból hiányzik az aminosav kötődése az aminosav α-szénatomjához; ezért további nitrogén biztosítása nélkül átalakíthatók a megfelelő aminosavakká. Korábbi jelentések kimutatták, hogy a napi 0,3–0,6 g/kg/nap esszenciális aminosavak (EAA) KA-analógjaival kiegészített VLPD számos potenciális előnyt jelent az előrehaladott CKD-ben szenvedők számára [60,61], miközben fenntartja a jó táplálkozást (2. ábra). . A KA/EAA kiegészítés megfelelő adagját azonban még nem állapították meg. Ezenkívül a nagy RCT-ken alapuló klinikai bizonyítékok, amelyek azt vizsgálták, hogy a VLDP-vel kiegészített KA/EAA képes-e kifejteni a reno-protektív hatást a CKD-re, beleértve a DKD-t is, nem elegendő. További nagy klinikai vizsgálatokra van szükség ezen pontok tisztázásához.
6. A fehérjeforrás nem olyan mértékű, mint a fehérjeszűkítés mértéke a vesekárosodás elleni védelem szempontjából?
A fent leírtak szerint az LPD késleltetheti a CKD progresszióját az ESRD felé. Az étrendi fehérjebevitel szintjének és a táplálékfehérje-táplálékforrásoknak az ESRD kockázatára gyakorolt hatása az általános populációban azonban továbbra sem tisztázott. Érdekes módon Lew et al. kimutatta, hogy a különféle vizsgált fehérjeforrások között a vörös hús bevitele szorosan összefügg az ESRD dózisfüggő megnövekedett kockázatával [62]. Ezeket az élelmiszerforrásokat vizsgálták a szingapúri Kínai Egészségügyi Tanulmányban, egy leendő népességalapú kohorszban, amely 63 257 45–74 éves kínai felnőttet vett fel. 951 ESRD-es eset fordult elő átlagosan 15,5 éves követés során. Nem találtak összefüggést a baromfi, a hal, a tojás vagy a tejtermékek bevitelével, míg a szója és a hüvelyesek kissé védő hatásúnak tűntek. Ezenkívül egy vörös hús egy adagjának pótlása más fehérjeforrásokkal jelentősen csökkentette az ESRD kockázatát. Így a vörös hús bevitelének elkerülése reno-védelmet mutathat a CKD-s betegeknél (2. ábra). További vizsgálatokra van szükség annak mögöttes mechanizmusainak megvizsgálására, hogy a savas terhelés vagy más vegyületek, beleértve a vörös húsban található aminosavakat, hogyan súlyosbíthatják a CKD progresszióját.
A trimetil-amin-N-oxid (TMAO), az étrendi kolin, a foszfatidilkolin (lecitin) és az l-karnitin bél mikrobiális függő metabolitja a CKD-ben megemelkedett, és a koszorúér-betegség patogenezisével jár együtt [63]. A vörös húsbevitel az urémiás toxinok fokozott termeléséhez vezethet a bél mikrobiotájában, mint például a trimetil-amin-n-oxid (TMAO), az indoxil-szulfát és a p-krezil-szulfát [64]. Ezek az urémiás toxinok a kardiovaszkuláris (CV) mortalitás fokozott kockázatával járnak [65].
7. Záró megjegyzések és a várható jövőbeli kilátások
Szerző közreműködései
M.K. és D.K. hozzájárult a cikk megfogalmazásához. Y.O. és I. M. hozzájárult a vitához. Valamennyi szerző kritikusan átdolgozta a kéziratot a fontos szellemi tartalom szempontjából, és jóváhagyta a végleges verzió közzétételét. M.K. és D.K. felelősek a munka egészének integritásáért.
Finanszírozás
Ezt a munkát pénzügyileg támogatta a Kanazawa Orvostudományi Egyetem (S2016-11) promóciós kutatásának támogatása, az MK, a kihívást jelentő feltáró kutatások támogatása (16K15472), a Tudománykutatás Elősegítő Alapja a magánszféra promóciója és kölcsönös vállalata számára. japán iskolák, valamint a Kanazawa Orvostudományi Egyetem (C2015-2) és DK együttműködésének támogatása.
Összeférhetetlenség
A Boehringer Ingelheim, a Mitsubishi Tanabe Pharma, a Kyowa Hakko Kirin, a Taisho Toyama Gyógyszergyár és az Ono Gyógyszergyár hozzájárult a molekuláris élelmiszer-tudomány és technológia megelőzésével foglalkozó részleg létrehozásához. Munehiro Kitada, Yoshio Ogura, Itaru Monno és Daisuke Koya kijelentik, hogy ehhez a kézirathoz nincsenek összeférhetetlenségek.
- A vesebetegség legyőzése növényi alapú étrenden a kések fölé szorul
- A krónikus vesebetegek táplálkozási kezelésének gyakorlati megközelítése Fokvárosban
- 8 étrend- és életmódbeli változás, amelyek segíthetnek a vesebetegségek megelőzésében - NDTV Food
- 10 étel hozzáadása az autoimmun betegség étrendjéhez TheHarmin
- 4 tipp a szívbetegségek kezelésére diétával Az UPMC HealthBeat