Atrófiás gyomorhurut és rosszindulatú gyomor elváltozásai
Edith Lahner, Gianluca Esposito, Gloria Galli, Bruno Annibale
Kulcsszavak: Atrófiás gyomorhurut; káros vérszegénység; bél metaplázia; gyomorrák; 1-es típusú gyomor karcinoidok
Beküldve 2015. május 07-én. Elfogadva közzétételre 2015. május 25-én.
Atrófiás gyomorhurut: rákmegelőző állapot
Az atrófiás gyomorhurut olyan gyulladásos állapot, amelyet a gyomor mirigyszerkezeteinek elvesztése jellemez, amelyeket kötőszövet helyettesít (nem metaplasztikus atrófia) vagy a helyükre alkalmatlan mirigyszerkezetek (metaplasztikus atrófia) (1). A gyomornyálkahártya atrófiája és a bélmetaplázia nagy kockázatot jelent a gyomorrák kialakulására, mivel ezek képezik a hátteret, amelyben a dysplasia és a bél típusú gyomor adenokarcinóma kialakulhat (2,3). Emiatt az atrófiás gyomorhurut és a bél metaplázia rákmegelőző állapotnak tekinthető.
Sok esetben a bél típusú gyomor adenokarcinóma kialakulása jelenti a gyulladás-metaplazia-diszplázia-karcinóma szekvencia végső lépését, amelyet a többlépcsős gyomor-karcinogenezis Correa-kaszkádjának is neveznek. E kaszkád szerint a gyomorrák a normál gyomornyálkahártya krónikus Helicobacter pylori (H. pylori) -hez kapcsolódó nem atrófiás gyomorhurut, atrófiás gyomorhurut és bélmetaplázia fokozatos progressziója következtében alakul ki diszpláziáig és karcinómáig (4,5 ). A longitudinális vizsgálatok megerősítették ezt a modellt (6,7).
Az atrófiás gasztritisz különböző fenotípusai kialakulhatnak a különböző környezeti expozíció és genetikai profilok miatt. A gyomornyálkahártya premalignus elváltozásainak intra-gyomorban történő eloszlása a gyomorrák kockázatának egyik meghatározó tényezője: multifokális atrophiás gastritisnek nevezzük az oxyntikus mirigy atrófia és/vagy a bél metapláziáját, amely multifokális mintázatban oszlik meg, beleértve a korpusz és a fundus kisebb görbületét., és ezt a „kiterjedtnek” minősített fenotípust a gyomorrák magasabb kockázatával társítják. Hasonlóképpen, a „carcinoma fenotípus gyomorhurutja” fogalma azt javasolja, hogy a korpuszban túlsúlyban lévő gastritis növelje a gyomorrák kockázatát, valószínűleg a gyomor belsejében bekövetkező változások következtében, mint a megemelkedett pH, csökkent aszkorbinsav (AA) és a nitritek eltávolítása és egyéb lehetséges rákkeltő anyagok (8–10).
A bélmetaplázia besorolható „teljes” vagy „hiányos” kategóriába, ahol a teljes bélmetaplázia serleget és abszorpciós sejteket mutat, egyes gyomor-nyálkahártyák expressziójának csökkenése MUC1, MUC5AC és MUC6, de a bél mucin MUC2 expressziója. Ezzel szemben a hiányos bélmetaplázia serleg és oszlopos, nem abszorpciós sejteket expresszál a gyomor és a bél mukinjeiben (11-13). Egyes tanulmányok pozitív összefüggést mutatnak a bélmetaplázia mértéke és a hiányos bélmetaplázia mértéke között, de a rutin diagnosztikában a bélmetaplázia altípusa nem elterjedt.
Újabban a bélmetaplázia harmadik mintázatát írták le, amelyet spazmolitikus polipeptidet expresszáló metapláziának (SPEM) neveznek, amelyet a TFF2 spazmolitikus polipeptid expressziója jellemez, amely oxyntikus atrófiával társul. A gyomortestben megfigyelt bélmetaplázia ezen mintázatáról beszámoltak arról, hogy erősen összefügg a H. pylori fertőzéssel és a gyomorrákkal, és valószínűleg egy újabb utat jelenthet a gyomor neoplazia felé (14). Egy nagyon friss, Tajvanon végzett tanulmány kimutatta, hogy a genomi egy nukleotid polimorfizmusok (ITGA5-1160/ITGB1-1949/ITGB1 + 31804 T/A/C hordozóként és COX-2-1195/IL-10-592 mint G-hordozó/AA ) a gyomorrákos betegek utódainál a H. pylori fertőzés után hajlamosak a SPEM-re, és markerként szolgálhatnak a H. pylori felszámolására nagy kockázatú alanyok azonosítására (15).
A gyomor dysplasia a gyomor karcinogenezisének utolsó előtti szakaszát jelenti. Ezt az elváltozást szövettanilag egyértelmű neoplasztikus hámként definiálják, a szöveti invázió bizonyítéka nélkül (16), amelyet abnormális differenciálódást és rendezetlen mirigy-architektúrát tükröző sejtes atypia jellemez. A gyomor diszpláziáját tehát közvetlen neoplasztikus prekancerózus elváltozásnak kell tekinteni. A Padova, a Bécs és a WHO osztályozások javaslatok a gyomor diszpláziás elváltozások morfológiai spektrumának terminológiájának egységesítésére (17-20).
Az epidemiológiai adatok arra utalnak, hogy az atrófiás gyomorhurut nemcsak a bél típusú gyomorrákhoz, hanem az 1. típusú gyomor karcinoidhoz is társul. A gyomortumorok kialakulásához vezető patofiziológiai mechanizmusok mélyen eltérőek. Amint fentebb említettük, a gyomorrák a H. pylori-val összefüggő gastritistól kezdve az atrófiás gastritisig, a bélmetaplaziaig és a dysplasiaig terjedő többlépcsős folyamat végeredményeként alakul ki (4). Ezzel szemben az 1-es típusú gyomor-karcinoidok gasztrin-függő daganatok. Ezek a daganatok jól differenciáltak, alacsony proliferációs indexük és általában jóindulatú magatartásuk mellett az összes gyomor-karcinoid 80% -át teszik ki (21). Az 1-es típusú gyomor karcinoidok egyik fő patogenetikai tényezője az atrófiás gasztritisz következtében fellépő hypergastrinemia. A gasztrin növekedési faktorként hat az enterochromaffin-szerű sejtek számára, amelyek az atrófiás gastritisben krónikusan proliferálódnak, és a hiperpláziától a dysplasiaig terjedő többlépcsős folyamat révén karcinoid alakulhat ki (21-23).
A gyomor nyálkahártyájában számos esemény fordul elő a gyomorrák vagy az 1-es típusú gyomor karcinoid kialakulása előtt, és ezek az évek több évig is eltarthatnak. Így az atrófiás gasztritisz prevalenciájának ismerete a különböző klinikai körülmények között, annak klinikai jellemzői és az esetleges kockázati tényezők, amelyek ennek az állapotnak a gyomor neoplazmává válásával járnak.
Atrófiás gastritis: epidemiológia és klinikai jellemzők
Az atrófiás gyomorhurut egy krónikus rendellenesség, amely az általános populáció legfeljebb 8% -ában fordul elő, főként az oxyntikus mirigyek sorvadása, ennek következtében a gyomorsav hiányával és késői stádiumban a belső faktor termelésének hiányával. Gyakran megfigyelhető az autoantitestek parietális sejtekkel szembeni pozitivitása és/vagy belső tényező, az autoimmun betegségek kompenzációja pajzsmirigy autoimmun betegségként vagy 1-es típusú cukorbetegségként (24–27). Egy 2008-ban végzett vizsgálatban (27) a vizsgált 319 atrófiás gasztritiszes beteg közül 169-nek (53%) társult pajzsmirigy-rendellenessége, és ezek közül 89 (52,7%) nem tudott róla. A pajzsmirigy betegség autoimmun volt 128 betegnél (75,7%) és nem autoimmun 41 betegnél. A logisztikus regresszió azt mutatta, hogy az autoimmun pajzsmirigy-betegség kialakulásának kockázati tényezői atrófiás gastritisben szenvedő betegeknél a női nem (esélyarány 5,6), a parietális sejt antitestek jelenléte (2,5-es esélyarány) és a metaplasztikus atrófia jelenléte (2,2-es esélyarány) voltak. Ezek az adatok azt mutatják, hogy az autoimmun pajzsmirigy betegség és az atrófiás gyomorhurut szorosan összefüggő módon fordul elő, és azt javasolják, hogy az atrófiás gasztritiszben szenvedő betegeket okkult autoimmun pajzsmirigybetegség miatt kell megvizsgálni, különös tekintettel a nőkre és azokra, akiknek pozitív parietális sejtes antitestjei vannak (27).
Az atrófiás gyomorhurut gyakori klinikai megjelenése a káros anaemia, a B12-vitamin felszívódásából eredő megaloblasztos vérszegénység az intrinsic faktorhiány következményeként (28,29). Az atrófiás gyomorhurut vashiányos vérszegénységgel is járhat, amely a vashiány felszívódásának következménye, a csökkent gyomorsav-szekréció, valamint a normál vagy alacsony kobalaminszint (30,31) következtében, és e betegek egy részénél idővel nyilvánvaló káros kóros vérszegénység alakulhat ki (32). A hasonló gyomor-elváltozásokat hordozó atrófiás gyomorhurutban szenvedő betegek ezen eltérő klinikai bemutatásának okai, amelyek gyakorlatilag B12-vitamin-hiányhoz vezetnek, nem ismertek, és genetikai alapjuk lehet. Egy nemrégiben végzett tanulmány során, amelyben kobalamin felszívódással kapcsolatos egyetlen nukleotid polimorfizmusokat vizsgáltak kóros vérszegénységben szenvedő és anatómia nélküli atrófiás gyomorhurutban szenvedő betegeknél az egészséges kontrollokhoz képest, kimutatták, hogy a transzkobalamin II genetikai változata, amely alacsonyabb B12-vitamin-szinthez kapcsolódik, gyakoribb a károsító vérszegénységben szenvedő betegeknél a kontrollokhoz képest, megmutatva az atrófiás gyomorhurut lehetséges klinikai megnyilvánulását meghatározó genetikai tényezők valószínűségét (33).
A hasi vérszegénységet, az atrófiás gastritis lehetséges végstádiumát autoimmun rendellenességnek tekintik (28,29). A mai napig nincsenek egyértelmű, általánosan elfogadott kritériumok az autoimmun gastritis meghatározására és a klinikai entitás megkülönböztetésére a krónikus H. pylori-vezérelt atrófiás gastritisről. Egy korábbi munkában kimutatták, hogy az autoimmun és a nem autoimmun gastritis megkülönböztetésének elősegítő tulajdonságai hasonlóak voltak, mivel az intrinsic faktor és a parietális sejtek antitestjeivel szembeni pozitivitás, az enterochromaffin-szerű sejtek jelenléte, a káros anaemia és az aktív H. pylori fertőzés hasonlóak voltak corpus-korlátozott atrófiás gastritisben szenvedő betegeknél (az autoimmun gastritis klasszikus szövettani jellemzője) és antral és corporalis atrophiás gastritisben szenvedő betegeknél (főként H. pylori fertőzésnek tulajdonítva), ami azt jelzi, hogy az autoimmun gastritishez társuló specifikus klinikai-szövettani jellemzők messze vannak jól körülhatárolható (31).
Egy nemrégiben készült szisztematikus áttekintés értékelte az atrófiás gasztritisz előfordulását az atrófiás gasztritistól mentes betegeknél a vizsgálatba való felvétel pillanatában (34 A szerzők 14 követő vizsgálatot választottak ki, amelyek során az atrófiás gyomorhurutot szövettan (12 vizsgálat) vagy szérum pepszinogén (két tanulmány) alapján diagnosztizálták. Az atrófiás gasztritisz előfordulási aránya 0 és 10,9% között mozgott évente, valószínűleg azzal magyarázható, hogy az atrófiás gyomorhurut diagnosztizálásra kerültek-e, különös tekintettel a reflux oesophagitisben szenvedő betegekre és a legalacsonyabb incidenciájú H. pylori fertőzésben sikeresen kezelt betegekre (0 %) (35,36) és azoknál a betegeknél, akiknél a legmagasabb előfordulási arányú peptikus fekély miatt vagotomia történt (37). Meta-analízisben a H. pylori pozitív és a H. pylori negatív betegek atrófiás gyomorhurutának előfordulását összehasonlító arányarány 2,4 és 7,6 közötti volt, 5-ös összefoglaló becsléssel (95% CI: 3,1–8,3) (34 ).
Más vizsgálatokban az atrófiás gyomorhurut prevalenciáját szerológiai szűréssel értékelték a gyomor funkciójának helyettesítő markereivel (pepszinogén I vagy pepsinogén I/pepsinogén II arány), vagy gasztroszkópiával/szövettan segítségével. Sok esetben mind a szerológiai, mind a szövettani szűréseket általános populációban végezték. A szerológiai vizsgálatok szerint az atrófiás gasztritisz prevalencia aránya 3% és 7% között volt, amely alacsonyabb volt, mint a szövettani jelentéseknél (38-47). Az ázsiai országokban tapasztalt magasabb atrófiás gasztritisz prevalenciát a gyomorrák nagyobb kockázata indokolhatja ezeken a területeken, valamint az atrófiás gasztritisz diagnózisának eltérő meghatározása a nyugati és az ázsiai országok között. Az ázsiai országokból származó vizsgálatok során az atrófiás gasztritisz diagnózisa az összes atrófiás elváltozást magában foglalta, függetlenül a gyomornyálkahártya (antrum és/vagy korpusz) atrófia lokalizációjától; a nyugati országokban végzett vizsgálatok túlnyomó többségében az atrófiás gyomorhurut diagnózisában csak olyan betegek vettek részt, akiknél corpus atrophia érintett, például corpus-atrophiás gastritis vagy multifokális atrophiás gastritis.
Egy nagyon friss, szerbiai vizsgálat 5284 svédországi résztvevőn (48) dokumentálta az atrófiás gasztritisz prevalenciájának növekedését a 35-44 éves felnőttek körében 22-ről 64/1000-re 1990 és 2009 között, de az atrófiás gasztritisz prevalenciája csökken a résztvevőknél 55 -64 évesek 124-től 49/1000-ig ugyanabban a megfigyelési időszakban. A H. pylori stabilizálódó szeroprevalenciája, valamint a túlsúly és az elhízás növekvő prevalenciája hozzájárulhat ehhez a váratlan tendenciához; vizsgálatokra van azonban szükség annak megállapításához, hogy ezek a változások befolyásolták-e a gyomorrák előfordulását (48).
Atrófiás gyomorhurut és a gyomor neoplazmáinak kockázata
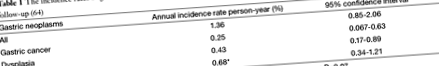
A gyomorrák továbbra is a negyedik leggyakoribb rák világszerte, és a második oka a rákkal kapcsolatos halálozásnak (49). Az atrófiás gyomorhurut gyomorrákká válásának évenkénti 2% -áig terjedő változó sebességét jelentették 1 és 16 év közötti (50-52) követési időszakokban. Egy nemrégiben végzett szisztematikus áttekintés kóros vérszegénységben szenvedő atrófiás gyomorhurutban szenvedő betegeknél összevont gyomorrák előfordulási aránya 0,3% fő/év, és a gyomorrák becsült hétszeres relatív kockázata.
Az 1. típusú gyomor karcinoidok megfigyelését illetően a jelzések még bizonytalanabbak. A daganatok endoszkópos kezelésével foglalkozó nemrégiben készült tanulmány arról számolt be, hogy az atrófiás gastritisben szenvedő betegeknél, akiknek nincs ismétlődő 1-es típusú gyomor-karcinoidja, az endoszkópos kontrollokat évente megtervezhetik a korai nyomon követés során, de valószínűleg 4 évente endoszkópos kontrollokkal kevésbé intenzívebbé válhatnak. atrófiás gasztritisz szűrés a gyomorrák kockázatának szempontjából (62). Az atrófiás gyomorhurutban szenvedő betegek megfigyelésének jobb értékeléséhez és az utánkövetési gyakoriságok megállapításához pontosabb adatokra van szükség a gyomor neoplasztikus elváltozásainak előfordulásáról, lehetőleg nagy, prospektív vizsgálatokban, megfelelő nyomon követéssel (63).
A betegek gyomorrákkal és az 1-es típusú gyomor karcinoidokkal kapcsolatos tulajdonságai eltérnek, összhangban maradva e két daganat típusának különböző patogenetikai mechanizmusaival (4,21). Az 1-es típusú gyomor-karcinoidok előfordulása elsősorban az autoimmun gastritis jellemzőivel, mint káros anémiával és a gyomor autoantitestekkel szembeni pozitívumokkal társul. A gyomorrák ehelyett a H. pylori jelenlétével társul a test nyálkahártyájában (HR 8) (64), összhangban maradva a korpuszban domináns gastritis fogalmával, amelyet az Uemura több mint tíz évvel ezelőtt megfigyelt: H. pylori pozitív a betegek és a súlyos gyomor atrófiában, a korpuszban túlsúlyban lévő gyomorhurutban vagy a bél metapláziában szenvedőknél fokozott a gyomorrák kockázata (9 Az 1. ábra a gyomorrák és a karcinoidok Kaplan-görbéit mutatja a káros vérszegénység vonatkozásában: A károsító vérszegénység jelenléte a gyomor karcinoidjaival társul, a gyomorrákkal azonban nem, mivel a károsító vérszegénységben szenvedő betegeknél a karcinoidoktól mentes túlélés lényegesen rövidebb.
Nyilvánvalóvá vált, hogy a H. pylori mellett más baktériumok is részt vehetnek a gyomor karcinogenezisében; kimutatták, hogy a gyomorrák mikrobiotájában a Streptococcus, Lactobacillus, Veillonella és Prevotella nemzetségek fajai domináltak, bár meg kell határozni e fajok szerepét a gyomorrák kialakulásában (70). A 2. ábra vázlatos áttekintést ad az intragasztrikus közeg változásairól, amelyek valószínűleg atrofiás gyomorhurutban szenvedő betegeknél a gyomorneoplazmák nagyobb kockázatához kapcsolódnak.
Atrófiás gasztritisz és premalignus változások kimutatása
Noha a gyomorrák előfordulása az elmúlt évtizedekben csökkent, különösen a nyugati országokban, a gyomorrák okozta halálozási arány továbbra is magas (71). A premalignus betegségben szenvedő betegek felismerése és megfigyelése, mivel atrófiás gyomorhurut és bélmetaplazia potenciálisan előrehaladott elváltozások - azaz diszplasztikus elváltozások és gyomorrák - felismeréséhez és kezeléséhez vezethet korai stádiumban (72-74). Premalignus betegségben szenvedő betegeknél a gyomorrák kialakulásának kockázata tovább rétegezhető a gyomor atrófia és/vagy metaplázia helye, súlyossága és mértéke szerint (75,76).
Számos szövettani osztályozást fejlesztettek ki az atrófiás gyomorhurut és a preneoplasztikus változások szempontjából. A klinikai gyakorlatban és a kutatásban napjainkig elsősorban a frissített Sydney-rendszert használják. Ez a rendszer ötvözi a topográfiai, morfológiai és etiológiai információkat a szövettani jelentések egységesítése érdekében (77). A közelmúltban az OLGA (operatív kapcsolat a gasztritisz értékeléséhez) és az OLGIM (operatív kapcsolat a gyomor-bél metapláziájához) értékelésre ismert rendszereket javasoltak a gasztritisz stádiumában (78). Sajnos az osztályozásokat még mindig nehéz használni a klinikai gyakorlatban, és gyakran hátrányt jelentenek a megfigyelők közti és megfigyelői közötti fontos variációk (79).
Következtetések
Az atrófiás gyomorhurut és a bélmetaplázia premalignus változások, amelyek a betegek nagy részénél szerencsére soha nem fognak bél típusú adenokarcinómává vagy 1-es típusú gyomor-karcinoiddá válni. Számos erőfeszítést tettek eddig ezekről az állapotokról való ismeretek megszerzése, valamint az atrófiás gyomorhurutot és/vagy bélmetapláziát hordozó betegek kezelésének és felügyeletének optimalizálása érdekében. A közelmúltban beszámoltak arról, hogy a nanoarray-elemzés képes kilégzett lélegzeten keresztül detektálni a rákot megelőző gyomor elváltozásokat és a gyomorrákot, és hogy ez esetleg a hiányzó, nem invazív szűrőeszközt nyújthatja a gyomorrák és a kapcsolódó rákot megelőző elváltozások esetén, valamint a utóbbi (81). Amíg ezek vagy más innovatív eszközök érvényesítésére várnak, fontosabb kérdéseket kell jobban megválaszolni, mivel az autoimmun gastritisben és a káros anémiában szenvedő betegek bevonása a gyomorrák és a karcinoidok nagyobb kockázatának kitett betegek körébe, valamint az optimális időintervallum és költséghatékonyság endoszkópos-szövettani nyomon követés atrófiás gyomorhurutban és bélmetapláziában szenvedő betegeknél.
Köszönetnyilvánítás
Lábjegyzet
Érdekkonfliktusok: A szerzőknek nem jelentenek be összeférhetetlenséget.
- Atrófiás gasztritisz-diéta Prevalencia, okok, tünetek, típusok és kezelés
- A gyomorhurut 5 tünete és a gyomor Erufu ellátásának megelőzése
- Táplálkozási tényezők a gyomor-bél metaplázia kialakulásában funkcionális dyspepticusban
- Sávos Roux-en-Y gyomor bypass by szuper kóros elhízásban szenvedő betegeknél (BRandY-tanulmány)
- Bariatrikus sebészet - laparoszkópos gyomor bypass