Autoimmun hemolitikus anaemia
Absztrakt
Az autoimmun hemolitikus vérszegénység (AIHA) diagnózisát lépésről lépésre lehet felállítani, amelynek célja a hemolízis laboratóriumi és klinikai bizonyítékainak azonosítása, majd a közvetlen anti-globulin teszt segítségével meghatározza a hemolízis immun jellegét. Miután kizárták ezeknek a megállapításoknak az alternatív okait, létrejön az AIHA, és a klinikusnak meg kell keresnie a másodlagos okokat, valamint meg kell határoznia az AIHA típusát. A rituximab ma az elsődleges meleg AIHA és az elsődleges hideg agglutinin betegség (CAD) első vonalbeli kezelése, monoterápiaként vagy bendamustinnal kombinálva. A komplement gátlók hasznosnak bizonyultak az akut súlyos hemolízissel járó AIHA betegek stabilizálásában. A jövőbeni kilátások megvitatásra kerülnek, és magukban foglalják a C1s inhibitor BIVV009-et (sutimlimab), amely most lép be a 3. fázisú CAD-vizsgálatokba.
Tanulási célok
Értse meg, hogyan diagnosztizálható az AIHA és altípusai a klinikai értékelés és a laboratóriumi vizsgálatok kombinációjával
Írja le az elsődleges meleg AIHA és a hideg agglutinin betegség kezelésének legfrissebb eredményeit
Az autoimmun hemolitikus anaemia diagnózisának megközelítése
Az autoimmun hemolitikus anaemia (AIHA) egy dekompenzált szerzett hemolízis, amelyet a gazda immunrendszere okoz a saját vörösvértest-antigénjeivel szemben. Az ezt követő komplement-aktiváció befolyásolhatja a klinikai képet, és a terápiás megközelítések feltörekvő célpontja.
Asztal 1.
Vizsgálatok AIHA-val jelentkező betegeknél
| Elsődleges értékelés | |
| Hemolitikus szűrő | |
| FBC, vérkenet, LDH, haptoglobin, bilirubin, DAT, retikulocitaszám vizelettel vagy anélkül hemosiderin vagy vizelet mérőpálca mikroszkópiához | |
| Az alapbetegségek kimutatása (az AIHA vizsgálata) | |
| Szérum Igs és elektroforézis immunfixálással * | |
| HIV, HBV, HCV | |
| Anti-dsDNS, ANA | |
| CT mellkas, has és medence | |
| Kiegészítő vizsgálat AIHA-val rendelkező kiválasztott betegeknél | |
| Csontvelői vizsgálat | CAD, életkor ≥ 60 év, a történelem jellemzői, vizsgálat, FBC vagy kenet, amely a velő lehetséges infiltrációjára utal |
| U&E, LFT, alvadás, BP, vizeletszintmérő pálca | Ha terhes vagy thrombocytopeniás, a DIC vagy a terhességgel összefüggő TMA kizárására |
| Fertőzésszűrés | A tünetektől, az utazási előzményektől és az életkortól függ |
| Perifériás T-sejt alcsoportok, kreatinin, LFT, alvadás | Minden gyermek és Evans-szindróma gyanúja esetén |
| Parvovírus, hematinika | Ha retikulocitopénia |
| További szerológiai vizsgálat kiválasztott AIHA-s betegeknél | |
| DAggT | Ha DAT pozitív a C3d ± IgG esetében |
| Hideg antitest-titer | Ha DAggT pozitív |
| Monospecifikus DAT IgM, G, A, C3d esetén | Ha DAT-negatív AIHA gyanúja merül fel |
| Vörössejt-eluátum | Ha (monospecifikus) DAT-negatív AIHA gyanúja merül fel |
| Donath Landsteiner | Ha a DAT pozitív a C3d ± IgG és |
| i) DAggT-negatív vagy jelentéktelen CA-k és | |
| ii) Életkor * Ha hideg autoantitest gyanúja merül fel, tartsa a mintát 37 ° C-on a szérum elválasztásáig. |
Hill és munkatársai módosították, engedéllyel. 12.
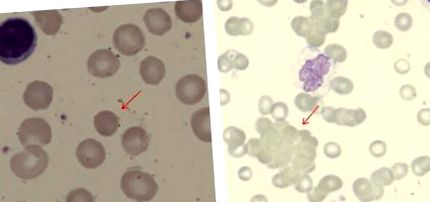
Vérfilmek megjelenése AIHA-ban szenvedő betegeknél (mindkettő May Grunwald Giemsa foltot használ). (A) Spherocyta meleg AIHA-ban szenvedő betegben (eredeti nagyítás, × 100). (B) Vörössejt agglutináció hideg agglutinin betegségben szenvedő betegeknél (× 40).
2. táblázat.
Az intravaszkuláris hemolízis okai
| Komplement-rögzítés (pl.) |
| Paroxizmális éjszakai hemoglobinuria |
| Paroxizmális hideg hemoglobinuria |
| Akut hemolitikus transzfúziós reakciók a nem megfelelő vér miatt |
| Néhány autoimmun hemolitikus vérszegénység, ha a komplement rögzítése lehetővé teszi a terminális komplement aktiválódást (membrán támadás komplex képződés) a vörösvérsejtek felszínén, ami lízist okoz |
| Mechanikus trauma (pl.) |
| Szívbillentyűk |
| Mikrotrombusok forgalomban - DIC, MAHA (TTP, HUS, aHUS) |
| Márciusi hemoglobinuria |
| Mérgező vagy exogén tényezők (pl.) |
| Fertőzések: Babesia, Clostridium, Leptospira, Falciparum malária |
| Pók harap |
| Kígyóméregek |
| Réz vagy cink toxicitás |
| Hipotonikus megoldások |
aHUS, atipikus hemolitikus urémiás szindróma; DIC, disszeminált intravaszkuláris koaguláció; HUS, hemolitikus urémiás szindróma; MAHA, mikroangiopátiás hemolitikus vérszegénység; TTP, thromboticus thrombocytopeniás purpura.
A hemolitikus vérszegénység pozitív DAT-val történő azonosítása után remélhetőleg nyilvánvaló okok lesznek, például egy nemrégiben történt transzfúzióból származó késleltetett transzfúziós reakció, szilárd szervet követő alloimmun hemolízis vagy allogén őssejt-transzplantáció, gyógyszer által kiváltott immun hemolízis vagy az újszülött hemolitikus betegsége klinikai értékelés alapján gyorsan azonosítható. Az alternatívák mérlegelésekor emlékeztetni kell arra, hogy pozitív DAT más folyamatok eredményeként is előfordulhat, például antitestek vagy immunkomplexek passzív lerakódása májbetegségben, krónikus fertőzés, rosszindulatú daganat, szisztémás lupus erythematosus (SLE), vesebetegségek és a következő gyógyszeres terápiák, például IV Ig vagy anti-timocita globulin. Ha nem találnak alternatív okot, fel lehet állítani az AIHA diagnózisát. Az AIHA negatív DAT mellett ritkán fordulhat elő standard technikákkal (pl. Alacsony affinitású antitest vagy csak IgA-antitest miatt). A DAT-negatív AIHA diagnózisa felállítható a hemolízis alternatív okainak gondos kizárása után, és ha lehetséges, egy érzékeny technikával történő megerősítés után, és ezt szteroid terápiára adott válasz is alátámasztja.
A következő lépés egy mögöttes társult állapot vizsgálata, amely a betegek ~ 50% -ában található, valamint további szerológiai tesztek az AIHA típusának meghatározására, mivel a kezelés megközelítése eltér (1. táblázat). Az AIHA javasolt diagnosztikai útját a 2. ábra mutatja, bár felismerték, hogy vannak kivételek (pl. Az alacsony titerű hideg antitest néha klinikailag jelentős lehet). Ezért a végső diagnózishoz szükség lehet a klinikai kép szintézisére és egy speciális referencialaboratórium tanácsára.
Az AIHA diagnosztikai útja. DAggT, közvetlen agglutinációs teszt; DIIHA, gyógyszer által kiváltott immun hemolitikus vérszegénység; HA, hemolitikus anaemia; HDN, az újszülött hemolitikus betegsége; HTR, hemolitikus transzfúziós reakció; PLS, utas limfocita szindróma; RT, szobahőmérséklet. * A CHAD vagy a vegyes AIHA végső diagnózisa az általános klinikai képen alapul, beleértve a szupportív szerológiai eredményeket is. † Például a hőamplitúdó. ** Sóoldatban szuszpendált vörösvértestek és a beteg széruma szobahőmérsékleten 30-60 percig. Hill és munkatársai engedélyével adaptálták. 12.
A betegek körülbelül 65% -ának meleg AIHA-ja van; ez diagnosztizálható konzisztens klinikai képpel és csak IgG esetén pozitív DAT-val rendelkező betegeknél, vagy ha a DAT pozitív C3d ± IgG esetén, ha kizártak egy klinikailag jelentős hideg antitestet.
A hideg agglutinin szindróma (CAS) diagnosztizálható olyan betegeknél, akiknek olyan laboratóriumi kritériumai vannak, amelyek megfelelnek egy klinikailag jelentős hideg antitestnek, amely másodlagos rendellenességekkel, például fertőzéssel, SLE-vel vagy agresszív lymphomával társul.
A vegyes AIHA-t meleg IgG antitest és hideg IgM antitest kombinációja okozza. A DAT általában pozitív IgG és C3d esetén. A megfázással járó tünetek ritkán jelentkeznek, és a hideg antitest alacsony antitest-titerrel bírhat (pl. 4 Felnőtteknél a leggyakoribb asszociáció a hematológiai malignitás, a fertőzés és az autoimmun rendellenességek. Átfogó stratégia az alapbetegség kezelése a legjobbak szerint gyakorlat. A sikeres kezelés javíthatja az AIHA-t is, de ez nem mindig így van, mert az asszociáció ereje változó. Ha a társult állapot nem igényel kezelést, az AIHA általában az elsődleges AIHA-hoz hasonló módon közelíthető meg, bár a kezelési döntések Például, ha az AIHA bizonyos rendellenességekkel, például SLE-vel társul, a splenectomia terhe és előnyei kevésbé kedvezőek az elsődleges meleg AIHA-hoz képest. Evan-szindróma, amelyben az AIHA immun trombocitopéniával (ITP) társul fontos különbségek az elsődleges AIHA-val szemben, a bilineage cytopenia alternatív okainak kizárása tekintetében, azonosítva a másodlagos okokat, például az aut oimmun limfoproliferatív szindróma és annak gyakran relapszáló/remitáló klinikai lefolyásának kezelése.
A B-sejtek rosszindulatú daganatai gyakran társulnak (pl. Az AIHA a krónikus limfocita leukémiában [CLL] szenvedő betegek ~ 5-10% -ában fordul elő). Aktív CLL-ben, amely szintén kezelést igényel, kombinációk, például rituximab, ciklofoszfamid és dexametazon (RCD); rituximab, ciklofoszfamid, vinkrisztin és prednizolon (R-CVP); és a bendamustin és a rituximab (BR) hatásosnak tűnnek. Az új célzott terápiák, mint például az obinutuzumab, az ibrutinib, az idelalisib és a venetoclax, potenciálisan előnyösek lehetnek az AIHA-ban szenvedő betegek számára; azonban éberségre van szükség a gyógyszer által kiváltott immuncytopeniák kialakulásának lehetősége miatt, amint azt korábban a fludarabin egyedüli szerével figyelték meg. 5 Ezt a kérdést az ibrutinib is felvetette, de az ibrutinib-terápia során felbukkanó AIHA a CLL-aktivitás kifejeződésének tűnik, nem pedig a gyógyszer által kiváltott hemolízisnek, és a kezelés alkalmazható olyan betegeknél is, akiknek a kórtörténetében AIHA szerepel. 5,6
Az elsődleges AIHA általános stratégiái
Minden beteg
Kezeljen minden azonosított okot, például fertőzést.
Az eritropoézis fokozódik a hemolízisre adott válaszként, ami fokozottabb keresletet eredményez a folát iránt. A folsav jól tolerálható kiegészítő az anémiát súlyosbító hiányosság megelőzésére.
A transzfúziót igénylő betegek kompatibilitási tesztje a beteg ABO CcDEe és K státuszának, valamint az alloantitestek jelenlétének azonosítására összpontosít. Ez speciális technikákkal érhető el, például auto- vagy alloadszorpcióval (meleg autoantitestek), vagy a sejtek és a beteg plazmájának előmelegítésével külön-külön 37 ° C-ra, mielőtt az indirekt anti-globulin tesztben (hideg autoantitestek) alkalmaznák. 7 A genotipizálás hasznos lehet, különösen összetett esetekben, amikor kívánatos kiterjesztett fenotípushoz illeszkedni. A klinikusoknak tisztában kell lenniük azzal, hogy a teljes kompatibilitási teszt 4–6 órát vehet igénybe, és a kapott egységeket nem fogják „kompatibilisnek” jelölni, mert a módosítatlan beteg plazmából származó autoantitestek valószínűleg megkötik a donor vörössejtjeit egy közvetett anti-globulin teszt keresztezésében. mérkőzés. A kórelőzményben szereplő transzfúzió vagy terhesség nélkül a betegnek aloantitestje valószínűleg nincs. Ha az anaemia életveszélyes, az ABO Rh és K vörösvérsejtek transzfúziója előnyösebb lehet, mint a teljes kompatibilitási tesztre való várakozás.
Vénás tromboembólia profilaxis: a hemolízissel járó trombózis kockázatát még mindig alábecsülik, de továbbra is a morbiditás és a mortalitás egyik fontos oka az AIHA-ban. Néhány sorozatban a vénás tromboembólia a betegek 20-25% -ában fordult elő, általában akkor, amikor a hemolízis aktív volt. Nagyobb vizsgálatok szerint a vénás és artériás trombózis nagyobb arányú volt az AIHA 8,9-ben szenvedő betegeknél, és újabban a kifejezetten CAD-ben szenvedőknél. 10 Talán nem meglepő, hogy a kockázat magasabb LDH-szinttel növekszik (az intravaszkuláris hemolízis és a trombózis kockázatának szerepéről korábban már volt szó 11), valamint a korábbi splenectomiában szenvedő betegeknél. Alacsony molekulatömegű heparinnal végzett tromboprofilaxis ajánlott a hemolízis akut exacerbációjában szenvedő betegeknél, és súlyos exacerbációk esetén ambuláns betegeknél mérlegelni kell (hemoglobin 12
CAD betegek
CAD betegeknél az intravaszkuláris hemolízist bakteriális vagy más lázas betegségek válthatják ki, és haladéktalanul kezelni kell.
A CAD-ben szenvedő betegeknek lehetőség szerint kerülniük kell a hideg időjárást, és a disztális végtagok védelme érdekében felöltözniük.
Kórházban a beteget melegen kell tartani, különösen a perioperatív időszakban. A kardiopulmonális bypass különös kihívást jelent a szisztémás hűtés és a hideg cardioplegia szokásos gyakorlatával kapcsolatban. A szisztémás normotermia és a meleg kardioplegia azonban elismert módszer, és a kiegészítő eculizumabot sikeresen alkalmazták bypass műtétek fedezésére. 13.
A betegeknek nem szabad IV folyadékot kapniuk, ezért ajánlott egy soros vérmelegítő használata.
Szteroidokat kapó betegek
A felső gasztrointesztinális szövődmények fokozott kockázata miatt antacid terápiát, például protonpumpa-gátlót javasolnak a szteroidokat szedő betegeknél, ha van egy további kockázati tényező, például korábbi peptikus fekélybetegség, ≥ 60 éves életkor, egyidejűleg nem szteroid anti - gyulladásos gyógyszer/véralvadásgátló/aszpirin alkalmazása, vagy egyidejűleg kialakuló thrombocytopenia.
A törés kockázata megnő azoknál a betegeknél, akik ≥ 3 hónapig (prednizolon ≥ 7,5 mg/nap) glükokortikoidokat kapnak. Ezeknek a betegeknek ajánlott tanácsot adni az életmód megváltoztatásáról (a dohányzásról való leszokás, az alkoholfogyasztás ≤2 U/d-re történő korlátozása és a rendszeres testsúlyú testmozgás), valamint a napi megfelelő D-vitamin (600-800 NE) és kalcium (1000) fenntartására. -1200 mg) diéta, ha lehetséges, vagy szükség esetén kiegészítők. 14 Ezenfelül ≥40 éves felnőttek esetében a kezdeti abszolút törés kockázatát az online FRAX (https://www.shef.ac.uk/FRAX/tool.jsp) eszköz, valamint a csontásvány felhasználásával kell megbecsülni. sűrűségvizsgálat, ha rendelkezésre áll, annak eldöntésére, hogy orális biszfoszfonátot is fel kell-e írni. Egyes irányelvek azonban azt is javasolják, hogy az 50 évnél idősebb férfiak és a posztmenopauzás nők elégséges kockázatnak vannak kitéve, hogy a kezelés további értékelés nélkül megfontolható legyen. 15
Elsődleges meleg AIHA
Az első vonalbeli szteroidokat kapó betegeknél a választott hosszú távú második vonalbeli kezelés a splenectomia volt. 21 A legutóbbi Egyesült Királyság 12 és francia 22 iránymutatások azonban inkább a rituximabot részesítették előnyben. Ez tükrözi a publikált esetsorok viszonylag nagy számát, amelyek nagyobb biztonságot nyújtanak hatékonyságukban és tolerálhatóságukban. 154 beteg meta-analízisében a meleg AIHA teljes válaszaránya a rituximabra 79% volt, bár nem minden esetben volt elsődleges, és néhányuk egyidejűleg szteroidokat kapott. 23 Rituximabot kapó 364 (14%) AIHA-beteg közül 38-ban fordultak elő mellékhatások, köztük 18 súlyos fertőzés. A válaszadó betegek körülbelül 25-50% -a 2–3-on belül visszaesik, míg a hosszú távú válaszarány nem ismert. 12.
Az elsődleges meleg AIHA-ban szenvedő betegek körülbelül 70% -a reagál a lépmûtétre, 12 és ez továbbra is hasznos másodlagos lehetõség, amikor a gazdasági korlátozások korlátozzák a rituximabhoz való hozzáférést. A splenectomiát követő fertőző és trombotikus szövődmények jól felismerhetők. A kis sorozatok rövid távon ~ 30% -os relapszusra utalnak, 17,25, de az ITP splenectomiájától eltérően a remisszió hosszú távú tartóssága nem ismert. Alternatív, viszonylag nem toxikus immunszuppresszív terápiák, például mikofenolát-mofetil, azatioprin és ciklosporin, szintén alkalmazhatók harmadik vonalbeli kezelésként. A válaszarányokat nehéz megbecsülni, mert a hatékonyság bizonyítékai olyan kis sorozatokra korlátozódnak, amelyek gyakran hiányoznak a részletekből, de valószínűleg alacsonyabbak, mint a rituximab vagy a splenectomia esetén.
Azok a betegek, akik szteroidérzékenyek, de refrakterek vagy kiújultak a harmadik vonalbeli terápiák után, elviselhetik a hosszú távú kezelést alacsony dózisú predniso (lo) ne (≤10 mg) kezeléssel, amelyet szteroidmegtakarító szerrel együtt lehet alkalmazni. 26 A nagyobb toxicitási potenciállal rendelkező alternatívák közé tartozik a ciklofoszfamid, 27,28 alemtuzumab, 29 és a hematopoietikus őssejt-transzplantáció. 30
Mentő terápiák
A betegeknek időbe telhet, hogy reagáljanak az immunszuppresszív terápiára (pl. Meleg AIHA esetén a rituximab esetében a medián 3-6 hét). 12 Ezért súlyos transzfúziótól függő hemolízissel küzdőknek mentő terápiára lehet szükségük. Ez szteroidokkal történhet, ha a betegről ismert, hogy érzékeny. Alternatív megoldásként a betegek körülbelül egyharmada reagál az IV Ig-re, a legsúlyosabb esetekben jobb reakcióval (hemoglobin ≤ 70 g/L). Az AIHA klinikai súlyosságát a velő kompenzációs válasza befolyásolja, és retikulocitopeniát figyeltek meg, különösen gyermekeknél és súlyos esetekben, valószínűleg az erythroid prekurzorok ellen ható autoantitestek következtében. 31 Ez a megfigyelés megalapozza a rekombináns eritropoietin empirikus alkalmazását, amikor a hemolízis súlyos, gyenge retikulocita válasz; a parvovírust, a hematinhiányt és a velő infiltrációját is figyelembe kell venni. Az alkalmatlan betegek sürgősségi splenectomiáját vagy részleges lépembólizációját akutan alkalmazták súlyos hemolízis kezelésére.
Az autoreaktív IgG és IgM előállítható meleg AIHA-ban; az eritrocitához kötődve mindkettő képes megkötni a C1q-et és aktiválni a klasszikus komplement útvonalat. A C1-észteráz inhibitor (C1-INH) a kereskedelemben kapható, kedvező biztonsági profillal rendelkező örökletes angioödéma esetén engedélyezett klasszikus út inhibitora. A C1-INH-t a transzfúzióra adott válasz javítására használták súlyos IgM-es meleg AIHA-ban szenvedő betegeknél. 32 Továbbá 4 CAD vagy kevert AIHA-val rendelkező, valamint C3d-pozitív DAT-os beteg mindegyike reagált a C1-INH BERINERT-re (napi 20 μg/kg 6-20 napig prednizolonnal együtt, rituximabbal vagy anélkül). 33 Bár az adatok ritkák, a C1-INH szerepet játszhat a súlyos hemolízis stabilizálásában, ha a DAT pozitív a C3d szempontjából.
Kilátások a jövőre
Az elsődleges meleg AIHA jövőbeli kilátásai a következők gátlását tartalmazzák:
B-sejtek alternatív anti-CD20 monoklonális antitestekkel (mAb-k) (pl. Obinutuzumab)
A rapamicin emlős célpontja (pl. Sirolimus)
- Autoimmun hemolitikus vérszegénység, amit tudnia kell
- Autoimmun hemolitikus vérszegénység kutyákban VCA Állatkórház
- A vérszegénység az autoimmun betegség kezelésének megszakítója - a Karolinák Holisztikus Wellness Központja
- Vérszegénység - Irodai utasítások - DOCTOR TODAY TLC, LLC
- Vérszegénység kínai orvoslás és annak hiánya; Vér