Az Actovegin-kezelés javítja a patkányok térbeli tanulását és memóriáját átmeneti előagyi ischaemiát követően
Sigal Meilin
egy Neurológiai Szolgálat, MD Biosciences Ltd, Nes-Ziona, Izrael
Fausto Machicao
b Molekuláris genetika és diagnózis, IV. Belgyógyászati Osztály, Egyetemi Kórház, Tübingen, Németország
Martin Elmlinger
c Kísérleti orvostudomány, Biomarker fejlesztés, Takeda Pharmaceuticals International GmbH, Zürich, Svájc
Absztrakt
Ez a tanulmány azt kívánta megvizsgálni, hogy az Actovegin, amely borjúvérből származó deproteinizált ultraszűrő, mutat-e neuroprotektív hatásokat az átmeneti globális agyi ischaemia patkánymodelljében. Negyven Sprague Dawley patkányt négyéres elzáródásnak vetettünk alá, hogy átmeneti globális agyi ischaemiát indukáljunk, majd sóoldattal vagy Actovegin-kezeléssel. Ál-műveleteket végeztek 15 patkányon. Az Actovegin-t (200 mg/kg) vagy fiziológiás sóoldatot 6 órával a nyaki artéria elzáródása után, majd naponta a 40. napig adtuk be. A tanulást és a memóriát két különböző 5 napos periódus alatt értékeltük a Morris vízlabirintus teszt segítségével, és a tapadás erősségét is elvégeztük. a lehetséges motoros károsodások ellenőrzésére. A patkányagyakat szövettani elemzés céljából a 68. napon gyűjtöttük össze. A kontrollokkal összehasonlítva az Actoveginnel kezelt patkányok csökkent késleltetési időt mutattak a rejtett platform eléréséig a vízi labirintus tesztelésének második tanulási kísérletében (46,82 ± 6,18 szemben 27,64 ± 4,53 mp, P Kulcsszavak: actovegin, ischaemia, tanulás, memória, neuroprotekció, stroke
Bevezetés
Az iszkémiás stroke világszerte növekvő klinikai és gazdasági terhet jelent [1,2]. A hosszú távú fogyatékosságok, például a stroke utáni kognitív károsodások (PSCI), gyakran fordulnak elő a stroke után [3], és az összes stroke-betegek legfeljebb 22% -a maradhat klinikailag demens 3 hónappal a kezdeti ischaemiás sértés után [4]. Így az iszkémiás stroke és annak következményeinek folyamatos kezelése sürgősen további vizsgálatokat indokol, különösen azért, mert az Egészségügyi Világszervezet azt tervezi, hogy az agyi érrendszeri megbetegedések a közeljövőben továbbra is a halálozás egyik legfőbb oka [5].
Az ischaemia által kiváltott idegsejtkárosodás patofiziológiájának megértésében a legújabb fejlemények felkeltették az érdeklődést az új neuroprotektív terápiák iránt [6], amelyek potenciálisan megvédhetnek a stroke következményeitől, beleértve a PSCI-t is. Különböző terápiákat értékeltek [7], és bár ezek közül a terápiák közül sok kudarcot vallott a klinikai vizsgálatokban [7,8], a trombolízissel végzett vizsgálatok kimutatták, hogy artériás elzáródást követően menthető penumbra létezik [9]. Ez a megfigyelés felélénkítette a stroke-terápiák terápiás neuroprotektív kutatását.
A stroke patofiziológiája összetett, de a többféle molekuláris esemény bármelyikének gátlása terápiás szerekkel részben megvédheti az agyszövetet a sérüléstől [10]. Például egyre több bizonyíték arra utal, hogy az oxidatív stressz jelentősen hozzájárul az ischaemiás stroke-ot követő megfigyelt idegsejt-pusztuláshoz. Az iszkémiás szövetek reperfúziója szerint a reaktív oxigénfajták (ROS) és a reaktív nitrogénfajták felszabadulását idézik elő a mitokondriumokból [11], ami vér-agy gát működési zavarokat és egyéb káros hatásokat eredményez a környező szövetekben [12,13].
Az Actovegin, amely borjúvérből származó ≤5000 D) deproteinizált ultraszűrőn alapszik [14], jelenleg az egyik olyan kezelés, amelyet egy jó klinikai gyakorlatnak megfelelő, kettős-vak, placebo-kontrollos vizsgálatban vizsgálnak. PSCI (ARTEMIDA; http://clinicaltrials.gov azonosító:> NCT01582854). Klinikai vizsgálatok más betegpopulációkban bebizonyították, hogy az Actovegin javítja a klinikai eredményt mind a diabéteszes polyneuropathiában (DPN) [15], mind a kevert demenciában szenvedő betegeknél [16,17], bár az akut agyi ischaemiára gyakorolt hatását még nem vizsgálták alaposan. Az Actovegin hatásmódját vizsgáló in vitro és in vivo vizsgálatok pleiotróp neuroprotektív és metabolikus hatásokat tártak fel.
Ezekkel a megállapításokkal együtt a streptozotocinnal (STZ) kezelt patkányok kísérletei, amelyek súlyos neuropátiás tüneteket mutatnak, bebizonyították, hogy az Actovegin képes csökkenteni a perifériás idegsejtek degenerációját és javítani azok funkcionalitását. A poli (ADP-ribóz) polimeráz (PARP) aktivitásának változását figyelték meg az Actoveginnel kezelt patkány idegsejtekben, és ezek bekapcsolódtak annak hatásmechanizmusába [18]. Továbbá, in vitro kísérletek primer hippokampusos neuron kultúrák alkalmazásával kimutatták, hogy az Actovegin képes csökkenteni az oxidatív stresszt és az apoptózist, ezáltal növelve a sejtek túlélését [19]. A megfigyelt apoptózis-csökkenés a kappa B (NF-κB) nukleáris faktor modulációjának magába foglalását javasolja [20]. Más vizsgálatok kimutatták, hogy az Actovegin fokozza a glükózfelvételt, az energia-anyagcserét, az oxigénfelvételt és -felhasználást, és hogy molekuláris szinten felgyorsítja a sebgyógyulást [21]. Az ischaemiát követő Actovegin-kezelés sejtes és molekuláris hatásait azonban még nem jellemezték, mivel az eddigi vizsgálatok in vitro modellekre és más betegségmodellekre összpontosítottak, ideértve a diabéteszes polyneuropathiát.
Ezt szem előtt tartva a tanulmány célja az volt, hogy megvizsgálja, vajon az Actovegin neuroprotektálást biztosít-e a globális agyi ischaemia kialakult patkánymodelljében, és ha igen, akkor ez a hatás összefügg-e a kognitív és neurológiai teljesítmény javulásával. Az Actovegin agyi ischaemiát követő hatásainak értékeléséhez a négyéres elzáródás (4-VO) által kiváltott stroke modellt választották ennek a modellnek a modell rendszerévé, mivel ez egy megbízható és széles körben alkalmazott átmeneti globális előagyi ischaemia patkánymodell.
Anyagok és metódusok
Állatok
Ötvenöt hím Sprague Dawley patkányt (amelyeket hasonló vizsgálatokban alkalmaztak [22,23]) ~ 250 g (± 20%) súlyúak voltak. A patkányoknak legalább 5 napot hagytak, hogy hozzászokjanak a környezetükhöz, és táplálékkal (kereskedelmi, steril rágcsáló-étrend) és ad libitum vízzel látták el őket. A tanulmányt a laboratóriumi állatok gondozásával és felhasználásával foglalkozó etikai magatartási bizottság hagyta jóvá. Minden kísérletet az állatjólét maximalizálására tettek, a tudományos érvényesség és integritás megőrzése mellett.
A 4-VO által kiváltott stroke modell
Az eljárás során minden állat maghőmérsékletét rektális szondával (400-as modell; YSI Inc., Yellow Springs, OH, USA) hőmérőhöz (8402-00 modell; Cole-Parmer Instrument Co. Ltd., London) csatlakoztattuk., Egyesült Királyság). Az iszkémiás sértést 37–38 ° C rektális hőmérséklet elérésekor kezdték meg, és ezt a hőmérsékletet az eljárás során folyamatosan tartották.
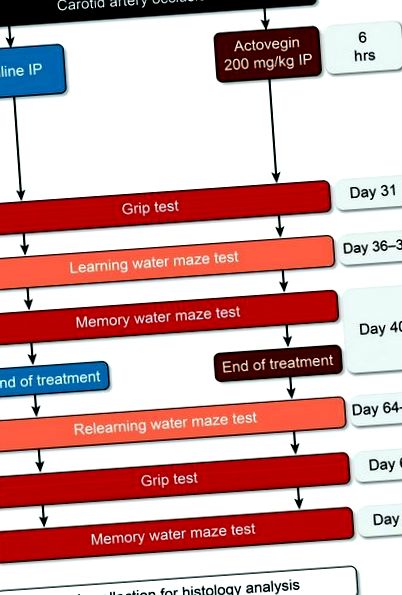
A műtét után a patkányokat véletlenszerűen három kísérleti csoport egyikébe sorolták: álműtött, sóoldatos kezelés vagy Actovegin kezelés. Az aktovegint (200 mg/kg) és a fiziológiás sóoldatot intraperitoneálisan (IP) adtuk be a nyaki artéria elzáródása után 6 órával és naponta egyszer a 40. napig (1. ábra. 1. ábra). Az Actovegin ezen adagját korábban úgy számították ki, hogy egyenértékű legyen a DPN-ben szenvedő betegeknél alkalmazott dózissal, és a klinikai gyakorlatban napi Actovegin-infúziókat írnak elő. Ezenkívül ezt az adagolási rendszert korábban patkány neuropátiás vizsgálatokban is alkalmazták [18].
Tanulmányozza a kísérleti tervet. Az aktovegint (200 mg/kg) és a fiziológiás sóoldatot 6 órával a nyaki artéria elzáródása után adtuk be a 40. napig. Grip tesztet végeztünk a 31. és a 67. napon; a 36–39. és a 64–67. napon megtanultuk a vízlabirintusokat; a memória vízi labirintusokat pedig a 40. és 68. napon végezték.
Morris vízlabirintus
A Morris vízi labirintust azért választották, mert ez az egyik leggyakoribb funkcionális módszer a hippocampus sérülésének felmérésére. A vizsgálat során két Morris-vízlabirintus-periódust hajtottak végre (1. ábra; 1. ábra; 36–40. És 64–68. Nap a carotis carotis elzáródása után) az Actovegin tanulásra és memóriára gyakorolt hatásainak értékelése céljából. Raz et al. [28] által korábban leírt módosított protokoll szerint végeztük, és az Actoveginnel kezelt patkányokat összehasonlítottuk sóoldattal kezelt és álműtött patkányokkal. A kiválasztott időpontokban az Actovegin a neuronális sérülés stacionárius fázisa [29], nem pedig a magas gyulladásos aktivitás szintje alatt [30].
A patkányokat egy standardizált, 1,2 m átmérőjű, 120 másodpercig vízzel töltött medencébe vezettük. vagy amíg nem találnak 1 cm-re rejtett emelvényt a víz felszín alatt. A medence helyiségében számos vizuális jelzéssel látták el, hogy a patkányok térben navigálhassanak a víz labirintusában. Pontosabban, az egyik csövet keletről nyugatra helyezték el az északi falon, egy „X” jelölést a déli falon, egy második csövet a mennyezettől a padlóig a nyugati falon, a bejárati ajtót pedig a keleti fal. A rejtett emelvényt megtaláló patkányok 10 másodpercig maradhattak rajta, és azok a patkányok, amelyek 120 másodpercen belül nem találták meg a platformot. 10 másodpercre az emelvényre helyeztük. A patkányoknak két kísérletet engedélyeztek a rejtett platform megkeresésére, és ezt a tanulási tesztet 4 napos időtartamon keresztül hajtották végre (36–39. Nap és 64–67. Nap; 1. ábra). 1). A memória teszteket (próbakísérleteket) az ötödik napon (40. és 68. nap) hajtották végre, ekkor a rejtett platformot eltávolították, és a patkányokat egyetlen 60 másodpercig a medencébe helyezték. próba. Az egyes patkányok által eltöltött időt abban a negyedben, ahol korábban a rejtett emelvény volt, rögzítette egy megfigyelő, akit elvakítottak a kísérleti csoportok felé.
A Morris-vízlabirintust használták annak értékelésére, hogy a patkányok mennyire emlékeztek a rejtett emelvény helyére, és hogy megtanultak-e a megfelelő kvadráns felé navigálni. A Morris vízi labirintus tesztek második sorozatát (64–68. Nap) végezték annak felmérésére, hogy az Actovegin hatásai fennmaradnak-e a kezelés abbahagyása után, és ezért lehetnek-e betegségmódosító tulajdonságai.
Grip tesztelés
Kontrollként tapadásvizsgálatot végeztek a patkányok izomerőjének objektív számszerűsítésére. A markolat erősségmérője (Cat # 47200; Ugo Basile Srl, Monvalle Varese, Olaszország) a 2. napon kétszer mérte meg az egyes patkányok mellső tapadási szilárdságát, hogy megkapja az alapértéket, és ismét a 31. és 67. napon (1. ábra 1. Röviden: a patkányokat finoman fogva tartották a farkuknál, mielőtt rács tetejére helyezték őket, hogy elülső mancsuk megfoghassa az erőmérőt. A patkányokat ezután hátrafelé húzták, amíg már nem tudtak tartani a mérőn, ezzel megmérve a maximális tapadási erőt.
Szövettani elemzés
A 4-VO modell által okozott idegkárosodás kvantitatív szövettani mérésekkel értékelhető. Jelen tanulmányban meghatároztuk a hippocampal cornu ammonis 1 (CA1) piramissejtek túlélését. A vizsgálat végén (68. nap) a patkányokat pentobarbitál-nátriummal (> 100 mg/kg IP) leöltük, majd sóoldattal és 4% formaldehiddel perfundáltuk a bal kamrán keresztül. Az agyakat formaldehidben utólag rögzítettük további legalább 72 órán keresztül. A patkány agyi blokkjait standard paraffin beágyazási technikákkal készítettük. A szövetbeágyazás után 5 μm-es hippokampusz metszeteket kivágtak, haematoxilinnal és eozinnal festettek, és a túlélő (azaz életképes) sejtek standard elemzésével [31] vizsgálták meg azokat a megfigyelőket, akiket elvakított a kísérleti körülmények között. A hippocampalis CA1 régió kvantitatív szövettani elemzéséhez a régiót három területre osztottuk. Minden területen megszámolták a normálisnak tűnő CA1 neuronokat, és mindhárom terület összege képviselte a normális CA1 neuronok régiónkénti összes számát.
Ezt az elemzést követően az összes paraffinba ágyazott blokkot a későbbi elemzésig tároltuk.
Statisztikai analízis
Az adatokat Student-féle t-teszttel (Prism V 4.0; GraphPad Software Inc., La Jolla, Kalifornia, USA) és egyirányú anovával, majd Tukey több összehasonlító elemzésével elemeztük. P (2. ábra) 2) azt mutatta, hogy az Actovegin-kezelés védett a CA1 sejtpusztulás ellen. A kontrollokhoz képest az Actovegin-kezelés szignifikánsan megnövelte az életképes sejtek átlagos számát (bal agyfélteke, 332 ± 27, szemben az Actovegin-tel szemben - 166 ± 50 sejtek, szemben a sóoldattal kezelt patkányokban, P 3. ábra). 3). Az egyes állatok közötti neuroprotekció mértéke változó volt, de szignifikáns maradt a csoportok között.
Haematoxilinnal és eozinnal festett paraffinba ágyazott agyszelvények mikroszkópos felvételei. A dobozos CA1 almező szakaszok nagyobb nagyítással jelennek meg (B, D, F és H), és megszámolták az életképes idegsejtek számát ezeken a területeken. (A és B) a sóoldattal kezelt kontroll patkányokban a CA1 neuronok majdnem teljes elvesztését mutatják. (C és D) a CA1 neuronok majdnem teljes megőrzését ábrázolja egy Actoveginnel kezelt patkányban. (E és F) a CA1 neuronok részleges megőrzését mutatják Actoveginnel kezelt patkányokban. (G és H) ép CA1 idegsejteket mutatnak ál-operált patkányban.
Hippocampal CA1 piramissejtek túlélése. Az adatokat átlagként ± az átlag standard hibáiként mutatjuk be (* P 4. ábra). 4). A tanulási meredekségeket a 40. napon számoltuk ki, és megerősítették, hogy az Actoveginnel kezelt patkányok szignifikánsan megnövekedett tanulási arányt mutatnak a sóoldattal kezelt patkányokhoz képest (P = 0,019; 5. ábra 5. ábra).
- A súlycsökkenés javítja a memóriát és megváltoztatja az agyi aktivitást a túlsúlyos nőknél - ScienceDaily
- Súlygyarapodás a pajzsmirigy túlműködés után Gyakori a kezelés
- A tranziens receptor potenciális 1-es típusú vanilloid csatorna szabályozza az étrend által kiváltott elhízást, az inzulint
- Súlykontroll és elhízás kezelése és kezelése Cleveland Clinic
- Súlygyarapodás a hyperthyreosis kezelése után - PubMed