Az alacsony fehérjetartalmú étrend gátolja a húgysavszintézist és csillapítja a vesekárosodást a streptozotocin által kiváltott diabéteszes patkányokban
Jianmin Ran
1 Endokrinológiai Osztály, Guangzhou Vöröskereszt Kórház, Jinan Egyetem Orvosi Főiskola, No. 396 Tong Fu Zhong Road, Kanton 510220, Kína
Jing Ma
1 Endokrinológiai Osztály, Guangzhou Vöröskereszt Kórház, Jinan Egyetem Orvosi Főiskola, No. 396 Tong Fu Zhong Road, Kanton 510220, Kína
Yan Liu
2 Nefrológiai Osztály, Guangzhou Vöröskereszt Kórház, Jinan Egyetem Orvosi Főiskola, No. 396 Tong Fu Zhong Road, Kanton 510220, Kína
Rongshao Tan
3 Klinikai Táplálkozástudományi Intézet, Guangzhou Vöröskereszt Kórház, Jinan Egyetem Orvosi Főiskola, No. 396 Tong Fu Zhong Road, Guangzhou 510220, Kína
Houqiang Liu
1 Endokrinológiai Osztály, Guangzhou Vöröskereszt Kórház, Jinan Egyetem Orvosi Főiskola, No. 396 Tong Fu Zhong Road, Kanton 510220, Kína
Gancheng Lao
1 Endokrinológiai Osztály, Guangzhou Vöröskereszt Kórház, Jinan Egyetem Orvosi Főiskola, No. 396 Tong Fu Zhong Road, Kanton 510220, Kína
Absztrakt
1. Bemutatkozás
A diabéteszes nephropathia (DN) ma már a végstádiumú vesebetegség vezető oka az 1-es vagy a 2-es típusú cukorbetegségben. Oly sok éven át terápiás stratégiák sorát kutatták fel, ideértve a szoros glükóz- és vérnyomásszabályozást, a renin-angiotenzin blokádot [1] és a lipidszint csökkentést [2]. Sajnos ezek a kezelések csak lassítják a vese progresszióját, nem pedig megfordítják a haladást [3]. Újabb, módosítható tényezőket kell keresni a DN-re.
A közelmúltban egyre több tanulmány bizonyította, hogy a hyperuricemia szorosan összefügg a DN progressziójával. Keresztmetszeti vizsgálatban Tseng [4] független összefüggést igazolt a szérum húgysav (UA) és a vizeletalbumin kiválasztása között tajvani 2-es típusú cukorbetegeknél. A másik kohorszos vizsgálatban Hovind et al. [5] megállapította, hogy az UA-szint nem sokkal az 1-es típusú cukorbetegség kialakulása után önállóan megjósolja a DN kialakulásának kockázatát egy medián 18 éves követés során. Egy állatkísérletben [6] a diabéteszes (db/db) egerek tubulointerstitialis károsodása jelentősen enyhült az allopurinollal 8 hétig tartó kezelés után. Klinikailag az allopurinol terápia 12 hónapig krónikus vesebetegségben (CKD) szenvedő hiperurikémiás betegeknél jelentősen csökkenti a szérum húgysav (SUA) szintjét és megőrzi veseműködésüket [7]. 4 hónapig allopurinollal is, Momeni et al. [8] bebizonyította, hogy a DN típusú 2-es típusú cukorbetegeknél a vizelet albumin kiválasztása jelentősen csökken.
Annak ellenére, hogy hatékony az SUA csökkentésére, az allopurinol valószínűleg nyilvánvaló mellékhatásokkal rendelkezik, például súlyos bőrallergiával. Tehát a hypouricemiás szerek nem biztos, hogy optimálisak a hosszú távú alkalmazásra a DN megelőzésében. Megalapozott, hogy az alacsony fehérjetartalmú étrend (LPD) beavatkozása hatékonyan és biztonságosan csillapítja a vesekárosodást és késlelteti a vesefunkció romlását a CKD-s betegeknél [9]. Mégis, az LPD hatása a DN progressziójára ellentmondásos [10]. Eközben nincs bizonyíték arra, hogy az LPD bármilyen hatást gyakorolna az endogén UA anyagcserére, és ennek megfelelően javítaná a DN vagy a CKD kimenetelét. Ezért a jelen tanulmányban megvizsgáltuk az LPD hatásait az in vivo UA szintézisére és clearance-ére, valamint annak lehetséges hatásait a vesepatológiára streptozotocin (STZ) által indukált diabéteszes patkányokban, amely a cukorbetegség és a DN kialakult állatmodellje.
2. Anyagok és módszerek
2.1. Állatok előkészítése
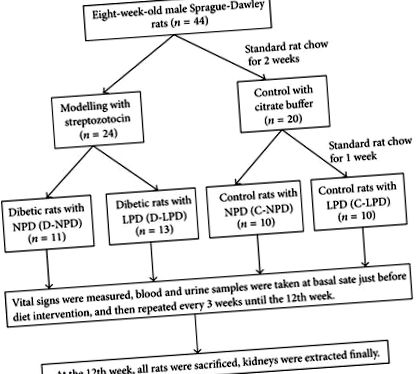
Az állatkísérletek intakt protokollját vázlatosan az 1. ábra mutatja. Konkrétan nyolc hetes Sprague-Dawley patkányokat (Guangdongi Orvosi Laboratóriumi Állatközpont, Kína) 180-230 g tömegű örökbefogadással fogadtak el. Negyvennégy patkányt csoportosan elhelyeztek (2 patkány ketrecben), és két hétig etették standard patkánytojással, majd randomizálták a diabéteszes (n = 24) és a kontroll (n = 20) csoportba. A cukorbetegség kialakulásához a patkányoknak intraperitoneálisan injekciózták az STZ-t (50 mM citrátban oldva (PH = 4,2, Sigma, St. Louis, USA)) egyetlen 65 mg/kg dózisban; azokat, akiknek a vércukorszintje véletlenszerűen meghaladja a 16,7 mmol/l-t három különböző időpontban, kiválasztottuk a kísérletekhez. A kontroll patkányokat csak intraperitoneálisan injektáltuk azonos térfogatú citrátpufferrel.
Az általános állatkísérlet vázlatos protokollja. NPD: normál fehérjetartalmú étrend, LPD: alacsony fehérjetartalmú étrend.
2.2. Diéta beavatkozás és állatkísérletek
A modellezés után egy héttel a patkányokat további négy étrendcsoportba soroltuk: cukorbeteg patkányok normál fehérjetartalmú étrenddel (D-NPD, n = 11), cukorbeteg patkányok LPD-vel (D-LPD, n = 13), kontroll patkányok normál fehérjetartalmú étrenddel (C-NPD, n = 10), és a kontroll patkányokat LPD-vel (C-LPD, n = 10). A normál fehérjetartalmú étrend (NPD) csoportba tartozó patkányokat 65% szénhidrátot, 17% zsírt és 18% fehérjét tartalmazó ételekkel etették, míg az LPD csoport élelmiszerei 78% szénhidrátból, 17% zsírból, és a fehérje 5% -a (Guangdong Medical Laboratory Animal Center, Kína). A teljes kalória/gramm étel megegyezett az NPD és az LPD között (3,95 Kcal/g). Az étrendi beavatkozás a modellezést követő 12 héten belül folytatódott, az életjeleket, a vér- és vizeletmintákat 3 hetente gyűjtöttük a kísérlet végéig.
Az életjeleket, beleértve a szisztolés vérnyomást, a diasztolés vérnyomást és a pulzusszámot, teljesen tudatos patkányokban rögzítették közvetett farok-mandzsetta berendezéssel (LE5002, Harvard Apparatus, USA). Miután a patkányokat 20 percig 37 ° C-os lemezen előmelegítettük, feljegyeztük az egyes patkányok vérnyomását és pulzusát.
Az egész kísérlet során minden patkány szabadon hozzáférhetett élelmiszerekhez és vízhez; a szoba fénye 12 órás világos-sötét ciklusban forgott. Huszonnégy órás vizeletet gyűjtöttünk és számszerűsítettünk a kísérleti nap előtt, míg a patkányokat speciális metabolikus ketrecekben etettük. A kísérlet reggelén az ételeket minden művelet előtt 12 órával kivonták. A patkányokat 12 w diétás kezelés után feláldoztuk; a veséket eltávolították szövettani és immunhisztobiokémiai vizsgálatok céljából. Az összes állatkísérletet a Jinan Egyetem etnikai bizottsága hagyta jóvá.
2.3. Biokémiai vizsgálatok
A glükóz, a triglicerid, az összes koleszterin, a húgysav (SUA), a karbamid-nitrogén (BUN) és a kreatinin (SCr) szérumkoncentrációit megfelelő kereskedelmi készletekkel mértük automatikus biokémiai gépen (ECHO, ECHO, Olaszország). Huszonnégy órás vizeletmintákat gyűjtöttünk és számszerűsítettük. A vizelet húgysavat (UUA), a vizelet karbamid nitrogént (UUN) és a vizelet kreatinint (UCr) azonos automata készülékkel detektáltuk. A vizeletalbumint meghatároztuk a standard bróm-krezol-zöld módszerrel, majd kiszámítottuk a 24 órás vizelet-albumin kiválasztást (UAE).
2.4. Vesemorfológia
Az összes patkány veséjét eltávolítottuk és 4% paraformaldehidben rögzítettük, majd paraffinba ágyazottuk, és 2 μm-es metszetekre vágtuk. A metszeteket a rutin Hematoxylin és Eosin festési módszerrel festettük. Az összes diát digitalizálták és feldolgozták egy speciális számítógépes rendszerrel (BX41, Olympus, Japán).
A glomeruláris terület a kapilláris hurok körvonala mentén határos volt, és az átlagos glomeruláris területet (MGA) 15 glomerulusból határoztuk meg. Az egyes csoportok mezangiális kiterjedésének mértékét az egyes proliferációs fokok pontszámainak összegeként számoltuk ki [11]. A tubuláris károsodást a tubuláris hámsejtek hyalin degenerációjának mértéke szerint értékeltük, és mindegyik csoportban kvantitatív pontozással értékeltük a korábban leírtak szerint [12].
2.5. Immunhisztokémia
A glomerulusokban és a tubulusokban a tumor nekrózis faktor α (TNF-α) és a vaszkuláris endoteliális növekedési faktor (VEGF) sejtes expresszióit immunhisztokémiai vizsgálatokkal detektáltuk. A paraffinba ágyazott részeket paraffinoltuk és hidratáltuk; az endogén peroxidáz aktivitást teljesen gátolta 3% perhidrollal végzett inkubálás. Ezután standard kétlépcsős immunoperoxidáz festést hajtunk végre, és negatív kontrollokat állítunk be úgy, hogy az egyes primer antitesteket PBS pufferrel helyettesítjük. A TNF-α és a VEGF elsődleges antitestjei mind a nyúl poliklonális származékai voltak (BOSTER BIO-ENGINEERING, Wuhan, Kína). A foltos glomerulusokat és a tubulusokat ezután szemkvantitatív módon barnarészecskékből osztották ki a számítógéppel támogatott fénymikroszkóppal (BX41, Olympus, Japán) 1–4 skálán [13]: egyetlen intracelluláris barnarészecskét sem ítéltek negatívnak, és 1-gyel értékelték, A világosbarna szemcsék a sejtek kevesebb, mint 10% -ában 2, a mérsékelt vagy sötét barnás szemcsék a sejtek több mint 60% -ában 4 pontot kaptak, mások pedig 1-3 között minden bizonnyal 3 pontot kaptak. Az összes pontszámot végül minden csoport összes patkánya.
2.6. Statisztikai analízis
Asztal 1
Átlagos napi táplálékfelvétel, vízfogyasztás és vizeletmennyiség egy patkány számára az étrendi beavatkozást követő teljes időszakban.
| C-NPD | 11. | 15,9 ± 5,0 | 24 ± 5 | 9 ± 6 |
| C-LPD | 13. | 20,4 ± 4,1 | 25 ± 4 | 9 ± 2 |
| D-NPD | 10. | 29,1 ± 6,7 † | 127 ± 24 † | 93 ± 32 † |
| D-LPD | 10. | 35,7 ± 7,4 † ∗ | 174 ± 30 † ∗ | 98 ± 38 † ∗ |
Az adatokat átlag ± SD-ben fejezzük ki. † P 2. ábra), a testtömeg normális vagy diabéteszes patkányokban növekvő tendenciákat mutatott (P 0,05), és összehasonlítható volt normál és cukorbeteg patkányok között. Az NPD és az LPD nem volt szignifikáns hatással ezekre az életjelekre sem normál, sem cukorbeteg patkányokban (2. ábra).
Szintén a 3. ábra mutatja, hogy az STZ által kiváltott diabéteszes patkányok a modell modellezésétől a vizsgálat végéig szignifikánsan alacsony triglicerid- és teljes koleszterinszintet mutattak, de az LPD tovább csökkentette a trigliceridet a teljes koleszterinszint helyett ezekben a patkányokban. A kontroll patkányokban az LPD lipidprofilokra gyakorolt hatását nem találták.
A BUN és az SCr, a veseműködési funkciót tükröző két paraméter, szintén figyelemre méltóan megnőtt a diabéteszes patkányokban a modellezés után, de a 6. héttől kezdve viszonylag állandóak voltak. A diabéteszes patkányokban a BUN és az SCr legmagasabb plazmaszintje 11,7 mmol/l, illetve 88,1 μmol/l volt. Az LPD nem enyhítette mindkét paramétert sem cukorbeteg patkányokban, sem kontroll patkányokban (3. ábra).
3.3. Napi vizeletürítés
Amint a 4. ábra mutatja, a napi UAE jelentősen megnőtt a cukorbeteg patkányokban a modellezés után, és állandó maradt a kísérleti folyamat során. Az LPD szignifikánsan gyengítette a magas UAE-t cukorbeteg patkányokban, és semmilyen hatása nem volt a kontroll patkányokban.
24 órás vizeletürítés időtartama különböző patkánycsoportok között. A folytonos kör, folytonos és szaggatott vonalakkal a C-NPD és a C-LPD csoportot jelöli, míg a folytonos és szaggatott vonallal rendelkező üreges kör a D-NPD és a D-LPD csoport adatait mutatja. Az adatokat átlag ± SD-ként fejeztük ki. † P 5 (a) és 5 (b), vagy NPD-vel (5. ábra (a) - (B)), vagy LPD-vel (5. ábra (a) - (D) ábra) táplált cukorbeteg patkányok súlyosabb mesangiális tágulatot mutattak, mint a kontroll patkányok (5. (a) - (A) és 5. (a) - (C) ábra). Az átlagos glomeruláris terület diabéteszes patkányokban is megnövekedett (5. ábra (d)). Az LPD csak a mezangiális terjeszkedést akadályozta meg (5. (a) - (C) és 5. (b) ábra) és csökkentette a glomeruláris méretet (5. ábra (d)) normál patkányokban, miközben ezekre a változásokra nem gyakorolt hatást cukorbeteg patkányokban ( 5. (a) - (D), 5. (b) és 5. (d) ábra).
3.6. A citokinek expressziója
Immunhisztokémiai festéssel két, a diabéteszes vesekárosodásban kialakult citokint, a TNF-α és a VEGF-et detektáltuk. Amint a 6. (a) ábrán látható, a tubulointerstitialis területen a TNF-α expresszió nagyobb arányban volt diabéteszes patkányokban (6. (a) - (B) és 6. (a) - (D) ábra), mint kontroll patkányokban (6. ábra (a) - (A) és 6 (a) - (C). Az LPD szignifikánsan gátolta a TNF-α expressziót diabéteszes patkányokban (6. (a) - (D) és 6. (b) ábra), de kontroll patkányokban nem (6. (a) - (C) és 6. (b) ábra). A másik oldalon, amint azt a 6. (c) és 6. (d) ábra mutatja, a VEGF véletlenül expresszálódik bizonyos arteriolák körül. Nem volt különbség a VEGF expressziójában a cukorbeteg és a kontroll patkányok között. Az LPD mindkét fajta patkányban nem változtatta meg a kifejezéseit.
Az LPD hatása a tumor nekrózis faktor α (TNF-α) és a vaszkuláris endoteliális növekedési faktor (VEGF) expressziójára a glomerulusokban és a tubulointerstitiumban. (a) TNF-a immunhisztokémiai festése. A TNF-α főleg a tubulointerstitialis területen expresszálódott kontroll vagy diabéteszes patkányokban. A kontroll patkányokkal ((A), (C)) összehasonlítva a diabéteszes patkányok ((B), (D)) bőségesebb TNF-a-t (barna színt) expresszáltak ezen a területen. Az LPD csak a diabéteszes patkányokban (d) csökkentette szignifikánsan a TNF-α expressziót, de a kontroll patkányokban (C) nem. (b) A TNF-α expressziójának mennyiségi pontszáma tubulointerstitiumban. (c) A VEGF immunohistobiokémiai festése. A VEGF esetenként bizonyos arteriolák körül expresszálódik. A diabéteszes patkányok ((B), (D)) összehasonlítható VEGF-et fejeztek ki, mint a kontroll patkányok ((A), (C)). Az LPD nem gyakorolt hatást a VEGF expressziójára sem kontroll (C), sem diabetikus patkányokban (D). (d) A TNF-α expresszió kvantitatív pontszámai az arteriolák körül. A (B) és (D) pontokban az NPD mint (□), az LPD pedig (■). † P Reeves WB, Rawal BB, Abdel-Rahman EM és mtsai. Terápiás módok a diabéteszes nephropathiában: jövőbeli megközelítések. Open Journal of Nephrology. 2012; 2 (2): 5–18. [PMC ingyenes cikk] [PubMed] [Google Tudós]
- Alacsony purintartalmú diéta a vér húgysavszintjének emelkedéséhez - Times of India
- A magas diétás fehérje növeli a magas vérnyomást és a vesekárosodást a Dahl SS patkányokban, növelve
- Magas rosttartalmú; Fehérje étrend menük mindennapjaink
- Magas fehérjetartalmú étrend - Almased®
- Magas fehérjetartalmú étrend 5 diétás tipp a fehérje feltöltésére télen - NDTV Food